脊柱骨折“集簇现象”的诊断和治疗:1例报道及文献回顾
2018-12-29王牧川边焱焱张嘉
王牧川 边焱焱 张嘉
(中国医学科学院北京协和医学院北京协和医院骨科,北京100730)
脊柱骨折“集簇现象”即8个月内出现5个节段,以上的自发性胸椎和(或)腰椎骨折,是一种罕见的与骨质疏松相关的多发椎体骨折现象。目前关于上述“集簇现象”的文献报道极少,然而该现象一旦发生后果非常严重,应引起足够的重视。本文回顾性分析1例发生“集簇现象”患者的诊治过程,并对相关文献进行回顾,探讨这一现象发生的可能危险因素以及防治方案,为临床诊疗工作提供借鉴。
1 临床资料
1.1 一般资料
患者,男,62岁,因2周前无明显诱因出现持续性腰背部疼痛并翻身困难于我院就诊(2017年2月)。患者6个月前不慎扭伤腰部后出现腰背部疼痛,3个月前起床后感觉腰背部疼痛加重,视觉模拟评分(visual analytic score,VAS)6~7分,伴活动困难,于当地医院行胸椎、腰椎MRI示“T8、T10、T12、L2椎体压缩性骨折”(图1)。当地医院给予“T8、T10、T12、L2经皮椎体后凸成形术(percutaneous kyphoplasty,PKP)”治疗,并予口服钙剂与活性维生素D,术后腰背部疼痛明显改善,胸椎、腰椎正侧位X线片示骨水泥位置可(图2)。
2015年9月,患者因突发右眼睑下垂于我院神经内科就诊,诊断为“重症肌无力”,给予口服泼尼松持续治疗,起始剂量为45 mg/d,口服2周后加量至90 mg/d,并持续该剂量6个月,之后逐渐减量,截至本次就诊共口服泼尼松1年半,当前剂量为20 mg/d。服用激素初期:β-胶原降解产物(beta collagen degradation products,β-CTX)0.27 ng/ml(0.26~0.51 ng/ml);总25-羟维生素D 12.3 ng/ml(8.0~50.0 ng/ml);股骨颈、全髋骨、L1、L2、L3、L4骨密度,T值分别为-1.3、-1.5、-0.8、-0.4、-1.0、-0.4。2016年12月,股骨颈、全髋骨、L1、L2、L3、L4骨密度,T值分别为-1.5、-1.9、-1.1、-1.4、-0.7、-1.0。既往高血压、糖尿病史10余年,自行药物控制良好。
入院检查:VAS 8分,脊柱T7-T8水平压痛及叩击痛(+),椎旁肌无明显压痛,四肢及躯干感觉、肌力正常,深浅反射正常对称,病理征未引出。全脊柱正侧位X线片(图3A)及胸腰段MRI(图3B)均提示新发压缩性骨折(T7)。股骨颈、全髋骨、L1、L3、L4骨密度,T值分别为-1.5、-1.9、-1.9、-1.0、0.1。各项骨代谢指标:碱性磷酸酶(ALP)56 U/L(15~40 U/L),甲状旁腺素(PTH)28.8 pg/ml(12.0~68.0 pg/ml),总25-羟维生素D 26.2 ng/ml(8.0~50.0 ng/ml),1,25双羟维生素D3 22.72 ng/ml(19.6~54.3 ng/ml),β-CTX 0.38 ng/ml(0.26~0.51ng/ml),骨钙素1.36ng/ml(1.8~8.4ng/ml)。双下肢彩超示右小腿肌间静脉血栓。
诊断:①脊柱骨折“集簇现象”;②脊柱新发压缩性骨折(T7);③脊柱陈旧压缩性骨折(T8、T10、T12、L2);④激素诱导性骨质疏松症(glucocorticosteroid-Induced osteoporosis,GIOP);⑤重症肌无力;⑥右小腿肌间静脉血栓;⑦2型糖尿病;⑧高血压。
1.2 治疗方法
由于患者背痛明显,严重影响正常生活,患者长期使用激素,骨质疏松明显,骨折自行愈合能力较差,且既往高血压、糖尿病史多年,并有下肢肌间静脉血栓,卧床保守治疗出现相应并发症风险高,经讨论后,决定行T7椎体PKP治疗。

图1 第1次手术前的影像学资料

图2 第1次手术后的影像学资料
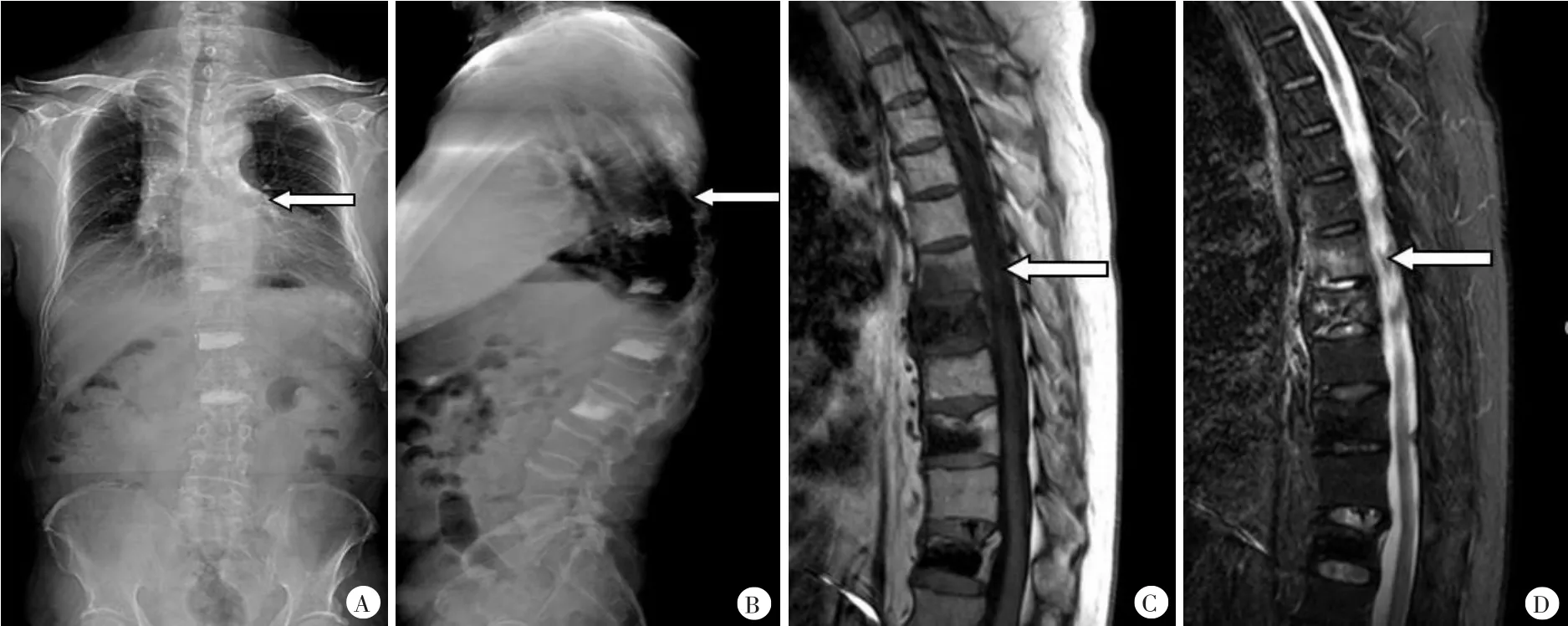
图3 第2次手术前影像学资料
术后予碳酸钙每日3次,每次600 mg;骨化三醇每日2次,每次0.25 μg;皮下注射特立帕肽每日3次,每次20 U(图5A、B)。术后2个月时各项骨代谢指标:ALP 54 U/L,PTH 15.5 pg/ml,总 25-羟维生素 D 27.8 ng/ml,β-CTX 0.372 ng/ml。术后 4 个月时各项骨代谢指标:ALP 44 U/L,PTH 15.7 pg/ml,总25-羟维生素 D 26.2 ng/ml,β-CTX 0.358 ng/ml。股骨颈、全髋骨、L1、L3、L4骨密度,T值分别为-1.7、-1.8、-0.6、-0.5、0.7。术后6个月时各项骨代谢指标:ALP 47 U/L,PTH 17.6 pg/ml,总 25-羟维生素 D 34.2 ng/ml,β-CTX 0.288 ng/ml。股骨颈、全髋骨、L1、L3、L4骨密度,T值分别为-1.6、-1.8、-0.1、-0.4、0.1(图5C、D)。
2 讨论
1993年,Kaplan等[1]将8个月内出现5个节段以上自发性胸椎和(或)腰椎骨折的现象定义为“集簇现象”。“集簇现象”在临床中较为罕见,相关报道极少。Sun等[2]报道了1例63岁的女性GIOP患者,在第1次出现腰椎压缩性骨折后行经皮椎体成形术(percutaneous vertebro plasty,PVP)治疗,术后4个月内出现了椎体骨折的集簇现象,共11个节段的椎体发生压缩性骨折,最终患者共经历了6次手术。Donovan等[3]也报到了1例L2椎体压缩性骨折患者行PVP后1周内出现了T11-L5共6个节段不同程度的椎体压缩性骨折并由此导致再次手术。
目前关于脊柱骨折“集簇现象”的文献报道极少,其发生的危险因素尚需进一步研究,结合既往文献以及本病例,认为其可能的危险因素有以下几点。
2.1 糖皮质激素(Glucocorticcooiiddss,GGCCss)
GCs是最为常见的影响骨代谢的药物,长期(3个月以上)使用任何剂量的GCs均可能导致骨质疏松,即GIOP[4],其骨折发生率为30%~50%[5]。在Kaplan[1]的研究中,8例发生椎体骨折“集簇现象”的患者中5例有长期服用GCs史,并且在发生“集簇现象”之前的3个月内都曾因为原发病情加重而增加GCs的剂量。目前仅有的2篇关于“集簇现象”的文献中[2,3],患者均因某种原因长期使用GCs。本病例因患重症肌无力服用泼尼松长达1年半以上,起始剂量为90 mg/d,而后缓慢减量至40 mg/d,虽然患者在服药过程中未出现短期增加激素用量的情况,但其骨密度以及相关骨代谢指标与用药初期相比均提示骨质疏松有所加重,进而可能导致短时间内多发椎体压缩性骨折的发生。
2.2 邻近椎体再发骨折
近年来多项研究提示,椎体压缩性骨折的发生本身就可能增加再发骨折的概率,椎体发生骨折后增加对邻近椎体的机械性负担,如果发生过2个以上椎体骨折,再发椎体骨折的风险增加至12倍[6]。而不少学者认为,目前被广泛用于治疗疼痛明显的新鲜椎体压缩性骨折的PKP和PVP,也可能因为骨水泥灌注术后椎体硬度增加以及骨水泥渗漏增加继发椎体压缩性骨折的风险[7]。PKP及PVP术后新发椎体骨折的发生率可达11%~52%[8-10],且多发生于术后3个月内。本病例3个月前曾因多发椎体骨折行PKP手术,新发椎体压缩性骨折位于T7椎体,紧邻之前行骨水泥灌注的T8椎体,符合PKP术后邻近节段的再发骨折。
此外,GIOP椎体骨折患者中,PVP或PKP术后再发椎体骨折的概率要高于原发性骨质疏松症患者[11-13],并且在初次手术后1年内更倾向于因为再发椎体骨折行第2次甚至第3次再手术[12],说明糖皮质激素用药史以及既往椎体压缩性骨折病史可能共同造成了“集簇现象”的产生。
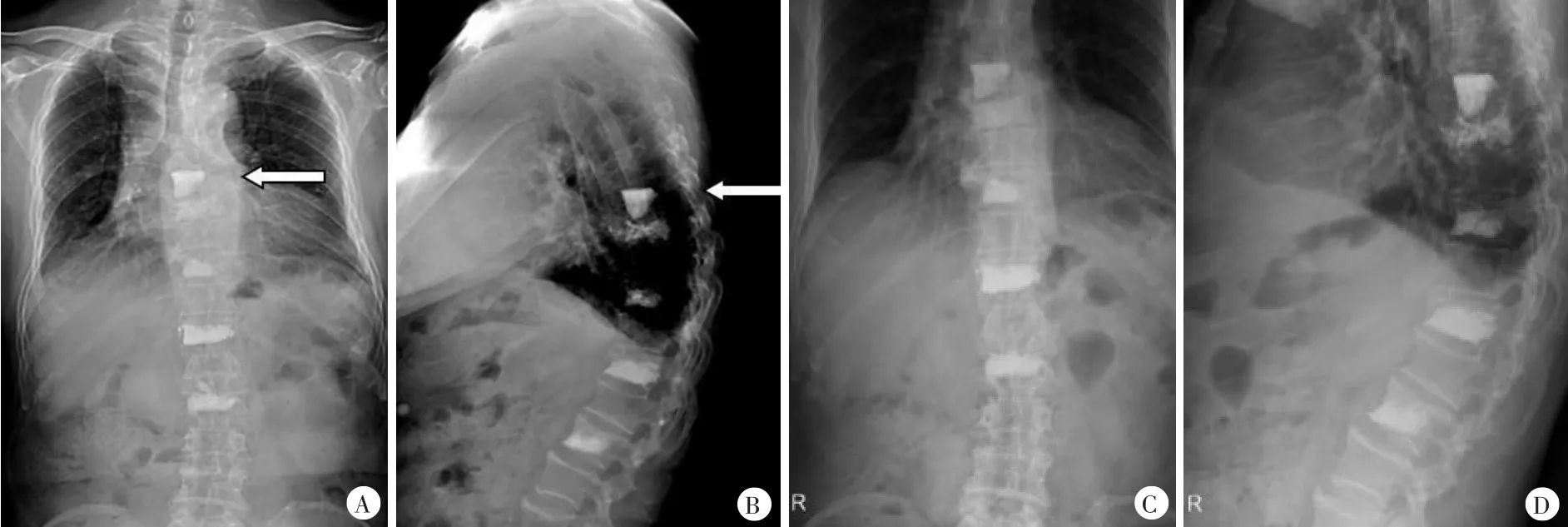
图4 第2次手术后和术后2个月随访的影像学检查
对于出现椎体骨折“集簇现象”的患者而言,骨折疼痛明显且持续时间更长,发生后凸畸形的概率增加[14],这就使早期诊断、及时治疗以及恰当的预防显得十分重要。临床上应格外警惕像本例一样突然出现腰背部疼痛加剧,且既往有椎体压缩性骨折史和长期糖皮质激素用药史的患者。X线片、MRI等检查均是诊断脊柱压缩性骨折“集簇现象”的重要手段。
治疗方面,推荐使用手术纠正椎体压缩性骨折与药物改善骨质疏松相联合的方案[15]。手术治疗可行PKP或PVP术式,使患者获得快速的疼痛改善和早期活动能力[16];而抗骨质疏松药物治疗方面,除口服传统的钙剂和维生素D类药物,还可同时皮下注射特立帕肽。特立帕肽为甲状旁腺素的类似物,是目前唯一促进骨形成的抗骨质疏松药物[17],其对于骨密度的改善以及减少骨质疏松性骨折发生等方面均优于阿仑膦酸钠[18],并且可一定程度上减缓骨水泥灌注后邻近节段椎体的继发骨折[19]。此外,减少糖皮质激素的使用对减缓骨质疏松的进程也十分重要。对于本病例的椎体(T7)新发骨折进行了PKP,术后继续钙剂和维生素D抗骨质疏松治疗,并加用特立帕肽20 U/d皮下注射,同时根据患者重症肌无力的情况尽可能地减少糖皮质激素的使用剂量并缩短疗程。患者经治疗后背痛症状明显改善,VAS 1~2分,无活动受限,术后2、4、6个月随访时均未再发腰背部疼痛,且骨密度和骨代谢指标较前均有所改善。
综上,临床工作中应对短时间内多个椎体集中发生压缩性骨折的“集簇现象”给予充分重视,格外警惕有腰背部疼痛迁延不愈并有明显突然加重主诉的患者。严重骨质疏松、长期糖皮质激素用药史、椎体压缩性骨折史、椎体手术史等因素可能共同促成了这一现象的产生。随着对“集簇现象”危险因素、诊治研究的不断深入,对其带来的严重临床后果的防治将会更加合理有效、个体化。
