甘肃省武威市苜蓿镰孢根腐病菌的鉴定
2018-12-27张贞明柏玉晶阿不满杨成德
张贞明,柏玉晶,阿不满,杨成德
(1.甘肃草原技术推广总站,甘肃 兰州 730000; 2.甘肃农业大学植物保护学院,甘肃 兰州 730070; 3.甘肃省农作物病虫害生物防治工程实验室,甘肃 兰州 730070)
苜蓿(Medicagosativa)抗逆性强,蛋白含量高,有“牧草之王”的称号,具有固氮能力,且根系发达,可有效防止表层土壤侵蚀,是保持水土和改土培肥的重要生态植物[1];在我国种植面积约3.77×106hm2,居各类人工种草之首[2],主要分布在内蒙古高原、东北地区、黄土高原、新疆维吾尔自治区、黄淮海地区等[3]。但是,随着苜蓿种植时间的增长,根腐病发生日趋严重[4-10],已成为现阶段苜蓿栽培过程中的重要限制因素之一。该病害可为害苜蓿全生育期,侵染根及根颈部位造成根部腐烂,致使根系分支减少,固氮能力降低,产量和品质下降,每年由苜蓿根腐病在全世界造成的苜蓿产量损失在20%左右,发病严重地块甚至达40%[11]。由于栽培区生态条件各异,根腐病病原种类有差别[12-13],目前报道的病原有29种,其中镰孢属(Fusariumspp.)真菌有14种[14],为引起该病害的优势病原,如黑龙江紫花苜蓿根腐病的主要病原为镰孢菌和丝核菌(Rhizoctoniasp.)[15],内蒙古中部地区苜蓿根腐病的优势病原为镰孢属真菌[10],甘肃省定西市苜蓿根腐病的病原为半裸镰孢菌(F.semitectum)、锐顶镰孢菌(F.acuminatum) 和尖孢镰孢菌(F.oxysporum)[16]。近年来甘肃省武威市苜蓿种植面积越来越大,2017年年底保有面积1.78×104hm2,已成为产业结构调整的主要作物之一,但局部种植年限较长的田块根腐病发生较重,且武威市苜蓿镰孢根腐病的病原种类有待于进一步研究。因此,本研究对甘肃省武威市苜蓿镰孢根腐病的病原菌进行分离、致病性测定和鉴定,以期为该病害的田间诊断和综合防治提供科学依据。
1 材料与方法
1.1 苜蓿根腐病标本
于2014年7月18日采自甘肃省武威市黄羊镇,取样田为种植3年的甘农3号,对地上部分有疑似根腐病症状的植株随机挖取10株进行根腐病的初步诊断和症状描述,并对根腐病标样带回实验室进行病原分离培养和鉴定。
1.2 症状描述
对紫花苜蓿根腐病地上及地下症状进行描述并拍照,包括颜色变化、腐烂情况等。
1.3 病原的分离和鉴定
1.3.1病原的分离 采用常规组织分离法在PSA培养基(马铃薯200 g、蔗糖20 g、琼脂17 g、蒸馏水1 000 mL)进行分离培养与菌落边缘纯化,待边缘纯化的菌株产孢后进行单孢分离纯化,后转入PSA斜面保存备用[17]。
1.3.2致病性测定 采用浸根接种法进行致病性测定[17]。具体为将紫花苜蓿播种于塑料花盆中(直径12 cm),在室温条件下培育至40 d苗龄,取出苗,冲洗干净根表面的泥土后将根部用6号昆虫针轻轻扎破表皮,再用分离物106cfu·mL-1的孢子悬浮液浸根15 min,再移栽于花盆继续生长;每个分离物重复3次,每次重复3盆,每盆5株,共45株;以无菌水浸根为对照。接种后连续观察植株发病情况,至有紫花苜蓿叶片黄化和开始落叶时挖出所有接种植株的根,统计发病植株,计算发病率,并对形成典型症状的植株进行再分离。
1.3.3病原菌的鉴定 将病原菌接种于PSA平板25 ℃下培养5 d后观察培养性状,产孢后观察分生孢子梗、厚垣孢子、大型分生孢子和小型分生孢子的形态特征,测量厚垣孢子、小型分生孢子和大型分生孢子大小(50个),显微拍照。根据菌株形态特征,参考《镰刀菌属》[18]和《真菌鉴定手册》[19]等进行鉴定。
按参考文献[20]进行DNA提取,采用镰孢霉属真菌专用引物Fu3(5′-CCG AGTTTACAACTCCCAAA-3′)及Fu4(5′-TCCTCCGCT TAT TGA TAT GC-3′)[21](由华大生物工程有限公司合成)进行PCR扩增,扩增体系为DNA模板2 μL(以加2 μL双蒸水为空白对照),2×MasterMix 25 μL,引物3 μL,加双蒸水定容至50 μL;扩增程序为95 ℃预变性3 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,共30个循环;最后72 ℃延伸10 min。将具特异性条带产物送华大生物工程有限公司测序,所测序列在GenBank中进行同源性比对并下载同源性较高的序列,并采用Mega5.0邻接法(Neighbor-Joining)构建菌株系统发育树,明确其分类地位。
2 结果与分析
2.1 田间症状
该病害主要为害根,发病初期根及根颈部形成褐色坏死斑,之后病斑逐渐扩大,最后严重腐烂变为深褐色及黑色,深达维管束(图1);植株地上部初期营养不良的表现,生长缓慢,叶片变黄枯萎,后期严重时枯死。

图1 苜蓿根腐病田间症状Fig. 1 Field symptoms of alfalfa root rot
2.2 病原菌的分离及致病性测定
根据分离物菌落形态、孢子和菌丝形态获得8个镰孢霉属真菌分离物,依次编号为WGF1、WGF2、WGF3、WGF4、WGF5、WGF6、WGF7和WGF8。经致病性测定,WGF2、WGF6和WGF7引致苜蓿根腐病的发病率为100%,致病力强;WGF1的发病率为75%,WGF3的发病率为50%,在发病部位可再分离得到与原接种镰孢真菌相同的分离物;接种WGF4、WGF5、WGF8和清水对照的紫花苜蓿无典型症状形成(图2)。该结果表明WGF1、WGF2、WGF3、WGF6和WGF7为紫花苜蓿根腐病的病原菌,且WGF2、WGF6和WGF7致病性强。

图2 致病性测定Fig. 2 Pathogenicity testing of the 7 isolates
2.3 病原菌的鉴定
2.3.1形态学鉴定 WGF2和WGF6菌落正面气生菌丝多,中心淡黄色,背面中心呈橘黄色,边缘呈淡黄色;菌落圆形,直径7.9 cm(图3A、B);产孢细胞单瓶梗;小型分生孢子纺锤形或哑铃形,大小(5.48~16.46) μm×(2.3~3.87) μm;大型分生孢子纺锤形或镰刀形,多为镰刀形,多3~5隔,两端为楔形,直或稍弯,大小(14.37~38.92) μm×(3.05~5.19) μm;厚垣孢子球形,直径(19.32~37.19) μm(图3C、D)。根据培养性状和形态特征[18-19]鉴定为半裸镰孢菌(F.incarnatum)。
WGF3菌落正面气生菌丝白色絮状,背面初期呈紫色,后期呈紫黑色;菌落圆形,直径7.5 cm(图4A、B)。分生孢子梗短,单瓶梗或多瓶梗;小型分生孢子卵圆形或椭圆形,大小(2.75~7.74) μm×(1.98~3.67) μm;大型分生孢子极少产生,有则多3~5隔,大小(13.41~39.49) μm×(1.3~43.92) μm(图4C、D);不形成厚垣孢子。根据培养性状和形态特征[18-19]鉴定为层出镰孢菌(F.proliferatum)。
WGF1和WGF7菌落正面气生菌丝乳白色,发达,中央周围有气生菌丝塌陷,背面中心颜色略深,边缘颜色较浅;菌落圆形,生长5 d直径7.7 cm(图5A、B);7 d形成分生孢子;产孢梗单瓶梗,大小(2.4~7.4) μm×(6.5~17.8) μm;大型分生孢子镰刀形,两端渐尖,具脚泡,大多为3~5隔,大小(14.5~32.2) μm×(3.4~5.1) μm;小型分生孢子大多为单孢,纺锤形或近椭圆形,较少,大小(8.3~18.7) μm×(2.4~4.4) μm;厚垣孢子间生或串生,圆形或近圆形,直径(7.1~29.7) μm(图5C、D、E)。根据培养性状和形态特征[18-19]鉴定为厚垣镰孢菌(F.chlamydosporum)。
2.3.2特异性基因序列分析鉴定 利用特异性引物分别对病原菌WGF2和WGF6基因组DNA进行PCR扩增,具特异性条带的扩增产物经测序,其序列分别长497和496 bp;将测序结果在GenBank中进行同源性比较,并用Mega(5.0)的邻接法构建系统发育树,WGF2和WGF6分别与半裸镰孢菌KY436233和KJ018790的同源性达100%,且在系统发育树上聚在一起(图6)。结合形态特征,将其鉴定为半裸镰孢菌。

图3 半裸镰孢形态特征Fig. 3 Morphological characteristics of F. incarnatum
A,菌落正面;B,菌落背面;C,大型分生孢子;D,厚垣孢子。
A, Upper surface of the colony; B, Reserved surface of the colony; C, Macroconidia of the pathogen; D, Chlamydospore.
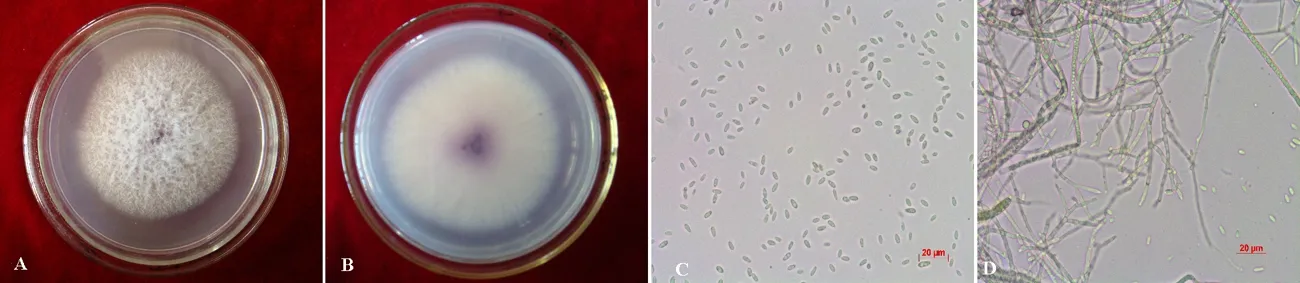
图4 层出镰孢形态特征Fig. 4 Morphological characteristics of F. proliferatum
A,菌落正面;B,菌落背面;C,大型分生孢子;D,产孢梗。
A, Upper surface of the colony; B, Reserved surface of the colony; C, Macroconidia of the pathogen; D, Conidiogenous cell.

图5 厚垣镰孢菌形态特征 Fig. 5 Morphological characteristics of F. chlamydosporum
A,菌落正面;B,菌落背面;C,产孢梗;D,大型分生孢子;E,厚垣孢子。
A, Upper surface of the colony; B, Reserved surface of the colony; C, Conidiogenous cell; D, Macroconidia of the pathogen; E, Chlamydospore.
提取WGF3基因组DNA,经特异性引物扩增后测序,获得532 bp的DNA片段,在GenBank中经同源性比较,与镰孢菌KU939075的同源性达99%,且在系统发育树上聚在一起(图6)。结合形态特征,将其鉴定为层出镰孢菌。
利用特异性引物分别对病原菌WGF1和WGF7基因组DNA进行PCR扩增,经测序WGF1和WGF7扩增产物分别长509和510 bp,在GenBank中经同源性比较,两病原菌与厚垣镰孢菌KY347905和KY347904的同源性达99%,且在系统发育树上聚在一起(图6)。结合形态特征,将WGF1和WGF7鉴定为厚垣镰孢菌。

图6 病原菌系统发育树Fig. 6 Phylogrnetic tree of WGF1,WGF2, WGF3, WGF6 and WGF7
3 讨论与结论
苜蓿根腐病是一种典型的土传病害,报道的病原达29种,其中优势病原为镰孢菌[14],其中镰孢菌主要有茄镰孢(F.solani)、梨孢镰孢菌(F.poae)、燕麦镰孢菌(F.avenaceum)、串珠镰孢菌(F.moniliforme)、半裸镰孢菌、黄色镰孢菌(F.culmorum)、链状镰孢菌(F.fusarioides)、木贼镰孢菌(F.equiseti)、三线镰孢菌(F.tricinctum)、接骨木镰孢菌(F.sambucinum)、锐顶镰孢菌、尖孢镰孢菌、大刀镰孢菌(F.culmorum)和拟枝孢镰孢菌[17,22-23]。甘肃省定西市苜蓿根腐病主要由尖孢镰孢菌、半裸镰孢菌和锐顶镰孢菌[16]引起。本研究中仅分离到厚垣镰孢菌、层出镰孢菌和半裸镰孢菌,5株致病菌中厚垣镰孢菌和半裸镰孢菌各2株,层出镰孢菌1株,且没有分离到尖孢镰孢菌和锐顶镰孢菌,说明武威苜蓿根腐病病原种与定西市有差异,且厚垣镰孢菌和半裸镰孢菌为强致病力菌株。
菌物形态除了受基因组控制外,也受环境因素的影响,特别是部分形态特征因培养条件的变化而改变,在形态上表现出多样性,因此物种鉴定极大地依赖于鉴定者的经验,如本研究中厚垣镰孢菌的分生孢子在PSA培养基上大于PDA培养基上;另外,部分镰孢菌的产孢条件难以筛选[24],增大了依据形态特征进行分类鉴定的难度,并且菌物形态特征上的相似性和许多菌株有性时期的未知性,在培养特征及形态特征上很难在种的水平上将其分类。因此,分子鉴定方法在菌物鉴定中得到进一步扩大和应用,以便提高种鉴定的准确性,特别是通过培养特征、表型特征和分子鉴定数据等综合资料和研究者的经验结合,可以较好地克服单一方法在菌株鉴定中的局限性,提高鉴定的准确性。分子鉴定方法中rDNA-ITS基因序列分析在鉴定真菌方面应用广泛,如王晓英和刘秀梅[25]综合镰孢霉属真菌rDNA18S、28S、5.8S及其区间序列ITS1和ITS2设计了镰孢霉属真菌专用引物Fu3/Fu4,该区间序列表达和调控保守,可以较好地区分镰孢霉属真菌在种一级的关系,本研究使用该引物对所分离的病原镰孢菌进行了鉴定,将5株引起武威市紫花苜蓿根腐病的致病菌分别鉴定为半裸镰孢菌、层出镰孢菌和半裸镰孢菌,丰富了苜蓿根腐病病原的资料,也为甘肃省武威市苜蓿根腐病的诊断和综合防治提供了依据。
