微小RNA-375调控自噬抑制肝癌细胞SMMC-7721增殖和转移
2018-12-27王星星宋虎杜晨阳王振张建军沈中阳
王星星,宋虎,杜晨阳,王振,张建军△,沈中阳
肝细胞癌(hepatocellular carcinoma,HCC)是最常见的原发性肝脏恶性肿瘤,占原发性肝癌的85%~90%,并且是全球恶性程度最高的癌症之一,经常在晚期发现并且预后不良[1-3]。手术切除和肝移植是HCC的主要治疗手段,但即使手术切除后,HCC患者的5年生存率仍然不高,侵袭、转移和复发是影响临床治疗和预后的主要因素[4]。微小RNA(microRNA,miRNA)异常表达涉及许多人类疾病,特别是癌症[5]。自噬(Autophagy)是一种细胞内降解过程,已被证明在多种生物功能中发挥着关键作用,包括细胞存活、神经元功能、线粒体翻转、蛋白质降解和能量代谢等[6]。有证据表明自噬可以通过其降解过程保护HCC细胞免于由抗肿瘤剂诱导的细胞凋亡,自噬可能促进HCC细胞转移[7]。本研究旨在探索miR-375介导Atg14调控自噬对肝癌细胞增殖和转移能力的影响。
1 材料与方法
1.1 材料 人SMMC-7721肝癌细胞系购自中科院上海细胞库;miR-375引物、miR-375模拟物(miR-375 mimic)、miR-375抑 制 物(miR-375 inhibitor)、Atg14的小干扰 RNA(siRNA)购自广州锐博生物科技公司;Atg14引物购自上海生工生物工程公司;胎牛血清(FBS)、培养基、胰酶购自美国Gibco公司;Trizol试剂购自美国Invitrogen公司;cDNA反转录试剂盒以及实时定量PCR试剂盒购自北京全式金生物技术有限公司;免疫细胞化学试剂盒购自北京中杉金桥生物技术有限公司;自噬双标腺病毒(mRFP-GFP-LC3)购自上海汉恒生物科技公司;qRT-PCR仪器购自瑞士Roche公司;Nanodrop分光光度计和CO2培养箱购自美国Thermo公司;荧光显微镜购自日本奥林巴斯公司;兔抗鼠泛素结合蛋白(P62)、Atg14、酵母Atg6同源物(Beclin1)、N-钙黏素(NCadherin)、波形蛋白(Vimentin)、β-连环蛋白(β-catenin)、GAPDH抗体以及辣根过氧化物酶(HRP)标记的羊抗兔二抗购自美国CST公司,兔抗鼠轻链3(LC3)Ⅰ/Ⅱ多克隆抗体购自英国Abcam公司。
1.2 方法
1.2.1 细胞缺氧复氧模型建立及分组 培养人SMMC-7721肝癌细胞并传代,将处于对数生长期细胞用胰酶消化后接种至6孔板,37℃、5%CO2培养箱培养细胞融合度为70%左右。分别用miR-375 mimics、miR-375 inhibitor、对照miRNA转染细胞以及Atg14 siRNA、对照siRNA转染细胞,分为miR-375 NC组、miR-375 mimics组、miR-375 inhibitor组以及siRNANC组、Atg14 siRNA组。各组转染后置于37℃、5%CO2培养箱中常规培养,12 h后更换新鲜培养基,继续培养48 h后移除培养基,加入2 mL Hank’s培养液,放入模拟缺氧专用培养箱,模拟缺血(缺氧)状态。1 h后移去Hank’s液,加入2 mL完全培养基,于37℃、5%CO2培养箱中继续培养6 h,模拟再灌注(复氧)状态。
1.2.2 qRT-PCR检测miR-375以及Atg14 mRNA的表达情况 Trizol法提取miR-375 NC、miR-375 mimics及miR-375 inhibitor组细胞总RNA,逆转录RNA获得cDNA(根据操作说明书进行)。miR-375引物:上游5′-CCCGCGCGAGCCCGA‑CAAACGC-3′,下游 5′-UCGUUUGUCGGGCUCGCGUGGG-3′;Atg14引物:上游5′-CATAACAACCCCGCCTACAC-3′,下游5′-TGCGTTCAGTTTCCTCACTG-3′;内参GAPDH引物:上游 5′-GGAGCGAGATCCCTCCAAAAT-3′,下游 5′-GGCT‑GTTGTCATACTTCTCATGG-3′。按说明书配制反应体系,经过94℃预变性30 s;94℃变性5 s,60℃退火15 s,72℃延伸10 s,扩增45个循环。结果使用比较阈值法定量分析,计算方法为:目的基因定量拷贝数=2-ΔΔCt,ΔCt=目的基因Ct值-内参基因Ct值,ΔΔCt=ΔCt实验组-ΔCt对照组,对每一标本计算目的基因的拷贝数。
1.2.3 免疫细胞化学 经转染处理后的miR-375 NC、miR-375 mimics及miR-375 inhibitor组细胞用胰酶消化,重新接种于24孔板中。37℃、5%CO2培养箱培养48 h后,室温下4%多聚甲醛固定20 min,3%H2O2阻断内源性过氧化物酶15 min,5%山羊血清封闭1 h,孵育一抗N-Cadherin、β-catenin(1∶500稀释)在4℃环境过夜。室温下孵育二抗1 h。二氨基联苯胺(DAB)溶液显色、苏木精染核后光镜显微镜下观察并采集图像。
1.2.4 蛋白印迹实验(Western blot) 各组细胞加入裂解液,充分裂解后用4℃,12 000 r/min,离心15 min,吸取上清。BCA法蛋白定量。SDS-PAGE电泳后转膜、封闭,加LC3、P62、Atg14、Beclin1、N-Cadherin、Vimentin、β-catenin与内参蛋白GAPDH一抗(1∶1 000稀释),4℃环境下孵育过夜,TBST洗涤后HRP标记的羊抗兔二抗(1∶2 500)室温孵育1 h,混合等体积的化学发光液与PVDF膜反应,曝光并保存图片。采用图像分析软件Image J对Western blot实验所得结果图像进行灰度分析,自噬过程中,LC3Ⅰ和磷脂酰乙醇胺(PE)结合转变为自噬体(即LC3Ⅱ),因此以LC3Ⅱ作为自噬标记蛋白。所有结果以GAPDH为内参对照,结果用灰度比值表示。
1.2.5 自噬双标腺病毒(mRFP-GFP-LC3)检测自噬体 将人SMMC-7721肝癌细胞接种至24孔板,培养至细胞融合度为50%~70%,用mRFP-GFP-LC3腺病毒感染miR-375 NC、miR-375 mimics和miR-375 inhibitor组细胞,并在荧光显微镜下观察细胞内自噬体情况。记录每个细胞内自噬体的数量,比较组间细胞自噬表达情况。
1.2.6 平板克隆 分别用miR-375 mimics、miR-375 inhibitor、Atg14 siRNA转染细胞,对照组转染空载质粒,分为miR-375 NC组、miR-375 mimics组、miR-375 inhibitor组以及siRNA-NC组、Atg14 siRNA组和miR-375+Atg14 siRNA共转组。将miR-375 NC组、miR-375mimics组、miR-375 inhibitor组和siRNA NC组、Atg14 siRNA组以及miR-375+Atg14 siRNA组均按相同密度接种在6孔板中(每孔加500个细胞),放入37℃、5%CO2培养箱培养1周后用结晶紫溶液(0.1%结晶紫)染色后观察并计数。
1.3 统计学方法 采用SPSS 22.0统计软件进行统计学处理。符合正态分布的数据用均数±标准差(±s)表示,2组间比较用t检验,多组间比较采用单因素方差分析,组间多重比较采用LSD-t法,P<0.05为差异有统计学意义。
2 结果
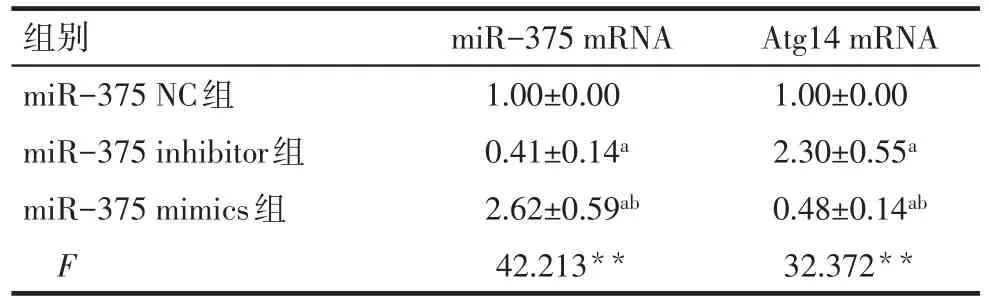
2.1 qRT-PCR检测细胞中miR-375和Atg14 mRNA的表达 通过靶基因预测网站TargetScan 7.2进行靶点预测发现miR-375与Atg14的相关性评分均较高,且有相互结合的序列,见图1。通过转染miR-375 mimics、miR-375 inhibitor以及对照miRNA结果显示,与miR-375 inhibitor组以及miR-375 NC组比较,miR-375 mimics组中miR-375 mRNA的表达明显增高,差异有统计学意义(P<0.01),而Atg14 mRNA在miR-375 mimics组表达最低,在miR-375 inhibitor组表达最高,差异有统计学意义(P<0.01),见表1。
Tab.1 Detection of miR-375 mRNA and Atg14 mRNA expression in cells by qRT-PCR表1 qRT-PCR检测细胞中miR-375 mRNA和Atg14 mRNA的表达 (n=4,±s)
Tab.1 Detection of miR-375 mRNA and Atg14 mRNA expression in cells by qRT-PCR表1 qRT-PCR检测细胞中miR-375 mRNA和Atg14 mRNA的表达 (n=4,±s)
**P<0.01;a与miR-375 NC组比较,b与miR-375 inhibitor组比较,P<0.05
组别miR-375 NC组miR-375 inhibitor组miR-375 mimics组F miR-375 mRNA 1.00±0.00 0.41±0.14a 2.62±0.59ab 42.213**Atg14 mRNA 1.00±0.00 2.30±0.55a 0.48±0.14ab 32.372**
2.2 免疫细胞化学检测SMMC-7721细胞中NCadherin、β-catenin表达情况 与miR-375 inhibitor组以及miR-375 NC组比较,miR-375 mimics组的β-catenin胞浆表达明显增多,而N-Cadherin的胞浆表达明显减少,见图2。
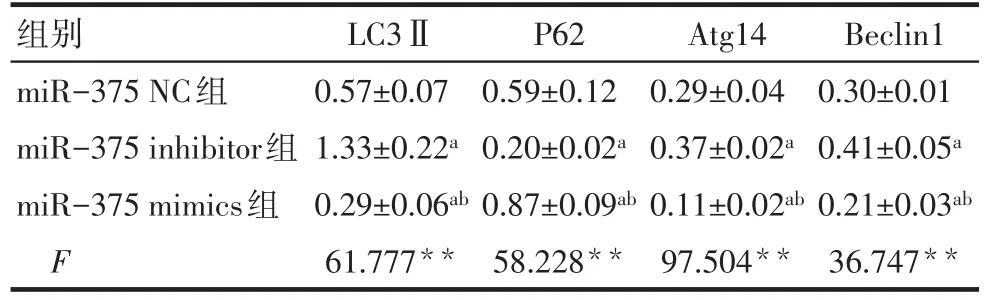
2.3 Western blot检测SMMC-7721细胞转染后相关蛋白的表达情况 过表达miR-375导致LC3Ⅱ的蛋白表达降低,P62的蛋白表达水平增加,差异有统计学意义(P<0.01)。与miR-375 inhibitor组、miR-375 NC组比较,miR-375 mimics组Atg14、Beclin1蛋白表达水平明显降低,差异有统计学意义(P<0.01),见图3、表2。
2.4 自噬双标腺病毒(mRFP-GFP-LC3)检测自噬体 miR-375 mimics组自噬体个数(4.25±1.26)明显低于 miR-375 NC组(8.25±1.26),而 miR-375 inhibitor组自噬体个数(16.75±2.50)明显高于miR-375 NC组,差异有统计学意义(n=4,F=48.531,P<0.01),见图4。
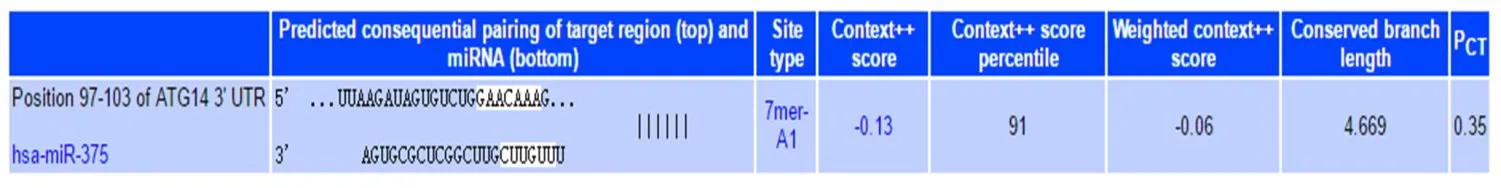
Fig.1 TargetScan 7.2 forecast results图1 TargetScan 7.2预测结果
2.5 平板克隆 与miR-375 inhibitor组(154.00±6.48)、miR-375 NC组(100.25±3.59)比较,miR-375 mimics组(29.25±2.99)的细胞集落明显减少,差异有统计学意义(n=4,F=736.061,P<0.01)。与siRNA NC组(144.25±8.85)相比,Atg14 siRNA组(48.00±10.23)细胞集落减少,且在miR-375 mimics与Atg14 siRNA共同转染后(29.25±5.19)细胞集落减少更加明显,差异有统计学意义(n=4,F=217.70,P<0.01),见图5。
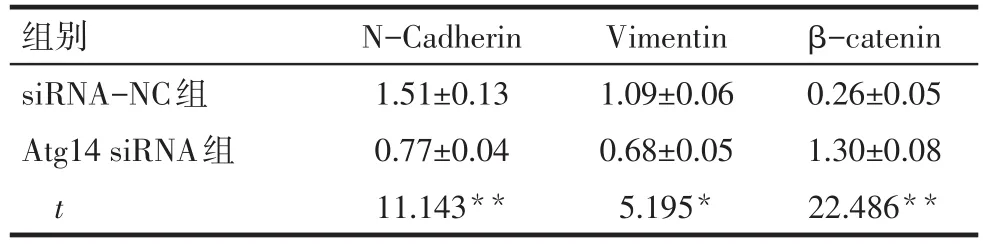
2.6 Western blot检测干扰Atg14表达后相关蛋白的表达情况 Atg14 siRNA组N-Cadherin、Vimentin蛋白表达水平明显低于siRNA-NC组,β-catenin蛋白表达水平明显高于siRNA-NC组,差异有统计学意义(P<0.05),见图6、表3。
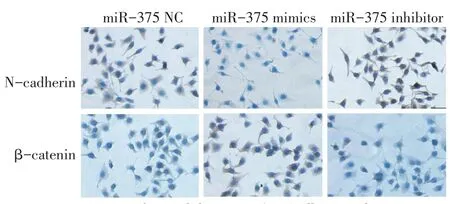
Fig.2 Immunocytochemical detection of N-Cadherin and β-catenin expression in SMMC-7721 cells(×400)图2 免疫细胞化学检测SMMC-7721细胞中N-Cadherin、β-catenin表达情况(×400)
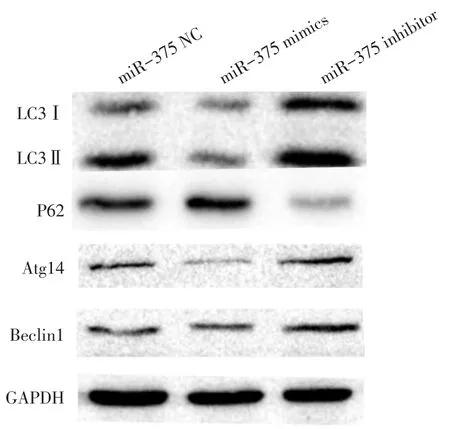
Fig.3 Western blot analysis of related protein expressions图3 Western blot检测相关蛋白的表达情况
Tab.2 Relative expression levels of related proteins after SMMC-7721 cell transfection表2 SMMC-7721细胞转染后相关蛋白的相对表达量(n=4,±s)
Tab.2 Relative expression levels of related proteins after SMMC-7721 cell transfection表2 SMMC-7721细胞转染后相关蛋白的相对表达量(n=4,±s)
**P<0.01;a与miR-375 NC组比较,b与miR-375 inhibitor组比较,P<0.05
组别miR-375 NC组miR-375 inhibitor组miR-375 mimics组F LC3Ⅱ0.57±0.07 1.33±0.22a 0.29±0.06ab 61.777**P62 0.59±0.12 0.20±0.02a 0.87±0.09ab 58.228**Atg14 0.29±0.04 0.37±0.02a 0.11±0.02ab 97.504**Beclin1 0.30±0.01 0.41±0.05a 0.21±0.03ab 36.747**
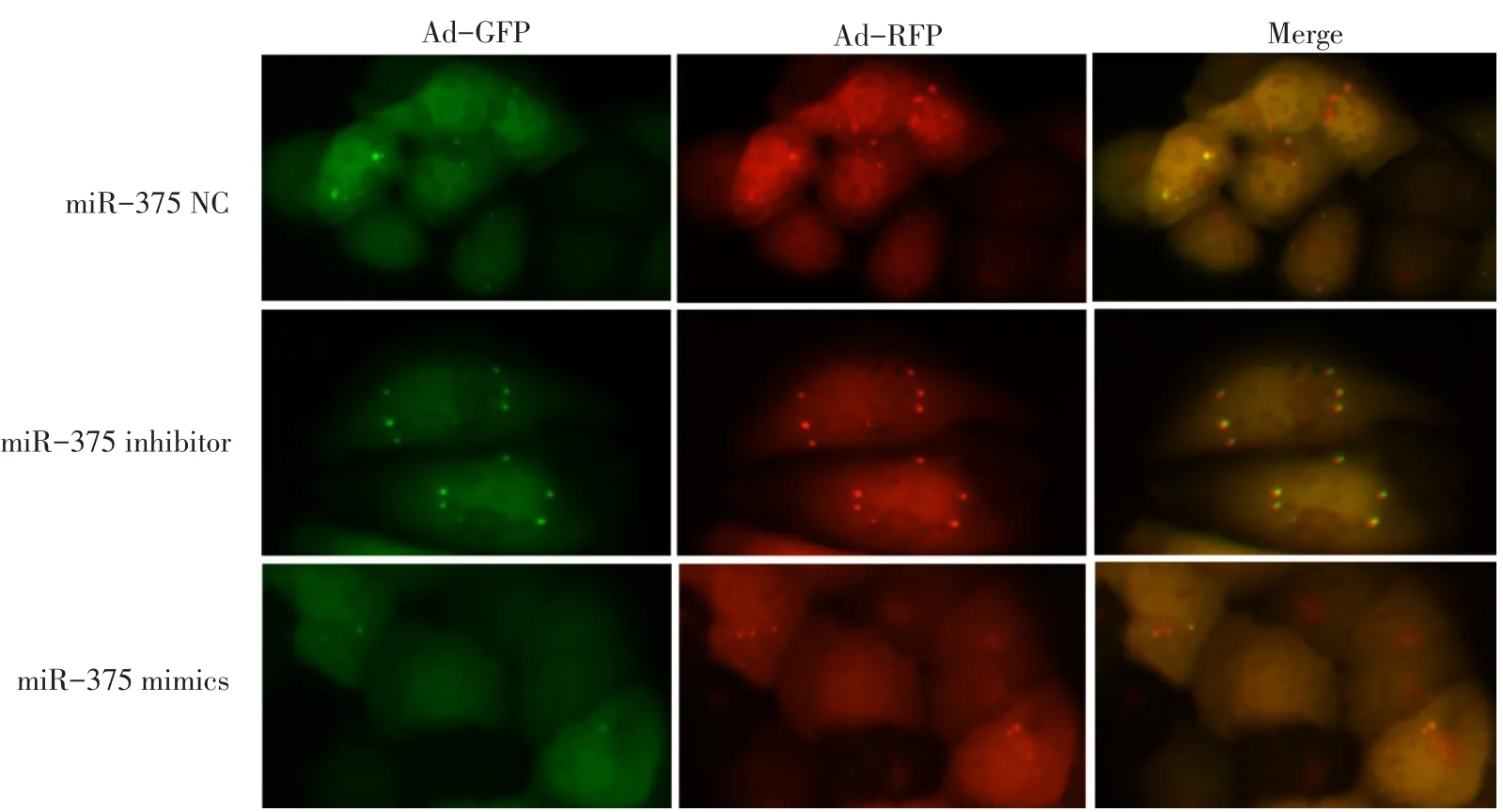
Fig.4 Autophagy double-labeled adenovirus(mRFP-GFP-LC3)for detection of autophagosomes(×400)图4 自噬双标腺病毒(mRFP-GFP-LC3)检测自噬体(×400)

Fig.5 Changes in cell proliferation in each treatment group图5 各处理组细胞增殖变化情况
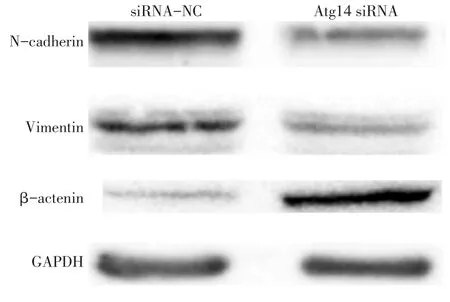
Fig.6 Western blot analysis of the expression of related proteins after interference with Atg14 expression图6 Western blot检测干扰Atg14表达后相关蛋白的表达情况
Tab.3 Relative expression of target protein after interference with Atg14 expression表3 干扰Atg14表达后目的蛋白的相对表达量(n=4,±s)
Tab.3 Relative expression of target protein after interference with Atg14 expression表3 干扰Atg14表达后目的蛋白的相对表达量(n=4,±s)
*P<0.05,**P<0.01
组别siRNA-NC组Atg14 siRNA组t N-Cadherin 1.51±0.13 0.77±0.04 11.143**Vimentin 1.09±0.06 0.68±0.05 5.195*β-catenin 0.26±0.05 1.30±0.08 22.486**
3 讨论
自噬是细胞应激条件下的重要生存机制,miRNA调控自噬在肿瘤的发生和发展过程中具有重要的调节作用[8]。Yuan等[9]通过研究紫外线辐射耐受相关基因(UVRAG)和UVRAG靶向miRNA对胃癌自噬和细胞凋亡的调节作用,发现miR-183通过靶向人胃癌细胞中的UVRAG,抑制饥饿诱导的自噬和细胞凋亡。Hua等[10]证实miR-1过表达可通过抑制Atg3介导的自噬来改善非小细胞肺癌(NSCLC)细胞对顺铂(Cisplatin)的化疗敏感性。而Liu等[11]通过研究miR-92b在乳腺癌自噬、增殖和侵袭中的主要作用,发现miR-92b的过表达促进了乳腺癌细胞中饥饿和雷帕霉素处理诱导的自噬。本研究表明,过表达miR-375能抑制Atg14表达,进而降低肝癌细胞内自噬体的形成和自噬相关蛋白LC3Ⅱ、Beclin1的表达;反之抑制miR-375表达能促进Atg14表达,进而提高肝癌细胞内自噬体的形成和LC3Ⅱ、Beclin1的表达;说明miR-375能通过负性调控Atg14以抑制肝癌细胞自噬。
miRNA对肝细胞癌的调控作用同样具有双面性。Liang等[12]发现在肝癌组织中miR-29a下调及干扰素诱导的跨膜蛋白-3(IFITM3)上调,miR-29a可通过负性调控IFITM3抑制HCC细胞的迁移、侵袭和增殖。Wang等[13]研究结果表明miR-506能特异性地靶向调控Yes相关蛋白(YAP)mRNA的3′-UTR区,抑制肝癌细胞的迁移、侵袭和转移。而Xu等[14]报道了miR-589-5p通过靶向有丝分裂诱导基因6(MIG-6)促进肝癌细胞生长,抑制miR-589-5p可能是抑制肝癌进展的可行方法。Hu等[15]研究发现肝癌细胞和组织中miR-665表达量显著增加,miR-665通过抑制蛋白酪氨酸磷酸酶受体B(PTPRB)靶向抑制Hippo信号传导活性,最终发挥促进肿瘤增殖、迁移和侵袭的作用。另有研究发现miR-375在多种类型的癌症中显著下调,如肝细胞癌、食管癌、胃癌、头颈部癌、黑色素瘤、胰腺癌和神经胶质瘤[16]。Yan等[16]研究显示miR-375可以抑制LC3Ⅰ向LC3Ⅱ的转化,并因此阻断自噬体的形成,此过程使溶酶体融合用于降解和再循环。此外,Liu等[17]也发现miR-375在HCC中显著下调,并且miR-375的过表达通过靶向调控另一种重要癌基因YAP来降低HCC细胞的侵袭和增殖。本研究表明,过表达miR-375可抑制肝癌细胞增殖,抑制肝癌细胞的侵袭、转移能力;反之抑制miR-375表达可促进肝癌细胞增殖,提高肝癌细胞的侵袭和转移能力;说明miR-375具有抗肝癌作用。
miRNA调控自噬作用于肝癌的机制复杂,可通过多种信号通路或靶点进行调控,如Atg、磷脂酰肌醇-3-激酶(PI3K)/蛋白激酶B(AKT)/哺乳动物雷帕霉素靶蛋白(mTOR)通路、细胞外调节蛋白激酶(ERK)/丝裂原活化蛋白激酶(MAPK)通路和蛋白激酶R样内质网激酶(PERK)通路等[18]。Wang等[19]研究结果表明miR-7通过靶向调控mTOR介导的自噬抑制肝癌细胞增殖,通过抑制自噬来增强miR-7的抗肿瘤活性。Zhang等[20]研究发现增强miR-142-3p表达可靶向miR-142-3p-ATG5/ATG16L1轴以减少索拉非尼诱导的自噬,增强索拉非尼诱导的细胞凋亡和抑制细胞生长,使肝癌细胞对索拉非尼敏感。Atg基因在自噬的激活和发生中起关键作用[21]。Si等[22]通过研究miR-23a对由败血症引发的自噬的作用,发现miR-23a在脓毒性损伤后被抑制,且能促进自噬并抑制高度炎症反应,进一步的研究证实Atg12是miR-23a的靶标。Li等[23]通过实验证实了Atg14为miR199a-5p的特异性靶点,并且Atg14部分地增强了miR199a-5p-增强的肝脏对葡萄糖和胰岛素的耐受性。本研究通过TargetScan预测miR-375与Atg14具有高度的基因相关性;过表达miR-375可使Atg14表达量降低,肝癌细胞增殖、侵袭转移能力降低,反之,肝癌细胞增殖、侵袭转移能力升高;使用RNA干扰抑制Atg14表达可使miR-375对肝癌细胞增殖、侵袭转移能力的抑制作用增强;说明Atg14是miR-375调控自噬作用于肝癌细胞的重要中间靶点,受miR-375且介导的自噬影响肝癌细胞。
综上所述,与正常肝细胞相比,miRNA-375在肝癌细胞中表达更低,且通过靶向下调Atg14抑制自噬,进而抑制肝癌细胞增殖、侵袭和转移能力,发挥抗肿瘤作用。miRNA-375靶向调控自噬抑制肝细胞癌为肝细胞癌的临床治疗提供了新思路。
