原花青素对环磷酰胺致免疫抑制小鼠免疫功能的影响
2018-12-27孔妮刘超杨方浩张腾元王宝堃高慧婕
孔妮,刘超,杨方浩,张腾元,王宝堃,高慧婕△
原花青素又名前花青素(proantho cyanidins,PC),是一种在热酸处理下能产生花色素的多酚化合物,大量存在于葡萄籽以及蓝莓叶中,是目前国际上公认的清除人体内自由基有效的天然抗氧化剂[1]。原花青素能够清除各种自由基、加快胆固醇分解、调节血脂、改善微循环、抗肿瘤、抗衰老,并且具有成本低、毒性低、用药安全等优点,因此被大量应用于化妆品以及保健品中[2-6]。但是,目前国内外研究的热点主要集中在其抗氧化功效上,对原花青素的免疫功能调节的相关研究尚少[7-8]。因此,研究原花青素对机体免疫功能的影响,从而指导原花青素对免疫抑制整体疗效的评估和合理使用都是十分必要的。本研究利用环磷酰胺(cyclophosphamide,Cy)建立小鼠免疫抑制模型,探究原花青素对免疫抑制小鼠的免疫调节作用及其对白细胞介素-10(IL-10)和肿瘤坏死因子-α(TNF-α)表达的影响,为原花青素在预防、治疗、提高机体免疫力及临床应用等多方面提供有效的参考。
1 材料与方法
1.1 材料
1.1.1 实验动物 清洁级ICR小鼠40只,4~8周龄,体质量25~30 g,雌雄各半,自由进食,由济宁医学院实验动物中心提供;普通级豚鼠5只,体质量300~400 g,自然喂养,由济宁医学院实验动物中心提供。
1.1.2 实验试剂与仪器 原花青素(货号L1517228)和环磷酰胺(货号C106991-1g/E1606077)购自Aladdin试剂公司;2,4-二硝基氟苯(DNFB)购自上海宝曼生物有限公司;反转录试剂盒购自美国Thermo Fisher Scientific公司;SYBR GreenⅠPCR kit及PCR引物购自上海生工生物工程公司;绵羊红细胞(SRBC)购自北京索莱宝科技有限公司;酶联免疫吸附测定(ELISA)试剂盒购自武汉基因美生物科技公司。CFX96实时荧光PCR仪(美国Bio-Rad公司);酶联免疫检测仪(Thermo Fisher Scientific公司)。
1.2 方法
1.2.1 分组和给药 40只ICR小鼠按随机数字表法均分为4组:正常对照组、Cy模型组、PC高剂量组(100 mg/kg)、PC低剂量组(80 mg/kg)。实验共7 d,PC组每只小鼠分别给予高、低剂量的PC 0.4 mL/d灌胃,其余2组灌胃等体积的生理盐水。免疫抑制模型制备:Cy模型组及PC高、低剂量组均在第2天和第4天腹腔注射Cy(50 mg/kg)0.1 mL,正常对照组注射等量生理盐水。
1.2.2 胸腺和脾脏指数测定 实验第7天灌胃后2 h,标记,称质量,处死小鼠,取小鼠的胸腺及脾脏进行称量。计算胸脾指数:胸腺(脾脏)指数=胸腺(脾脏)质量(mg)/体质量(g)。
1.2.3 外周血清溶血素测定 实验第6天,小鼠腹腔注射10%的绵羊红细胞0.2 mL。最后1 d灌胃2 h后,每只小鼠眼框取血0.3 mL,室温放置10 min,2 000 r/min离心30 min,取上清,以PBS为溶剂将血清进行1∶100稀释,取稀释后的血清0.1 mL置于酶标板中,然后加入等量0.2%的SRBC和豚鼠血清(1∶20),每鼠均做2个复孔,且分别设置血清对照、绵羊红细胞对照、豚鼠血清对照以及PBS空白对照各两个复孔,快速放置于37℃的恒温水浴箱中温浴60 min,2 000 r/min离心20 min。最后取上清150 μL,放置于一个新的酶标板中,用酶标仪测定450 nm下光密度(OD)值。
1.2.4 DNFB致迟发性超敏反应(DTH)检测 实验第2天,用生理盐水涂湿每只小鼠的腹部,后用剪刀贴皮剪去小鼠腹部的毛。面积大约为1 cm×1 cm,待腹部变干后,去毛部位涂抹50 μL 1%的DNFB,次日再涂抹一次;最后一次灌胃后,在小鼠的右耳部涂抹10 μL 0.2%的DNFB,24 h后,将小鼠处死,分别用打孔器取相同部位左右耳片,用精密电子天平称取小鼠左右耳的质量,并计算质量差,计算鼠耳肿胀度,用以检测迟发性超敏反应。
1.2.5 ELISA法测定外周血的TNF-α、IL-10的表达 每只小鼠眼框取血0.3 mL,25℃静置15 min,2 000 r/min离心30 min,取上清液。参照ELISA试剂盒说明,在450 nm波长下测定各个样品和标准品的OD值。
1.2.6 RT-qPCR测定脾细胞TNF-α和IL-10 mRNA的表达 取小鼠脾脏(<0.1 g),Trizol法提取脾细胞RNA,使用反转录试剂盒逆转录cDNA。使用SYBR Green在PCR扩增仪上行qPCR。PCR 引物序列如下:IL-10(118 bp)上游 5′-TGGGTTGCCAAGCCTTATCG-3′,下 游 5′-TTCAGCTTCT‑CACCCAGGGA-3′;TNF-α(209 bp)上游5′-ACCGTCAGCC‑GATTTGCTAT-3′,下 游 5′-CCGGACTCCGCAAAGTCTAA-3′。采用 GAPDH(183 bp)作为内参,上游 5′-ATTCAACG‑GCACAGTCAAGG-3′,下游 5′-GCAGAAGGGGCCGGAGAT‑GA-3′。采用2-ΔΔCt进行目的基因相对表达量分析。
1.3 统计学方法 采用SPSS 18.0统计软件进行分析。计量资料以均数±标准差(±s)表示,多组间比较采用方差分析,组间两两比较采用LSD-t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 原花青素对小鼠胸腺和脾脏指数的影响 与正常对照组相比,Cy模型组胸腺和脾脏指数均明显缩小(P<0.05)。与Cy模型组相比,PC低剂量组的脾脏指数显著增大(P<0.05),并且PC高剂量组胸腺和脾脏指数均较低剂量组增大(P<0.05),见表1。
Tab.1 Effects of PC on spleen index,thymus index,serum hemolysin and DTH in mice表1 PC对小鼠胸腺、脾脏指数和血清溶血素、小鼠迟发性超敏反应的影响 (n=10,±s)
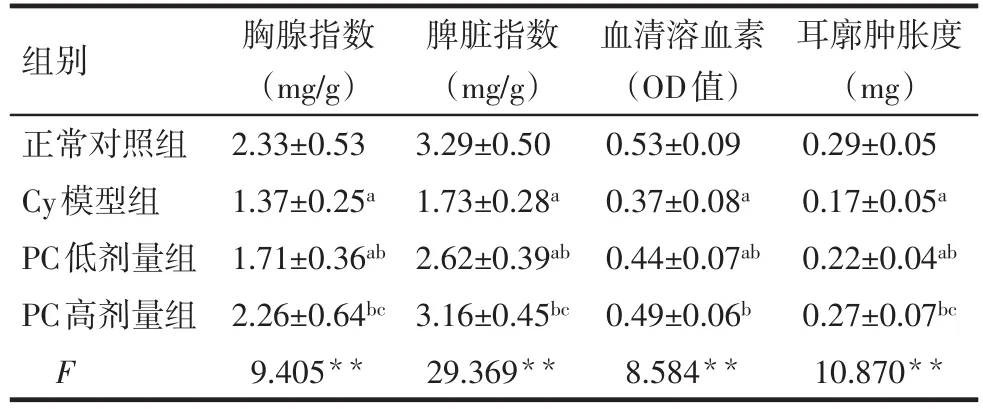
Tab.1 Effects of PC on spleen index,thymus index,serum hemolysin and DTH in mice表1 PC对小鼠胸腺、脾脏指数和血清溶血素、小鼠迟发性超敏反应的影响 (n=10,±s)
**P<0.01;a与正常对照组比较,b与Cy模型组比较,c与PC低剂量组比较,P<0.05;表2同
组别正常对照组Cy模型组PC低剂量组PC高剂量组F胸腺指数(mg/g)2.33±0.53 1.37±0.25a 1.71±0.36ab 2.26±0.64bc 9.405**脾脏指数(mg/g)3.29±0.50 1.73±0.28a 2.62±0.39ab 3.16±0.45bc 29.369**血清溶血素(OD值)0.53±0.09 0.37±0.08a 0.44±0.07ab 0.49±0.06b 8.584**耳廓肿胀度(mg)0.29±0.05 0.17±0.05a 0.22±0.04ab 0.27±0.07bc 10.870**
2.2 原花青素对小鼠血清血溶素的影响 Cy模型组小鼠血清溶血素的生成量较正常对照组显著降低(P<0.05),PC高、低剂量组小鼠血清血溶素生成水平较Cy模型组升高(P<0.05),见表1。
2.3 原花青素对小鼠DNFB致迟发性超敏反应的影响 Cy模型组小鼠耳廓肿胀度低于正常对照组(P<0.05),而PC高、低剂量组小鼠的耳廓肿胀度均高于Cy模型组(P<0.05),见表1。
2.4 原花青素对小鼠血清IL-10和TNF-α表达的影响 与正常对照组相比,Cy模型组小鼠血清IL-10的表达水平升高(P<0.05),与Cy模型组相比,PC高剂量组的IL-10的表达水平明显降低(P<0.05),而PC低剂量组变化不明显,差异无统计学意义(P>0.05);与正常对照组相比,Cy模型组小鼠血清TNF-α的表达水平显著降低(P<0.05),与Cy模型组相比,PC高、低剂量组TNF-α的表达均有所升高(P<0.05),见表2。
Tab.2 Effects of PC on IL-10 and TNF-α in mice表2 PC对小鼠IL-10和TNF-α的影响 (n=10,±s)
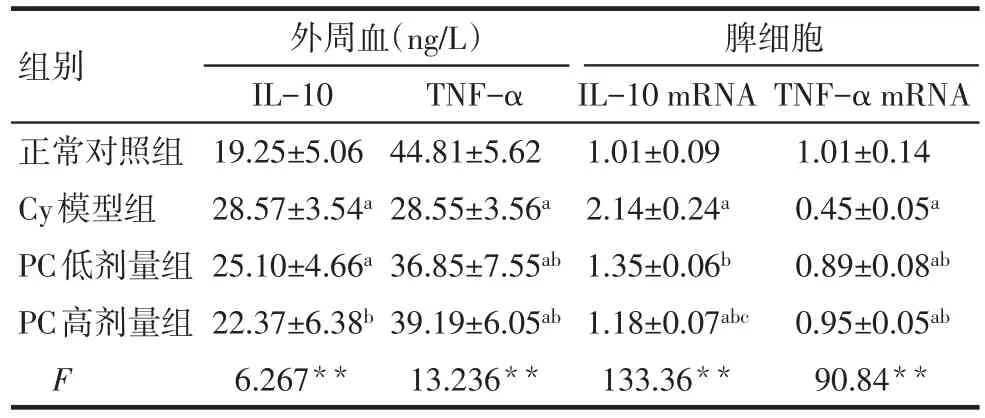
Tab.2 Effects of PC on IL-10 and TNF-α in mice表2 PC对小鼠IL-10和TNF-α的影响 (n=10,±s)
组别正常对照组Cy模型组PC低剂量组PC高剂量组F外周血(ng/L)IL-10 19.25±5.06 28.57±3.54a 25.10±4.66a 22.37±6.38b 6.267**TNF-α 44.81±5.62 28.55±3.56a 36.85±7.55ab 39.19±6.05ab 13.236**脾细胞IL-10 mRNA 1.01±0.09 2.14±0.24a 1.35±0.06b 1.18±0.07abc 133.36**TNF-α mRNA 1.01±0.14 0.45±0.05a 0.89±0.08ab 0.95±0.05ab 90.84**
2.5 原花青素对小鼠脾细胞IL-10和TNF-α mRNA表达的影响 Cy模型组小鼠IL-10 mRNA表达水平显著高于正常组,TNF-α mRNA的表达显著降低(P<0.05);与Cy模型组相比,PC高、低剂量组均能够有效下调IL-10 mRNA的表达,上调TNF-α mRNA的表达(P<0.05),见表2。
3 讨论
作为重要的免疫器官,小鼠的胸腺和脾脏可以反映出机体的免疫水平,因此可以用胸腺和脾脏指数评价小鼠的整体免疫状态,包括机体的体液免疫及细胞免疫功能[9]。本研究显示,PC可以恢复由Cy所致的胸腺和脾脏指数的减少,显示出其对中枢及外周免疫器官均有良好的保护活性和很好的免疫增强效果。此外,溶血素实验显示PC可提高小鼠外周血的抗体生成率,增强体液免疫;迟发性超敏反应显示PC可提高机体的迟发性超敏反应,即提高了迟发性超敏反应细胞TDTH(Th1)的活性,增强细胞免疫,这与PC对小鼠整体免疫水平的提高一致。
Th1细胞是TNF-α重要的产生细胞,参与体内多种免疫调节作用,可促进巨噬细胞、淋巴细胞活化,也可以促进内皮细胞黏附分子的表达和PAF、花生四烯酸(AA)的释放,对中性粒细胞有很好的活化和趋化作用[10]。无论是外周血TNF-α的表达,还是小鼠脾脏TNF-α mRNA的表达,均显示PC的应用提高了TNF-α的产生,这与迟发性超敏反应中Th1的活性增加是一致的,提示PC可以通过提高Th1的活性,促使其产生大量的TNF-α,提升机体细胞免疫功能。
负性调节因子在免疫应答的维持中也发挥重要作用。IL-10是免疫应答中重要的负性调节分子之一,目前认为其高表达与免疫细胞的抑制高度有关[11]。IL-10可以抑制单核巨噬细胞产生促炎性活性分子,抑制T细胞参与的细胞免疫应答。有研究显示缺乏IL-10的小鼠,给予其受体封闭抗体后,T细胞的功能可一定程度恢复[12]。Cheshier等[13]研究发现pycnogenol(含有原花青素分子)可以部分恢复喂食乙醇后小鼠的免疫功能不全的症状,降低喂食乙醇小鼠的脾细胞IL-10分泌量,同时提高自然杀伤(NK)细胞的杀伤活性。本研究发现,在灌服PC后,小鼠外周血及脾脏IL-10的表达水平均较Cy组有所下降,提示PC可能通过下调IL-10的表达而促进免疫应答。这可能是PC免疫调节作用的另一机制,但PC如何下调IL-10的表达仍有待进一步深入研究。
综上所述,PC对小鼠的整体免疫机能有一定的保护作用,并且有可能是通过对IL-6和IL-10的调节来参与对免疫功能的调节,为利用PC进一步开发提高抗氧化、抗肿瘤、增强免疫力的食品、药品和保健品提供了有力依据。
