15株乳酸菌的表面性质及其黏附能力
2018-12-26,,,,,
,,,,,
(东北农业大学,乳品科学教育部重点实验室,黑龙江哈尔滨 150030)
乳酸菌是可以发酵碳水化合物产生大量乳酸的细菌统称,具有调节机体免疫、促进肠道内微生物菌群的生态平衡、改善肠道菌群结构等多种益生功能[1-2]。目前研究表明,乳酸菌对肠道上皮细胞的特异性黏附作用有助于其在肠道定植、增强乳酸菌与肠道细胞之间的信号交流、抑制病原菌在肠道的定植和提高机体的免疫力。而乳酸菌在肠道中定植的前提是其必须黏附于宿主细胞表面[3-4]。所以,目前普遍把乳酸菌黏附性作为评价其能否成为益生菌的首要标准[5-7]。Tuo等[7]研究表明乳酸菌的自凝聚能力和疏水性与菌株的黏附能力存在一定的正相关性。尤其菌体表面疏水性是影响乳酸菌黏附性的内在因素,近几年来被广泛地作为评价乳酸菌黏附性能的重要指标。
细菌黏附与其细胞壁的组成成分密切相关。早在1985年,Camp等[8]在研究双歧杆菌黏附时发现,脂磷壁酸(Lipoteichoic acid,LTA)参与了乳杆菌黏附肠上皮细胞的过程。目前已发现,乳酸杆菌细胞表面的表层蛋白(Surface layer protein,SLP)、胞外多糖(Exopolysaccharide,EPS)、脂多糖(Lipopolysaccharide,LPS)以及肽聚糖(Whole peptidoglycan,WPG)等成分在乳酸菌的黏附过程中起到了一定的作用,因而这些成份也被称作黏附素[9-10]。而乳酸菌表层蛋白是目前研究最多,也是乳酸菌中比较普遍的一类黏附素。这些黏附素可以与肠道上皮细胞表面的受体发生特异性结合,随之引发一系列复杂的生理变化[11]。但是对于乳酸菌的黏附机制尚不明确。
本实验以实验室鉴定保藏完好的15株乳酸菌为研究对象,以具有良好黏附性能和益生功能的嗜酸乳杆菌NCFM作为对照,采用体外细胞培养和表面性质检测相结合的方法,对益生菌株黏附性质进行研究,筛选出高黏附乳酸菌菌株。再通过化学和酶处理乳酸菌细胞壁表面成分,经过cFDA-SE荧光标记后,测定黏附性质的变化,分析参与黏附的成分,确定主要黏附素。以期能对嗜酸乳杆菌KLDS1.0901的黏附机制进行初步探究。
1 材料与方法
1.1 材料与仪器
14株受试乳酸菌(见表1) 均为乳品科学教育部重点实验室保藏菌种,都分离自中国内蒙古地区传统发酵乳制品[12-14];嗜酸乳杆菌NCFM(参照菌株) 由东北农业大学姜毓君教授赠送;人体结肠腺癌细胞系Caco-2细胞株 购自中国科学院上海细胞库;MRS培养基 采用参考文献[12]的方法制备;M17肉汤培养基 北京天根生物技术有限公司;高糖DMEM培养基 美国HyClone公司;cFDA-SE 碧云天;青霉素-链霉素双抗、胰蛋白酶-EDTA 美国Gibco公司;MULTICELL胎牛血清 UK公司。
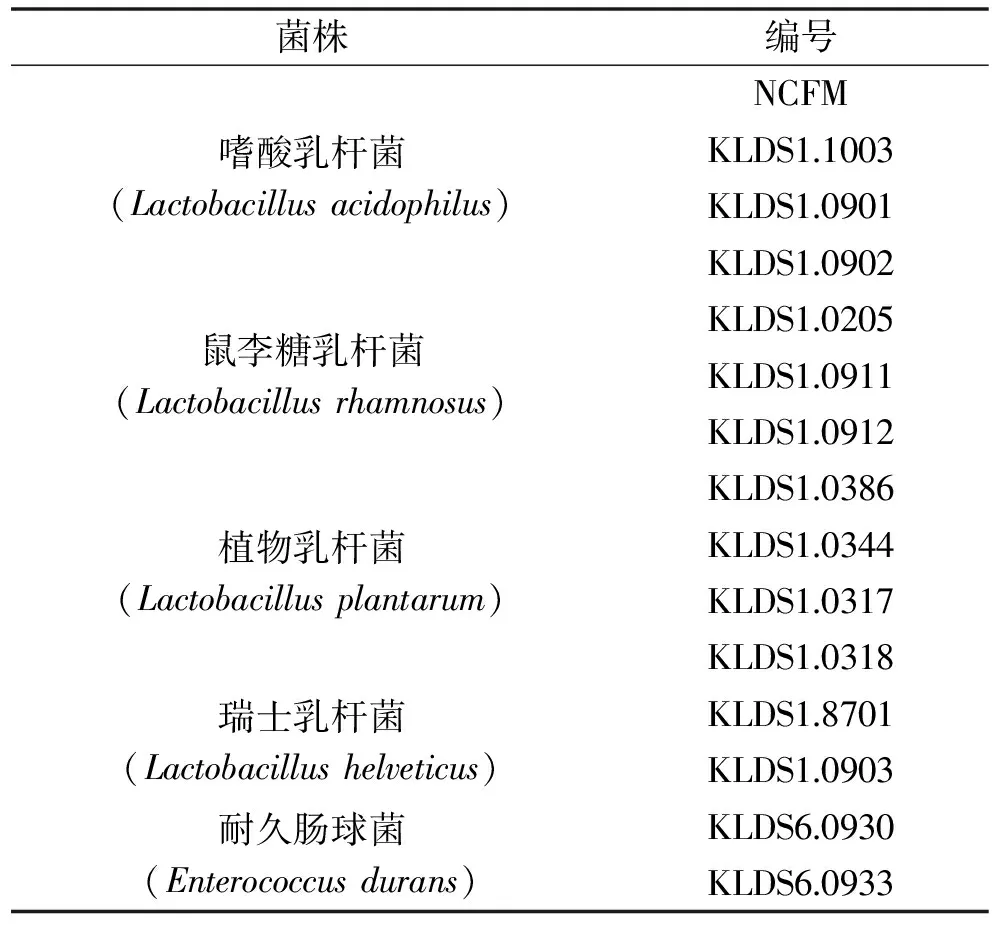
表1 15株受试乳酸菌Table 1 15 strains of tested lactic acid bacterias
HVE-50型高压灭菌锅 日本HIRAYAMA公司;ZHWY-100B型台式振荡器 上海智诚分析仪器制造有限公司;DB-3B型电子天平 沈阳龙腾电子有限公司;VD-1320型洁净工作台 北京东联哈尔仪器制造有限公司;GL-21M型高速冷冻离心机 上海市离心机械研究所有限公司;DHP-9272型电热恒温培养箱 上海一恒科技有限公司;Heal Force型细胞培养箱 力康医疗生物科技控股有限公司;DMLB型光学显微镜 德国徕卡显微镜与系统公司;SectrumLab54型紫外分光光度计 上海棱光技术有限公司;F4500荧光分光光度计 日本日立公司;Aira II流氏细胞仪 美国BD公司。
1.2 实验方法
1.2.1 乳酸菌的培养 将活化好的乳酸菌按体积分数为2%的接种量接种于MRS液体培养基中,37 ℃培养20 h,离心收集菌体(8000×g,4 ℃,10 min),用无菌PBS溶液(pH=7.2)洗涤2次后,将菌体重悬于PBS中,将菌悬液的A600调整至所需要的浓度。
1.2.2 表面疏水性测定 通过二甲苯萃取测定菌株的疏水性[15]。用PBS调整待测菌悬液的吸光度为OD600=0.25±0.05。取3 mL待用菌悬液,向其中加入等体积的二甲苯,漩涡振荡3 min后,在室温下孵化1 h(此时形成两相体系)。吸取水相,并测定其600 nm处的吸光度(A)。A0为萃取前待测菌悬液的吸光度。重复进行3次独立实验,取平均值。
疏水率(%)=[(A0-A)/A0]×100
1.2.3 自凝聚能力测定 乳酸菌的自凝聚实验采用任大勇[16]的方法并略作修改。按照1.2.1中的方法制备乳酸菌悬液。取2 mL菌液漩涡振荡10 s,测其吸光度(A0),再在37 ℃下静置2 h后,小心吸取其上清液1 mL,并测其吸光度(At)。自聚能力计算公式为:
自凝聚率(%)=[(A0-At)/A0]×100
1.2.4 Caco-2细胞黏附实验
1.2.4.1 细胞培养 从液氮罐中取出Caco-2细胞冻存管,迅速于37 ℃水浴锅反复摇动以迅速融化细胞,无菌条件下吸尽管中液体至10 mL无菌离心管中,加3 mL高糖DMEM培养基,在4 ℃条件下,1000 r/min离心5 min,弃上清;加入5 mL高糖DMEM培养基(补充10%的热灭活胎牛血清和1%双抗(青霉素浓度100 U/mL、链霉素100 μg/mL,经0.22 μm滤膜过滤除菌,并于4 ℃冰箱贮存备用[16]),用移液枪轻轻吹打混匀后转移至50 mL细胞培养瓶中,放入5% CO2培养箱中37 ℃培养;隔天更换新鲜高糖DMEM培养基;待细胞生长状态良好(贴壁生长为单层且培养瓶底部80%左右被细胞覆盖),用1 mL 0.25%胰蛋白酶-EDTA进行消化传代。传代四五次后,即可进行黏附试验。
1.2.4.2 乳酸菌悬液制备 同1.2.1中乳酸菌经无菌PBS洗涤两次后,再将离心收集的菌体,重悬于不含双抗的高糖DMEM培养基中,并调整菌悬液的浓度为108CFU/mL。
1.2.4.3 乳酸菌对Caco-2细胞的黏附能力 乳酸菌对Caco-2细胞的黏附试验采用Nueno-Palop等[17]的方法,并稍作改动。将Caco-2细胞以105细胞/孔的浓度从培养瓶传代接种至12孔板中,孔中培养液需每隔一天更换一次,待细胞贴壁完全后,继续培养10 d,细胞处于极化状态时方可进行实验。在进行试验的前一天,向孔板中加入不含双抗的高糖DMEM培养基。添加乳酸菌之前,用无菌PBS洗涤孔板中单层Caco-2细胞两次,再向每个孔中加入500 μL浓度为108CFU/mL(V0)的乳酸菌;将12孔板转移至5% CO2培养箱中,37 ℃培养2 h后;用PBS溶液洗涤12孔板中每孔的单层细胞层3次以上,以洗脱没有黏附的细菌和代谢分泌物。然后向每个孔中加入250 μL 0.25%胰蛋白酶-EDTA孵育10 min;再加入250 μL血清终止消化;收集每个孔内溶液,并分别进行10倍梯度稀释,采用平板菌落计数法检测培养后菌株的活菌数(V1)。黏附率(%)计算方法如下:
黏附率(%)=(V1/V0)×100
1.2.4.4 乳酸菌对Caco-2黏附观察 将Caco-2细胞以105/孔接种于含有载玻片的六孔板中,其他试验步骤同1.2.4.3中的处理。乳酸菌与细胞在37 ℃ 5% CO2培养箱中共同孵育2 h后,用无菌PBS缓冲液洗涤三次;取出载玻片,用0.4%的多聚甲醛固定30 min,自然晾干后,进行革兰氏染色,光学显微镜下观察乳酸菌的黏附情况。
1.2.5 乳酸菌的荧光标记 用二甲基亚砜(DMSO)溶液配制1 mmol/L cFDA-SE储备液[18]。用0.22 μm滤膜过滤除菌后,避光储存在-20 ℃中备用。将菌体重新悬于PBS溶液中,配制活菌体浓度为108CFU/mL,再向悬浮的乳酸菌中加入cFDA-SE储备液,至最终浓度为20 μmol/L,37 ℃避光静置15 min,离心(8000 r/min,4 ℃,10 min),再用PBS洗涤三次,除去多余的荧光染料。再将菌体重悬于无菌PBS溶液中。用流式细胞仪检测分析cFDA-SE标记情况(激发波长为488 nm)。
1.2.6 化学和酶处理对乳酸菌黏附性的影响
1.2.6.1 氯化锂处理 乳酸菌经PBS洗涤2次后,离心(8000×g,4 ℃,10 min)收集菌体,加入1 mL的5 mol/L 氯化锂溶液,用移液枪吹打均匀,于37 ℃摇床(200 r/min)孵育1 h。
1.2.6.2 饱和苯酚处理 将乳酸菌菌体悬浮于1 mL饱和苯酚溶液中,65 ℃作用30 min,之后在室温下漩涡混合30 min。
1.2.6.3 高碘酸钠处理 将乳酸菌菌体悬浮在1 mL 0.05 mol/L高碘酸钠溶液中,37 ℃孵育30 min。
1.2.6.4 胃蛋白酶处理 将胃蛋白酶溶解于0.05 mol/L甘氨酸-HCl 缓冲液(pH2.2)中,制成400 U/mL的溶液,然后0.22 μm滤膜过滤除菌。将乳酸菌菌体悬浮于1 mL胃蛋白酶溶液中,37 ℃作用30 min。
1.2.6.5 胰蛋白酶处理 将胰蛋白酶溶解于0.2 mol/mL的PBS(pH8.0)中,制成400 U/mL的溶液,然后0.22 μm滤膜过滤除菌。将菌体悬浮于胰蛋白酶溶液中,37 ℃作用30 min。
1.2.6.6 热处理 将菌体重悬于PBS溶液,于100 ℃水浴锅中加热5 min。
将以上不同处理过的菌体离心(8000 r/min,4 ℃,10 min),重新悬于PBS溶液,调整其浓度为108CFU/mL,荧光标记后进行黏附实验,以未进行任何处理的乳酸菌作为对照。考虑到化学和酶处理对荧光标记的影响,以黏附实验后的荧光强度比上相同处理乳酸菌的荧光强度值为黏附率。
1.3 数据处理
实验结果均以平均数±标准差来表示,采用Origin 8.0 对实验数据进行做图及拟合处理。运用SPSS 20.0 软件进行独立样本T检验和单因素方差分析。
2 结果与分析
2.1 乳酸菌的疏水性
由图1可知,15株乳酸菌中,耐久肠球菌KLDS6.0933的表面疏水性为30.00%,远高于其他14株受试乳酸菌。嗜酸乳杆菌KLDS1.1003和KLDS1.0901的疏水性次之,分别为12.66%、13.88%。实验结果也表明:同一种乳酸菌不具有相似的疏水性。这与Tuo等[7]的实验结果一致。嗜酸乳杆菌KLDS1.0902的疏水性仅为1.07%,显著低于(p<0.05)KLDS1.1003和KLDS1.0901;鼠李糖乳杆菌KLDS1.0205的疏水性为5.79%,高于KLDS1.0911和KLDS1.0912。同样,对于受试的4株植物乳杆菌,KLDS1.0344和KLDS1.0318的疏水性要显著高于KLDS1.0386、KLDS1.0317(p<0.05)。
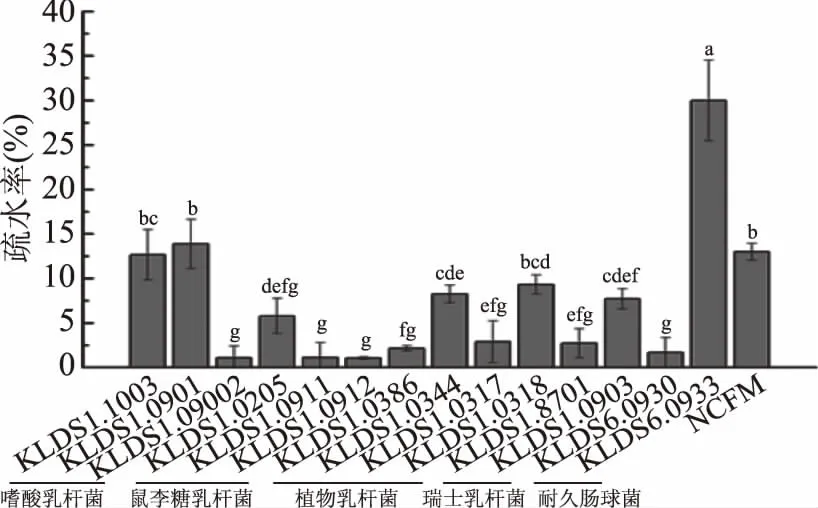
图1 15株乳酸菌的表面疏水性Fig.1 Cell surface hydrophobicity of 15 strains of lactic acid bacterias注:小写字母不同表示差异显著(p<0.05);图2、图3、图7同。
2.2 乳酸菌的自凝聚能力
菌株的自凝聚能力结果见图2。对于相同菌种,不同菌株间的自凝聚能力没有相似性。15株乳酸菌均具有自凝聚能力,但部分菌株之间的自凝聚能力差异显著(p<0.05)。植物乳杆菌KLDS1.0386、KLDS1.0317以及耐久肠球菌KLDS6.0933自凝聚能力最强,分别为87.25%、87.98%和88.07%,显著高于其他菌株(p<0.05)。自凝聚集能力最差的是瑞士乳杆菌KLDS1.0903,凝集率仅为51.28%。
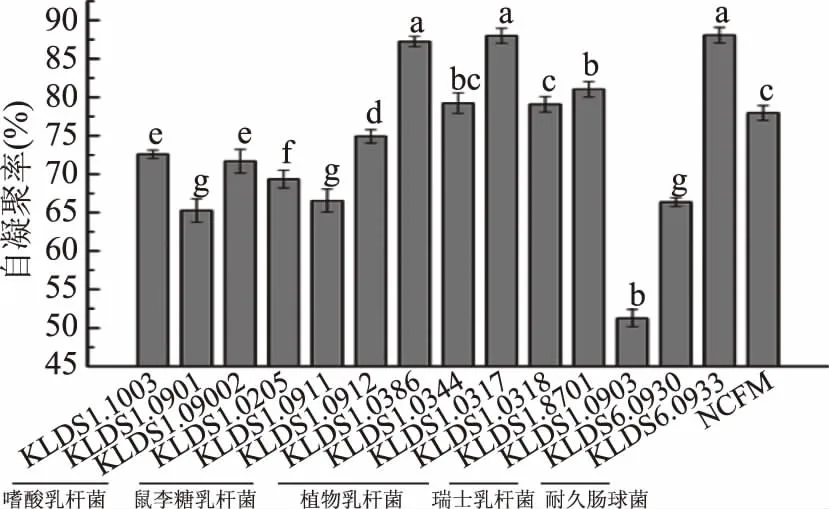
图2 15株乳酸菌的自凝聚能力Fig.2 Auto-agglutination ability of 15 lactic acid bacterias
2.3 乳酸菌对Caco-2细胞黏附能力分析
乳酸菌与Caco-2细胞共培养2 h后,去除未黏附的乳酸菌,将黏附的乳酸菌按倍数稀释后,涂布在乳酸菌相对应的固体培养基培养计数,实验结果见图3。15株乳酸菌的黏附率从0.13%~12.73%不等。嗜酸乳杆菌NCFM对Caco-2细胞的黏附率为11.23%。嗜酸乳杆菌KLDS1.0901和植物乳杆菌KLDS1.0318的黏附性分别为12.73%和12.695%,略高于嗜酸乳杆菌NCFM,并显著高于其他受试菌株(p<0.05)。耐久肠球菌KLDS6.0930和植物乳杆菌KLDS1.0903次之,分别为9.13%和8.50%。三株受试的鼠李糖乳杆菌黏附能力均非常低,都不足2%。
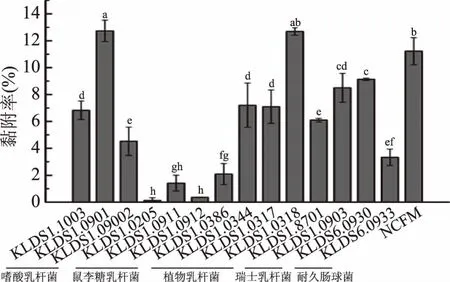
图3 15株乳酸菌对Caco-2细胞的黏附分析Fig.3 Adhesion capacity to Caco-2 of 15 lactic acid bacterias
2.4 乳酸菌对Caco-2黏附观察
结合2.3中的结果,选取黏附性良好的嗜酸乳杆菌KLDS1.0901、植物乳杆菌KLDS1.0318和嗜酸乳杆菌NCFM,以及黏附性差的鼠李糖乳杆菌KLDS1.0205与分化完成的单层Caco-2细胞共同孵育2 h后,进行革兰氏染色,用显微镜观察黏附情况。如下图4所示,可以直观的看出KLDS1.0901、KLDS1.0318和NCFM密集的围绕在Caco-2细胞的周围,而黏附的KLDS1.0205的数量明显变少。这与2.3中的结果相符。
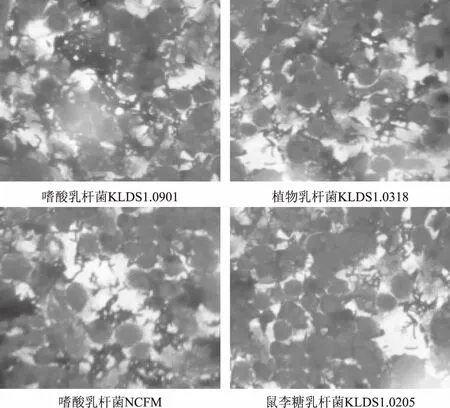
图4 乳酸菌黏附Caco-2细胞的显微镜照片(1000×)Fig.4 Microscopic photograph of lactic acid bacteria adhering to Caco-2 cells(1000×)
2.5 乳酸菌的荧光标记
如下图5所示,cFDA-SE荧光染料对嗜酸乳杆菌KLDS1.0901标记率高达99.8%,可用于后续的实验。
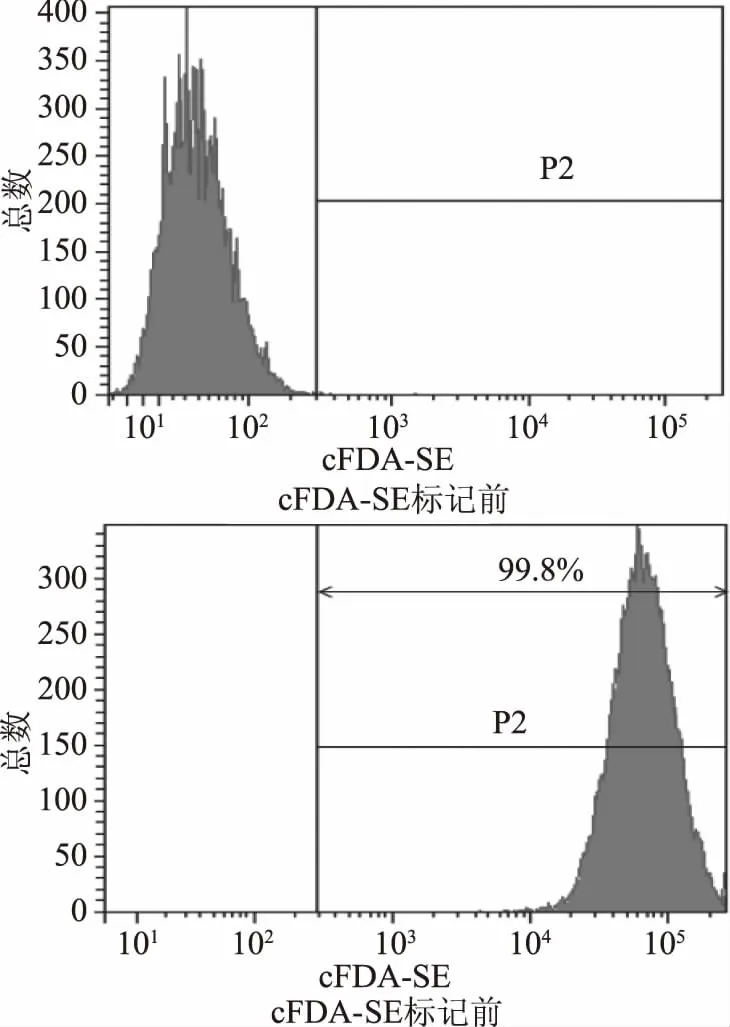
图5 cFDA-SE对KLDS1.0901的荧光标记率Fig.5 Fluorescent labeling of KLDS1.0901 cells using cFDA-SE
2.6 化学和酶处理对黏附的影响
化学和酶处理对KLDS1.0901黏附能力影响如图6所示。KLDS1.0901对高碘酸钠、苯酚、氯化锂、热处理均具有敏感性,KLDS1.0901经这些物质处理后黏附率显著降低(p<0.05)。相比于空白对照组(18.95%),KLDS1.0901经过氯化锂处理后,黏附率降到8.59%。说明菌体细胞表层蛋白可能是影响其黏附Caco-2细胞的主要黏附素。与空白组相比,胰蛋白酶和胃蛋白酶处理也能降低KDS1.0901的黏附率(p<0.05),但二者之间的差异不显著(p>0.05)。所以KLDS1.0901黏附Caco-2细胞可能是以表层蛋白为主的多种黏附素共同作用的结果。
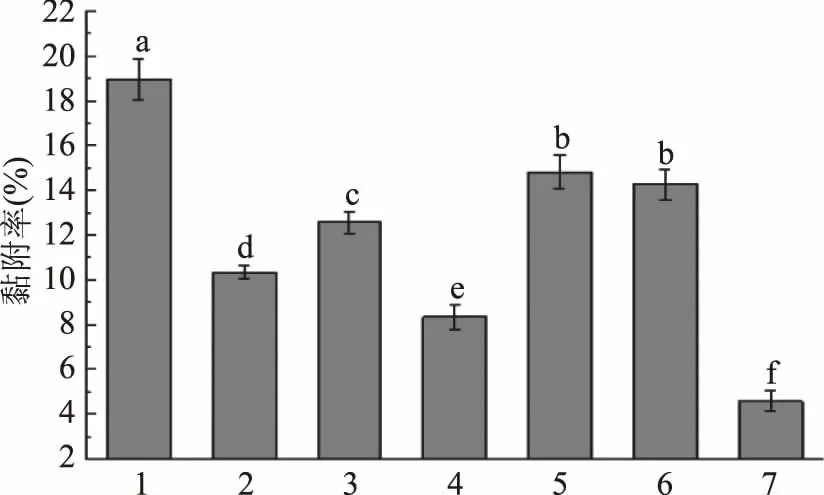
图6 化学和酶处理对KLDS1.0901黏附能力的影响Fig.6 Effects of chemical and enzymatic treatments on adhesion of KLDS1.0901 to Caco-2 cells注:1:空白对照;2:高碘酸钠;3:苯酚;4:氯化锂;5:胃蛋白酶;6:胰蛋白酶;7:热处理。
3 讨论
乳酸菌可通过抑制病原体的侵袭,改善肠道上皮屏障功能,调节宿主免疫系统等来发挥有益作用。而乳酸菌在胃肠道中的黏附和定植是其在人体内表现益生功效的先决条件[19]。对乳酸菌菌株的自凝聚能力、疏水性和对肠上皮细胞系(Caco-2和HT-29细胞)的黏附能力的评估,已经被作为筛选具有益生菌潜力的菌株的体外方法。在研究乳酸菌与肠道黏附的过程中,常使用Caco-2和HT-29细胞模型进行体外实验[20],但是这些方法耗时长且昂贵。大量的研究结果表明,细菌的黏附能力与菌体表面性质存在较大的相关性[21-22]。近几年,自凝聚集能力和疏水性被广泛地用于评价细菌黏附性。李清等[23]]测定10株不同来源的植物乳杆菌的表面疏水性以及体外黏附Caco-2细胞的能力,发现对细胞的黏附能力与表面疏水性存在着显著的相关性。然而,也有研究发现,认为两者之间没有相关性[24]。
因此本实验采用表面性质检测和体外细胞培养相结合的方法,测定了15株乳酸菌的表面疏水性和自凝聚能力,并采用平板计数和显微镜观察的方法研究乳酸菌对Caco-2细胞黏附状态和数量的差异。结果表明15株乳酸菌的疏水性和自凝聚能力与其黏附性并没有对应关系,疏水性和自凝聚能力高的菌株,其黏附能力并不一定高,如耐久肠球菌KLDS6.0933的疏水性高达30%,其黏附能力却很低。但是嗜酸乳杆菌KLDS1.0901的疏水性仅为13.88%,其黏附性能却是受试菌株中最高的。这与Tuo等[7]的研究结果相似。并且嗜酸乳杆菌KLDS1.0901和植物乳杆菌KLDS1.8701的黏附能力略高于商业嗜酸乳杆菌NCFM的黏附能力,具有益生菌的潜力,可做进一步的深入研究。15株乳酸菌对细胞的黏附能力不仅存在菌种差异性,也存在菌株差异性。Murphy[25]研究结果也证实了不同菌种之间的黏附性差异很大,即使菌种相同,在菌株水平上,黏附能力也具有差异性。由此可见,黏附能力与乳酸菌的自身性质存在着必然联系。
乳酸菌在肠道中定植的前提是其必须黏附于宿主细胞表面。黏附不仅涉及与表面性质有关的非特异性黏附,还包括与黏附素有关的特异性黏附[26]。目前已发现的黏附素包括脂磷壁酸、表层蛋白、菌毛、肽聚糖以及脂多糖等。这些黏附素可以与肠道细胞表面的受体进行特异性结合。对乳酸菌黏附素进行研究有利于阐述乳酸菌的黏附机制。化学或酶处理被普遍地用于研究乳酸菌的黏附素[27]。本实验中高碘酸钠处理可以显著的降低KLDS1.0901的黏附性,说明一些糖类物质参与了黏附过程。苯酚处理可以破坏细胞表面的脂磷壁酸和非纤维状蛋白,所以脂磷壁酸和蛋白均有可能参与到KLDS1.0901对Caco-2细胞的黏附中。氯化锂处理可显著降低黏附率,表明以非共价结合的方式存在于细胞表面的表层蛋白,可能是影响黏附效果的主要黏附素。胃蛋白酶和胰蛋白酶处理虽然也能降低黏附率,但二者的作用效果并无显著差异,说明KLDS1.0901的黏附素对二者的敏感度相似。热处理可强烈破坏细胞壁的完整结构,说明细胞表面的黏附素对热敏感或者热处理可以使其从细胞表面脱落,导致了KLDS1.0901黏附能力极低。综合以上分析,表明KLDS1.0901对Caco-2细胞的黏附可能是多种黏附素共同作用的结果[29]。
以后的研究将进一步确定与黏附有关的物质及黏附机制。此外,具有高黏附能力的乳酸菌有利于调节肠道微生态环境以及启动免疫应答,为功能性食品的开发提供可能。实验结果表明,嗜酸乳杆菌KLDS1.0901和植物乳杆菌KLDS1.8701具有良好的黏附能力,其表面黏附物质的属性及在黏附中发挥作用的具体机制有待进一步研究。
4 结论
本研究表明嗜酸乳杆菌KLDS1.0901和植物乳杆菌KLDS1.8701的黏附能力略高于商业嗜酸乳杆菌NCFM的黏附能力,具有益生菌的潜力,可进一步深入研究其黏附于肠道后对宿主产生的益生效应。化学和酶处理KLDS1.0901,尤其是氯化锂和热处理能显著降低KLDS1.0901的黏附性,表明以表层蛋白为主的多种黏附素可能参与了KLDS1.0901对Caco-2细胞的黏附。实验表明嗜酸乳杆菌KLDS1.0901是1株具有良好黏附能力的益生菌,且可能含有丰富的表层蛋白,其黏附的其他性质和详细的黏附作用机制有待今后进一步研究。
