川西北沙化土壤对镉和丁草胺的吸附特征
2018-12-26李云桂武彩霞杨慧敏
李云桂 罗 湘 武彩霞 杨慧敏 魏 良
(1.西南科技大学环境与资源学院 四川绵阳 621010; 2.低成本废水处理技术四川省国际科技合作基地 四川绵阳 621010)
土壤沙化是在风蚀、水蚀、风力、水力等沉积作用下,有机质含量、阳离子交换量、比表面积、黏土矿物较多的土壤变成含沙量较多的土壤,甚至变成沙漠的过程[1]。其中,有机质含量是评估土壤沙化退化的重要指标[2]。近年来, 我国的土壤沙化问题日趋突出,90%以上的草地已经或者正在退化,其中中度沙化程度以上的草地占全国草地面积30%以上[3],从某种意义上讲,未沙化的草地已经很难找到。在川西北地区,由于牧民过度放牧、毁林开荒等人为因素,气候干旱多风的自然因素,造成土壤大面积沙化退化。草地沙化对生态系统、社会生产和环境安全都会带来严重问题[4]。
与土壤沙化共存的是,我国土壤还面临严重的重金属和有机污染问题。据2014年《全国土壤污染状况调查公报》显示,我国土地重金属污染面积点位超标率为21.7%,有机污染面积点位超标率为3.8%。镉(Cd)作为一种生物毒性极强的重金属微量元素[5],近年来随着工业和农业的快速发展导致镉的用量大大增加[6],造成了大量土壤被污染,镉污染耕地超标面积达148.68万 hm2[7]。丁草胺作为一种环境毒性较高的农田除草剂[8-10],年产量达1×107kg,且每年呈逐渐增加的趋势[11]。滥用除草剂使得大量的丁草胺残留,因其较强的疏水性,丁草胺可在土壤中持续积累,是土壤有机污染的重要组成[12-13]。土壤中的重金属和有机污染,一方面事关农产品安全生产,另一方面迁移进入地下水循环,危害人体健康和生态安全[12,14]。土壤中污染物的迁移性主要与土壤的吸附过程息息相关,土壤吸附性能越弱,污染物进入地下水的风险越大[15-16]。
土壤沙化与土壤污染问题共存,研究两者的相互作用关系具有重要的理论意义,但当前相关文献鲜有报道。本文以四川省阿坝藏族羌族自治州中部沙化面积较大的红原县为代表区域,采集泥炭、未沙化、轻度沙化和中度沙化土壤,以镉(重金属)和丁草胺(有机污染物)为代表,研究沙化过程对污染物在土壤上的吸附行为,为准确评价沙化土壤的环境污染风险提供理论依据。
1 材料与方法
1.1 供试土壤
本研究所采用的土壤采自四川省阿坝藏族羌族自治州中部沙化土地面积较大的红原县瓦切乡。根据GB 19377将不同沙化程度的土壤区分为泥炭(PS)、未沙化土壤(ND)、轻度沙化土壤(LD)、中度沙化土壤(MD)为供试土壤。每个土壤选择两个样方,样方大小为10 m×10 m,样方内随机选取3个取样点,随机取样,采样深度为0~10 cm,供试土壤经室内风干、去除碎石、枯枝败叶等杂质后磨碎过100目筛,密封保存备用。供试土壤的来源如表1所示。
1.2 供试土壤理化性质的测定
土壤pH值采用玻璃电极法测定,固液比为1∶2.5;土壤比表面积(SSA)根据 BET 理论,采用 N2吸附法用 ST-08 型比表面积测定仪进行测定;土壤阳离子交换量(CEC)采用中性 NH4OAc 法测定[17];有机质含量(SOM)采用K2Cr2O7氧化-外加热法测定。供试土壤的理化性质见表1。
1.3 主要试剂及设备
主要试剂:Cd(NO3)2·4H2O(分析纯,成都市科龙化工试剂厂);C17H26ClNO2(丁草胺)(优级纯,西格玛奥德里奇(上海)贸易有限公司);CaCl2(分析纯,成都市科龙化工试剂厂);NaN3(分析纯,成都市科龙化工试剂厂);HNO3(优级纯,成都金山化学试剂有限公司);CH3OH(优级纯,成都市科龙化工试剂厂);优普超纯水制造系统(四川优普超纯科技有限公司)。

表1 供试土壤来源及其基本理化性质Table 1 Basicphysicochemical properties and sources of the tested soils
主要设备:PE900T火焰原子吸收光谱仪(珀金埃尔默(PerkinElmer)仪器(上海)有限公司);Agilent高效液相色谱(美国安捷伦有限公司);BSA224S型电子天平(北京赛多利斯科学仪器公司);ZWY-211C型恒温振荡器(上海智城分析仪器有限公司);TGL-16C台式高速离心机(上海安亭科学仪器厂)。
1.4 吸附实验
吸附背景溶液:pH值7.0,0.01 mol·L-1CaCl2和200 mg·L-1NaN3溶液,其中用0.01 mol·L-1的CaCl2控制离子强度,200 mg·L-1NaN3用于抑制微生物,以防止化合物降解对吸附实验带来的影响。
吸附质浓度的测定:采用PE900T原子吸收光谱仪测定镉的浓度,波长λ=228.8 nm,检测限为3 mg·L-1。采用Agilent高效液相色谱(1 260)测定丁草胺的浓度,流动相乙腈/水(80/20),流动相速度1 mL·min-1,色谱柱为C18反相柱(5 μm,4.6 mm×150 mm),柱温25 ℃,进样量60 μL,采用紫外检测器,检测波长为λ=197 nm,保留时间为6 min。
镉吸附实验:称取300 mg泥炭和未沙化土壤、1 000 mg 轻度沙化和中度沙化土壤于20 mL样品瓶中,加入20 mL镉溶液,放入恒温振荡器25 ℃,150 r·min-1下避光密封振荡吸附。每个时间点/浓度点设置2个平行和2个空白对照(不加土样),吸附结束后4 000 r·min-1下离心20 min,取上清液用1%的硝酸溶液稀释后测定浓度。吸附动力学实验中,镉初始浓度为60 mg·L-1,时间设置为0,0.083,0.167,0.5,1.0,1.5,2.0,3.0 h。等温吸附实验中,吸附时间设置为24 h,镉初始浓度设置为0,5.0,9.4,19,38,69,142,286 mg·L-1。
丁草胺吸附实验:称取100 mg泥炭和未沙化土壤、300 mg轻度沙化和中度沙化土壤于20 mL样品瓶中,加入丁草胺溶液20 mL,放入恒温振荡器25 ℃,150 r·min-1下避光密封振荡吸附,每个时间点/浓度点设置2个平行和2个空白对照(不加土样),吸附结束后4 000 r·min-1下离心20 min,取上清液用背景溶液稀释后测定浓度。吸附动力学实验中,丁草胺的初始浓度为16.72 mg·L-1,时间设置为0,3,6,9,12,24,48,72,120,168 h。等温吸附实验中,吸附时间设置为72 h,丁草胺初始浓度设置为0,2.09,2.79,4.18,5.58,8.36,11.15,16.72 mg·L-1。
1.5 数据处理
相关数据统计分析和作图分别采用Excel 2013和Origin 9.0软件完成。
根据吸附样品与空白之间的浓度差异,计算单位土壤上的吸附量Qt和Qe:
(1)
(2)
式中Qt和Qe分别为t时刻和吸附平衡时的吸附量,mg·kg-1;Ce为吸附达到平衡后测定得到的镉的浓度,mg·L-1;Co和Ct分别为测定得到的吸附之前和经过长达t时间的吸附之后溶液中镉的浓度,mg·L-1;V为吸附实验中添加的镉溶液的体积,mL;m为土壤的质量,mg。
采用准一级动力学模型(式(3))和准二级动力学模型(式(4))拟合吸附动力学曲线:
Qt=Qe(1-e-k1t)
(3)
(4)
式中,Qt和Qe分别为t时刻和吸附平衡时的吸附量,mg·kg-1;t为吸附时间,h;K1为一级吸附反应速率常数,min-1;K2为二级吸附反应速率常数,kg·mg-1·h-1。
分别采用Linear(式(5))、Freundlich(式(6))、Langmuir(式(7))等温吸附模型拟合受试土壤的等温吸附曲线。
Qe=Kd×Ce
(5)
logQe=logKf+NlogCe
(6)
(7)
式中,Qe为吸附平衡时土壤对镉的吸附量,mg·kg-1;Qm为理论计算时单位吸附剂吸附镉的量,mg·kg-1;Ce为吸附平衡时溶液中镉的浓度,mg·L-1;Kd为镉离子在土壤和溶液中的分配系数,L·kg-1;KL为土壤吸附镉的强度因子,L·mg-1;Kf,N为Freundlich吸附常数。
根据土壤对镉的吸附容量和受试土壤中有机质含量计算有机质标化吸附量(式(8))。
(8)
式中,Qe为吸附平衡时土壤对镉的吸附量,mg·kg-1;SOM为受试土壤中有机质的含量,g·kg-1;Qe,om为有机质标化吸附量,mg·g-1。
根据式(9)计算丁草胺的有机质标化分配系数:
(9)
式中,Kom为有机质标化分配系数,L·g-1;Kd为丁草胺在受试土壤上的吸附分配系数,L·kg-1;SOM为受试土壤中有机质含量,g·kg-1。
2 结果与讨论
2.1 吸附动力学
镉和丁草胺在受试土壤上的吸附动力学曲线如图1所示。
4种土壤对镉的吸附速率大致呈现先快后慢的变化趋势,在30 min内达到吸附平衡。土壤对镉的吸附过程分为两个阶段,即开始的快速吸附阶段和经过一段时间的慢速吸附阶段[15,18]。在反应前5 min,泥炭、未沙化、轻度沙化、中度沙化土壤对镉的吸附量可达平衡吸附量的96%,91%,92%和88%,这与王展等(2012)研究结果相似[18]。前5 min吸附速率快,这与土壤表面的吸附位点有关,吸附初期土壤表面吸附位点多,吸附速率快。随着时间的增加,被占据的吸附位点逐渐增多,吸附速率逐渐降低,直到土壤表面的吸附位点全部占据[19]。
4种土壤对丁草胺的吸附动力学也呈现先快后慢的基本特征,吸附量先急剧增加,而后逐渐趋于平稳,24 h内达到吸附平衡。反应前9 h,泥炭、未沙化、轻度沙化、中度沙化土壤对丁草胺的吸附量可达平衡吸附量的69.7%,62.3%,46.9%和9.70%。反应前12 h,泥炭、未沙化、轻度沙化、中度沙化土壤对丁草胺的吸附量可达平衡吸附量的93.5%,91.1%,90.3%和77.2%。文献表明,丁草胺在土壤上的吸附一般均在24 h达到平衡[16,20],也有研究发现吸附平衡时间达60 h[11]。
分别采用准一级和准二级动力学模型对吸附动力学曲线进行拟合,拟合参数见表2。准二级动力学模型能更好地描述镉的动力学吸附行为(R2≥0.97),准一级动力学模型能更好的描述丁草胺的动力学吸附行为(R2≥0.87)。
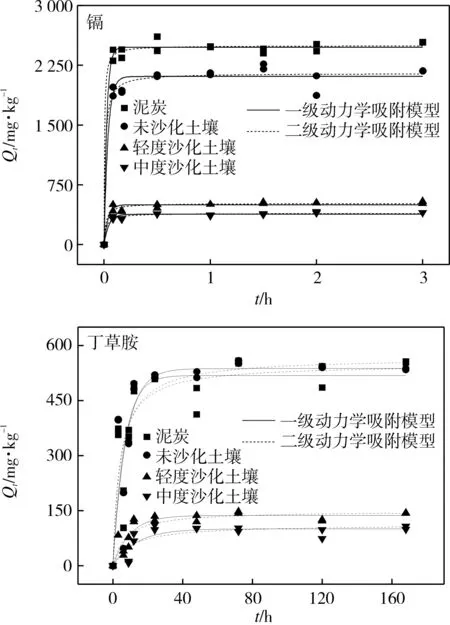
图1 镉和丁草胺在受试土壤上的吸附动力学曲线Fig.1 Sorption kinetics of cadmium and butachlor onto four selected soils
为评估沙化对镉和丁草胺吸附动力学的影响,采用准一级动力学模型拟合参数来进行对比。受试土壤对镉和丁草胺的吸附动力学存在显著差异,对镉的吸附速率较快,吸附达到平衡所需的时间更短。如表2所示,泥炭和未沙化土壤对丁草胺的吸附速率基本相当(0.15 min-1和0.13 min-1)。沙化后,轻度沙化和中度沙化土壤对丁草胺的吸附速率下降23%和43%(K1从0.13减至0.10,0.074 min-1)。泥炭对镉的吸附速率(38.0 min-1)略高于未沙化土壤(27.0 min-1)。沙化后,轻度沙化和中度沙化土壤对镉的吸附速率下降1.5%和18%(K1从27.0 min-1减至26.6,22.1 min-1)。沙化后,土壤对污染物的吸附速率快速下降,这与沙化后SOM含量下降有关。刘忠珍(2007)等研究发现,有机质是控制丁草胺吸附速率的主要因素。随着SOM的下降(从54.7 g·kg-1减至2.52 g·kg-1),丁草胺的吸附速率也下降60%[11]。
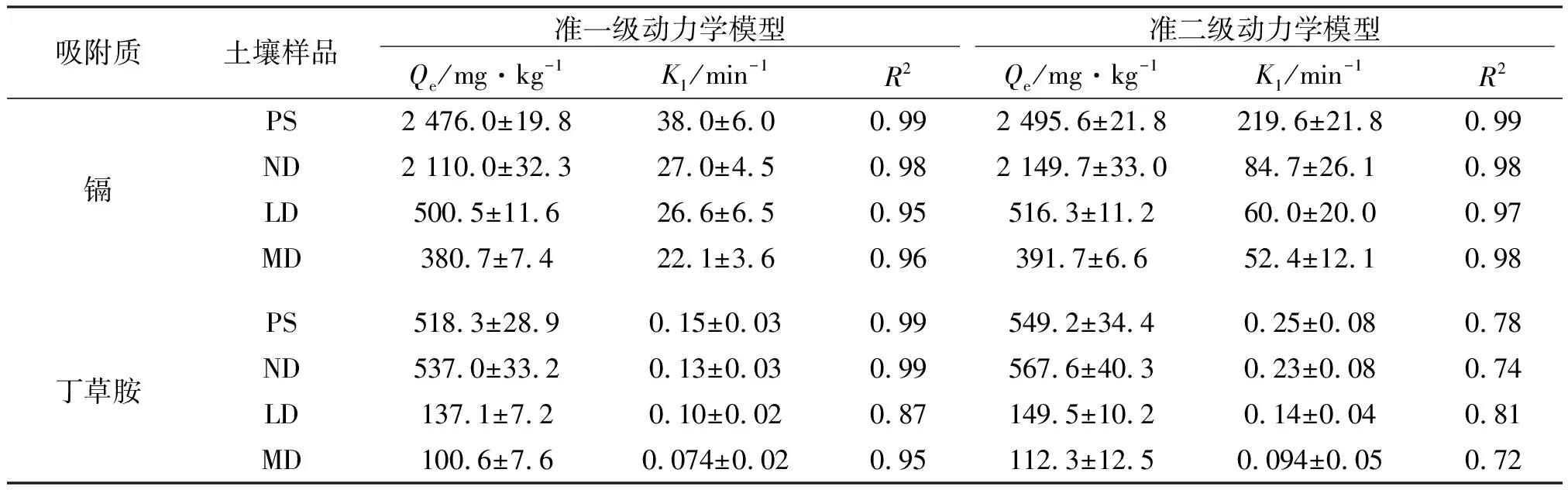
表2 镉和丁草胺在4种受试土壤上的吸附动力学拟合参数Table 2 Regression parameters of pseudo-first-order, pseudo-second-order kinetic models for the sorption of cadmium and butachlor onto four selected soils
2.2 等温吸附曲线
镉和丁草胺在受试土壤上的等温吸附曲线如图2所示。随着初始浓度的增加,镉吸附量先急剧增加,而后缓慢增加。沙化对土壤吸附镉具有重要影响。在相同初始浓度下,镉的平衡吸附量均表现为泥炭>未沙化土壤>轻度沙化土壤>中度沙化土壤。随着镉浓度的增加,4种土壤对镉吸附性能差异增加。当镉初始浓度为4.95 mg·L-1时,泥炭的吸附量为266 mg·kg-1,比未沙化、轻度沙化、中度沙化土壤分别高33.1,204,254 mg·kg-1。而当镉初始浓度为 38.3 mg·L-1时,泥炭的吸附量比其他3种土壤分别高285,1 399,1 500 mg·kg-1。李朝丽(2007)等研究也发现黑土、黄泥土、黄棕壤和红壤对镉的吸附量差异随镉浓度的增大而增大[23]。Langmuir(R2≥0.97)和Freundlich(R2=0.99)模型均能较好拟合4种土壤对镉的吸附过程,等温吸附模型回归参数见表3。泥炭和未沙化土壤对镉的饱和吸附量LangmuirQm分别为11 675和9 467 mg·kg-1。沙化后,土壤对镉的吸附性能显著下降。与未沙化土壤相比,轻度和中度沙化土壤对镉的饱和吸附量下降83.5%和 71.8%,Qm为1 566 mg·kg-1和776 mg·kg-1。
随着初始浓度的增加,4种受试土壤对丁草胺的吸附量呈线性增加趋势。泥炭和未沙化土壤对丁草胺的吸附量基本相当,而未沙化、轻度沙化和中度沙化土壤的吸附量差异较大并且随着浓度的增大而增大。当丁草胺初始浓度为1.99 mg·L-1时,泥炭对丁草胺的吸附量为122 mg·kg-1,泥炭比未沙化、轻度沙化、中度沙化土壤分别高5.00,94.3,101 mg·kg-1;而当丁草胺初始浓度为11.0 mg·L-1时,泥炭的吸附量与其他3种土壤吸附量差异分别增加到7.40,445,484 mg·kg-1。Linear(R2≥0.96)和Freundlich(R2≥0.98)模型均能较好拟合4种土壤对丁草胺的吸附过程,等温吸附模型回归参数见表3。丁草胺的吸附等温线具有良好的线性吸附特征(R2≥0.96,FreundlichN,0.84~1.0),吸附主要以分配作用为主。泥炭和未沙化土壤的分配系数基本相当,Kd分别为179,178 L·kg-1。与未沙化土壤相比,轻度和中度沙化土壤对丁草胺的分配系数下降79.7%和88.4%,Kd为36.2,20.7 L·kg-1。
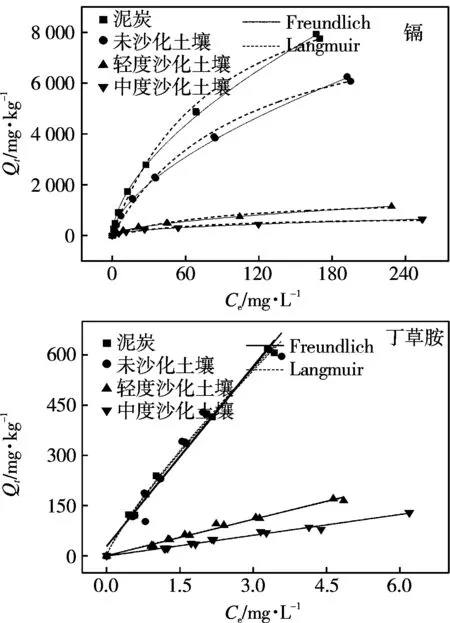
图2 镉和丁草胺在受试土壤上的等温吸附曲线Fig.2 Sorption isotherms of cadmium and butachlor onto four selected soils
如上所述,沙化后土壤对镉和丁草胺的吸附性能急剧下降。沙化后,镉和丁草胺更倾向存在于溶液中,倾向通过土壤径流扩散,使得污染物的生物有效性增加,相应的环境风险显著增加[21]。
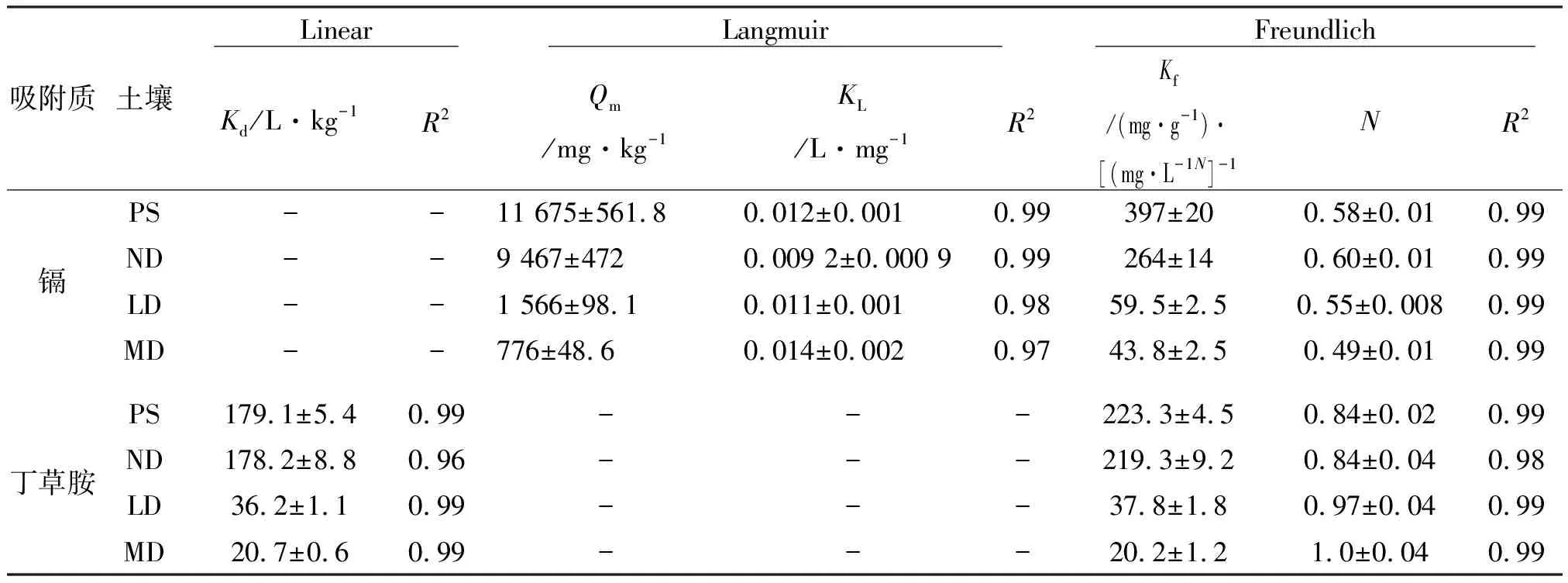
表3 镉和丁草胺在4种受试土壤上的等温吸附曲线的拟合参数Table 3 Regression parameters of Linear, Langmuir and Freundlich model for sorption isotherms of cadmium and butachlor onto four selected soils
注:“-”是不能正常拟合对应的模型。
2.3 土壤有机质在镉和丁草胺吸附中的作用
沙化后,土壤对镉和丁草胺的吸附容量急剧下降,与其理化性质的显著变化有关。如表1所示,沙化后,土壤pH值略有增加,比表面积(SSA)几乎不变,SOM(下降78.3%~87.8%)显著降低。这表明土壤的吸附性能可能与SOM的改变有关,为进一步评估SOM对吸附行为的影响,图3和图4拟合了镉吸附量与SOM的相关性,图5为丁草胺吸附系数与SOM的相关性。
由图3可知,土壤对镉饱和吸附量与SOM呈显著正相关(y=76.7x-429,R2=0.99),表明SOM是土壤吸附镉的主要介质。不同浓度下土壤对镉的平衡吸附量与SOM也呈正相关(R2=0.99)。值得关注的是,随着初始浓度的增加(从5.00 mg·L-1增至286 mg·L-1, 57.2倍),SOM的影响逐渐增强,镉的有机质标化平衡吸附量(Qe,om)逐渐增大(从1.57 mg·g-1增至50.1 mg·g-1,31.9倍)。可见,污染物浓度较低时,沙化对镉吸附性能的影响较小,随着污染物浓度增大,沙化的影响大幅增强,表明沙化后土壤面临高浓度的污染物时,污染物的生物有效性增强,环境风险增大。如图4所示,随着初始浓度的逐渐增大,镉的有机质标化吸附量线性增加(y=0.17x+3.00,R2=0.98)。在实验设定的最大镉初始浓度的条件下,受试土壤对镉的吸附仍未达到饱和,且此浓度时供试土壤表面有足够的吸附位点。有机质之所以是影响土壤对镉吸附的重要影响因素,是由于土壤有机质的腐殖酸结构中具有很高的分子量以及含有许多极性功能团的无定型物质,能够提供与化合物结合的特殊位点[20]。沙化后,土壤有机质含量减少,其吸附位点相应减少,从而减少土壤对镉的吸附。
如图5所示,土壤对丁草胺的吸附分配系数与土壤有机质呈线性正相关(y=1.19x+5.88,R2=0.95),表明SOM是丁草胺吸附系数的重要影响因素,是土壤吸附丁草胺的主要吸附介质。沙化后,随着土壤有机质含量的减少,丁草胺分配系数逐渐减小。对于未沙化、轻度沙化、中度沙化土壤,Kom(1.3~1.4 L·g-1)基本未发生变化,而泥炭的Kom相对较小,再次证明了有机质是影响受试土壤对丁草胺吸附性能的重要因素[16,22,23]。
SOM是土壤吸附镉和丁草胺的主要介质,但其影响特征有所不同。土壤沙化后,随初始浓度的增加,受试土壤对镉的有机质标化吸附量(Qe,om)逐渐增大,而丁草胺的有机质标化吸附系数Kom(1.3~1.4 L·g-1)基本未发生变化。这与镉和丁草胺在土壤上吸附机理不同有关,丁草胺的吸附主要以分配作用为主,而镉吸附以表面吸附为主[15,24]。
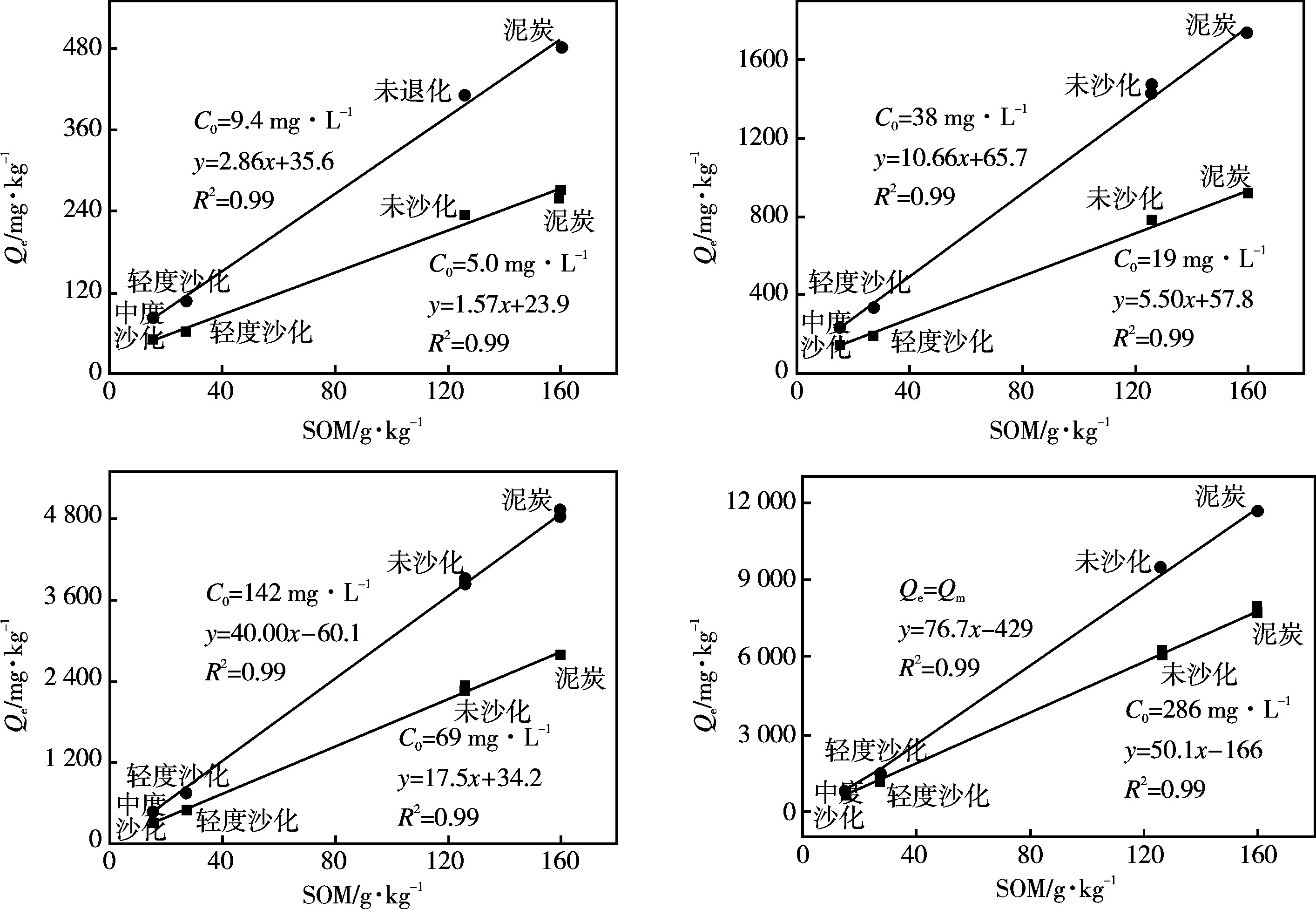
图3 供试土壤中有机质含量与镉吸附量的关系Fig.3 Relationship between SOM and sorption amount of cadmium onto four selected soils
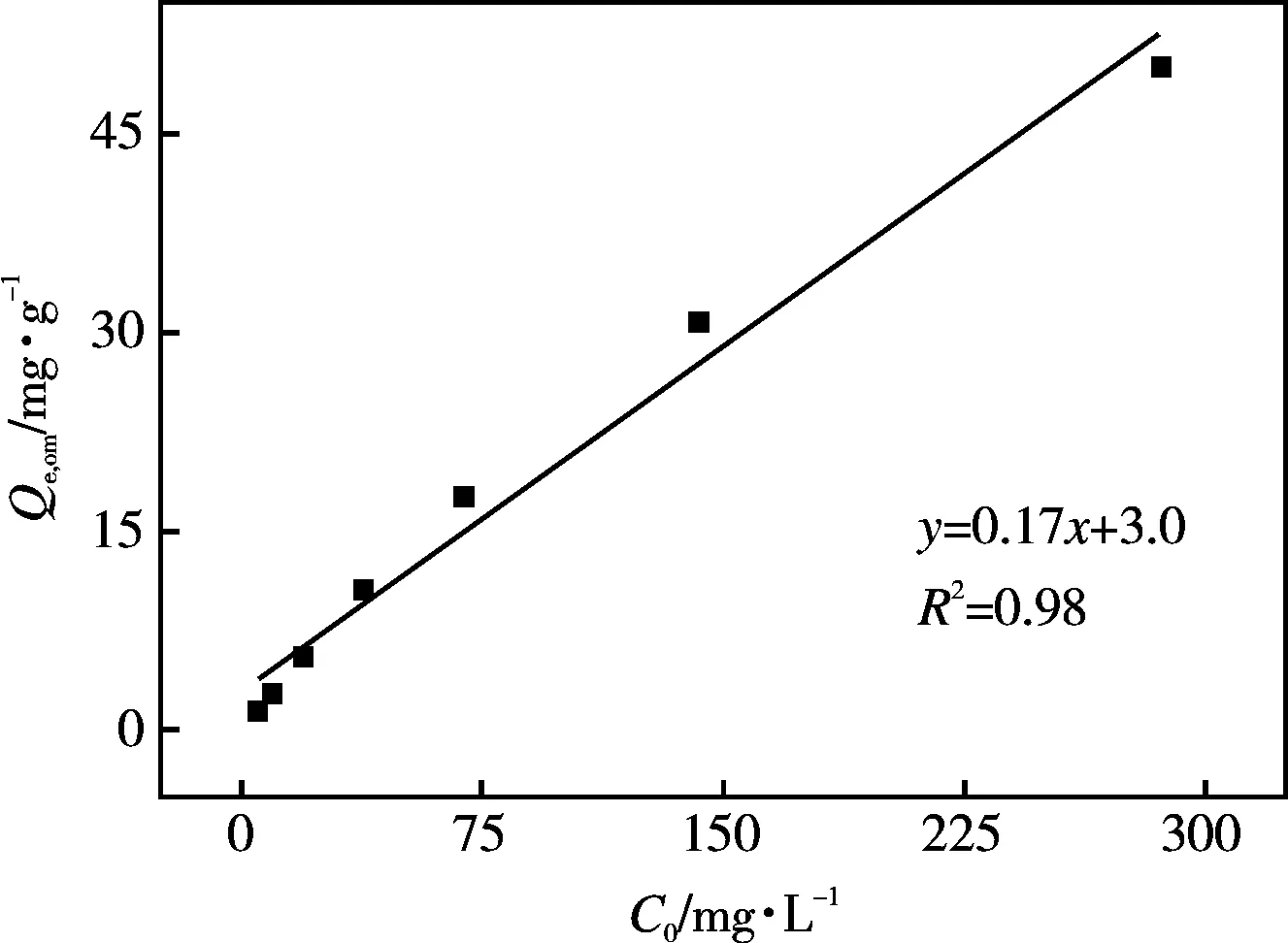
图4 镉的有机质标化吸附量与溶液初始浓度的关系Fig. 4 The relationship between Qe,om and the initial concentration of cadmium
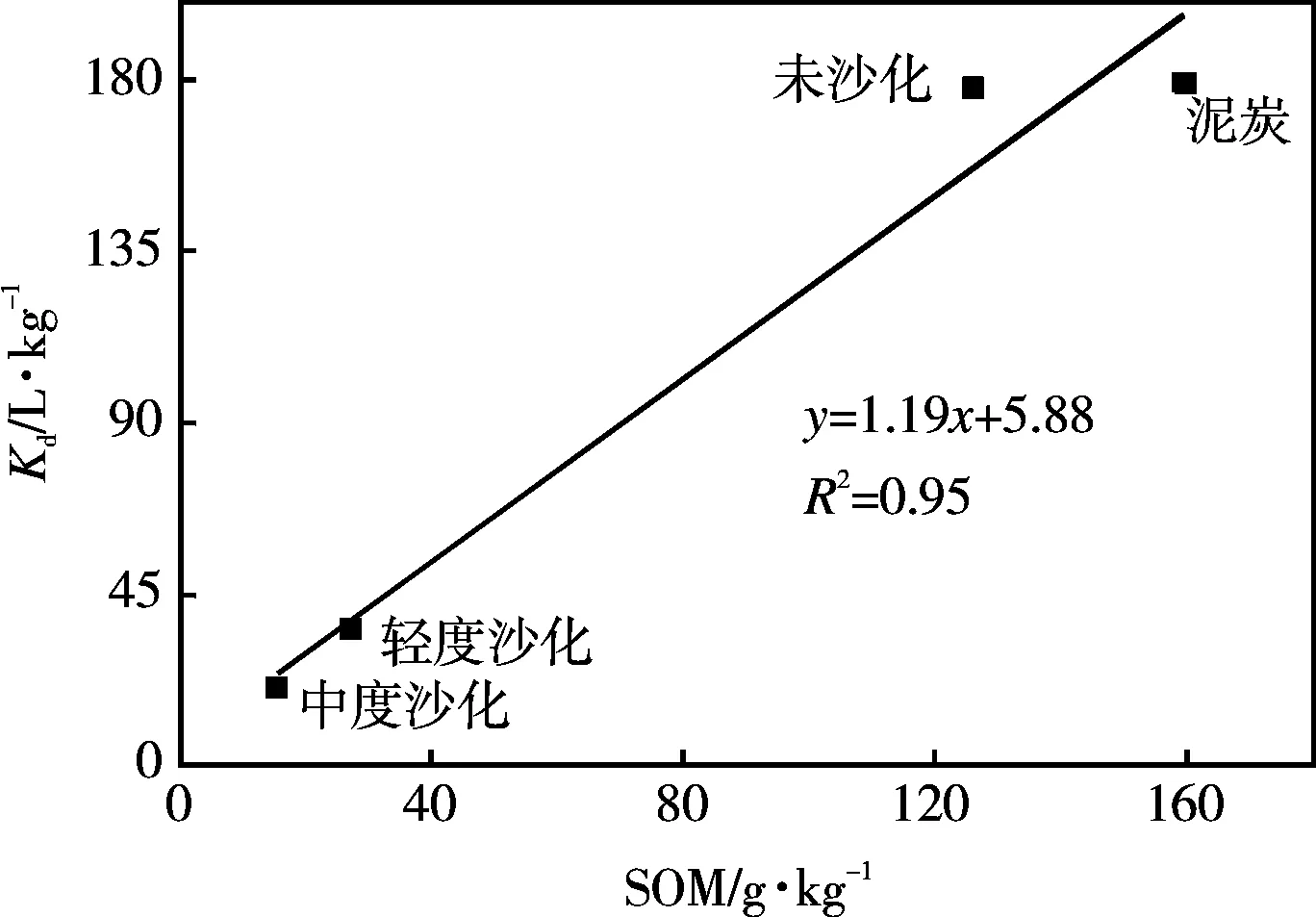
图5 土壤有机质对丁草胺吸附系数的影响Fig. 5 Effect of SOM on Kdof butachlor onto four selected soils
3 结论
(1)准一级动力学模型能更好地描述镉和丁草胺的动力学吸附行为(R2≥0.87)。沙化后,土壤对镉的吸附速率下降1.5%~18%(K1从27.0 min-1减至22.1 min-1);对丁草胺的吸附速率下降23%~43%(K1从0.13 min-1减至0.074 min-1),表明土壤的沙化作用能使丁草胺的吸附速率显著降低。
(2)土壤对镉的吸附具有明显的非线性,等温吸附曲线符合Langmuir模型(R2≥0.97),而丁草胺的吸附等温线具有良好地线性吸附特征(R2≥0.96, FreundlichN, 0.84~1.0)。沙化后,土壤对镉和丁草胺的吸附性能都显著下降。其中轻度和中度沙化土壤对镉的饱和吸附量(LangmuirQm)下降83.5%和91.8%(从9 467 mg·kg-1降至1 566,776 mg·kg-1);丁草胺的吸附系数Kd下降79.7%和88.4%(从178 L·kg-1降至36.2,20.7 L·kg-1)。
(3)SOM是镉和丁草胺吸附的主要介质,丁草胺的吸附以分配作用为主,而镉的吸附以表面吸附为主。SOM的含量与土壤吸附性能显著正相关,其影响程度与污染物类型及其初始浓度有关。随着初始浓度的增加,镉的有机质标化吸附量Qe,om逐渐增大,而丁草胺的有机质标化吸附系数Kom(1.3~1.4 L·g-1)基本不变。
