新生大鼠高胆红素血症脑组织Bcl-2表达及干预研究
2018-12-26,,,,,,,
,,, , ,, ,
高胆红素血症(hyperbilirubinemia)是新生儿期的一种常见疾病,对新生儿影响较大,严重者可因并发胆红素脑病(bilirubin encephalopathy)造成不可逆脑损伤,并遗留多种后遗症,甚至可造成新生儿死亡,给家庭和社会带来沉重负担[1]。因此,阐明新生儿高胆红素血症脑损伤发病机制,为临床诊治新生儿高胆红素血症提供理论依据具有重要意义。关于脑出血、缺血再灌注等颅脑损伤的研究表明,单唾液酸四己糖神经节苷脂(monosialotetrahexosylganglioside,GM1)对多种神经系统损伤具有脑保护作用[2]。但GM1是否对新生儿高胆红素血症脑损伤具有治疗作用,其具体机制目前仍不清楚。本研究目的是观察高胆红素血症时以及应用GM1干预后,新生大鼠脑组织细胞凋亡和Bcl-2表达的情况,以期为新生儿高胆红素血症的诊治提供理论依据。
1 材料与方法
1.1 实验材料
1.1.1 实验动物 选择健康的7日龄清洁级SD新生大鼠120只,雌雄不限,体重14 g~18 g,反应良好,购于山西医科大学生理实验室。
1.1.2 主要试剂 晶体胆红素、GM1、兔抗大鼠Bcl-2抗体、SABC免疫组化试剂盒、生物素化羊抗小鼠IgG抗体、DAB显色试剂、乙醚、二甲苯、苯胺蓝、10%多聚甲醛,以上试剂购自博士德生物技术公司太原分公司。
1.2 实验方法
1.2.1 实验动物分组 将120只健康SD大鼠随机分为对照组、模型组、干预组3组,各40只。各组根据造模后动物处死时间不同随机分为6 h组、12 h组、24 h组、48 h组、72 h组5个亚组,每组8只。
1.2.2 注射用胆红素溶液的配制 参考陈舜年等[3]提供的方法配制胆红素溶液,晶体胆红素20.0 mg,避光称取,溶于1 mL氢氧化钠溶液(0.5 mol/L)中,加入双蒸水9 mL,用氯化氢溶液(0.5 mol/L)将pH调节至8.5。
1.2.3 模型制作及干预方法 新生大鼠高胆红素血症模型的制作参照文献[4]方法制备,模型组大鼠腹腔注射胆红素溶液(100 μg/g),对照组大鼠腹腔注射生理盐水(100 μg/g),注射完毕后回到原来的饲养环境中,继续由母鼠喂养。GM1制剂用2 mL注射用水溶解。干预组在模型建立后即刻给予腹腔注射GM1,剂量为10 mg/(kg·d),给药时间为每日1次,注射3 d,然后回到原来的饲养环境中,继续由母鼠喂养。
1.2.4 大鼠脑组织的提取及标本制备 根据实验方案,在各个规定时间点将大鼠用乙醚吸入麻醉,之后将麻醉的大鼠固定在手术板上,打开胸腔,充分暴露心脏,用改造过的20 mL注射器(在注射器针头处连接穿刺针)由左心室小心插入心腔,剪断颈外静脉,同时将灭菌生理盐水注入左心室,当有清亮液体从颈外静脉流出时,停止灌流灭菌生理盐水。随后再灌流20 mL~30 mL10%多聚甲醛。停止灌流后,打开颅骨取出脑组织,用生理盐水清洗脑组织表面并用滤纸吸干,从视交叉及其后5 mm处将一侧脑组织做冠切(海马区),切取组织块的大小约0.5 cm×0.5 cm×0.5 cm,随后将其置于10%多聚甲醛中固定,然后标本经常规乙醇梯度脱水、二甲苯透明后用石蜡包埋。最后将标本在超薄轮转切片机上进行连续冠状切片,厚度约为4 μm,最后于载玻片上70 ℃烘片2 h~4 h。
1.2.5 大鼠脑组织染色 常规石蜡包埋与切片、烘片、常规脱蜡及水化、苏木素伊红(HE)染色、封片,在光镜下观察各组大鼠脑组织的病理学形态改变。
1.2.6 大鼠脑组织Bcl-2测定 免疫组织化学法(immunohistochemistry)检测Bcl-2,按试剂盒提供的步骤进行操作。光学显微镜下观察阳性细胞表达。
1.2.7 脑细胞凋亡检测 用Tunel法定量检测凋亡细胞,按试剂盒提供的步骤进行操作。光镜下观察凋亡细胞即阳性细胞,表现为细胞核呈棕黄色染色,高倍镜下(400×)每张切片随机选取5个非重叠视野,计数每个视野的阳性细胞和细胞总数,计算阳性细胞所占百分比即凋亡指数(AI)。AI=阳性细胞数/细胞总数×100%。
1.3 图像分析 采用BI-2000医学图像分析系统(成都泰盟科技有限公司)进行图像采集与分析,在相同光亮强度和放大倍数(10×40)条件下统计阳性细胞平均灰度值,平均灰度值越高,阳性表达越弱,而平均灰度值越低,阳性表达越高,每只大鼠取3张片,每张片取4个视野进行计算。
2 结 果
2.1 动物模型行为观察 试验前所有新生大鼠无明显异常表现。造模后6 h~24 h所有新生大鼠全部存活。模型组和干预组新生大鼠开始出现活动减少、反应迟钝、翻滚等表现,少数发生震颤、抽搐,其间无大鼠死亡;造模后48 h~72 h模型组新生大鼠活动减少,反应迟钝、翻滚震颤、抽搐等行为更明显;干预组大鼠活动减少,反应迟钝、翻滚等异常行为较模型组明显减少,未见抽搐发生。
2.2 脑组织病理改变 模型组大鼠脑组织轻度水肿出现于6 h,明显水肿及程度不同的萎缩出现于24 h,72 h可见液化坏死。干预组大鼠各时间点脑组织损伤程度与模型组比较明显减轻,72 h未见明显萎缩、液化及坏死。对照组大鼠各时间点脑组织未见明显异常。模型组与干预组大鼠脑组织出现程度不同的神经细胞水肿、变性、坏死、胶质细胞增生,病灶中心出现核的固缩和碎裂;干预组较模型组程度明显减轻,对照组各时间点脑组织未见明显异常。
2.3 Bcl-2的表达情况 造模后6 h模型组与干预组Bcl-2表达开始增多,24 h表达明显增加,48 h达到高峰,之后 Bcl-2表达逐渐下降,于造模后72 h时仍明显高于对照组;与模型组相比,干预组各时间点Bcl-2 表达均增加,差异有统计学意义(P<0.05);与对照组相比,模型组与干预组各时间点Bcl-2表达均显著增多,差异均有统计学意义(P<0.05);对照组各时间点脑组织未见或仅有少量Bcl-2表达。详见表1、图1。

表1 3组不同时间脑组织Bcl-2表达的变化(阳性细胞平均灰度值,±s)
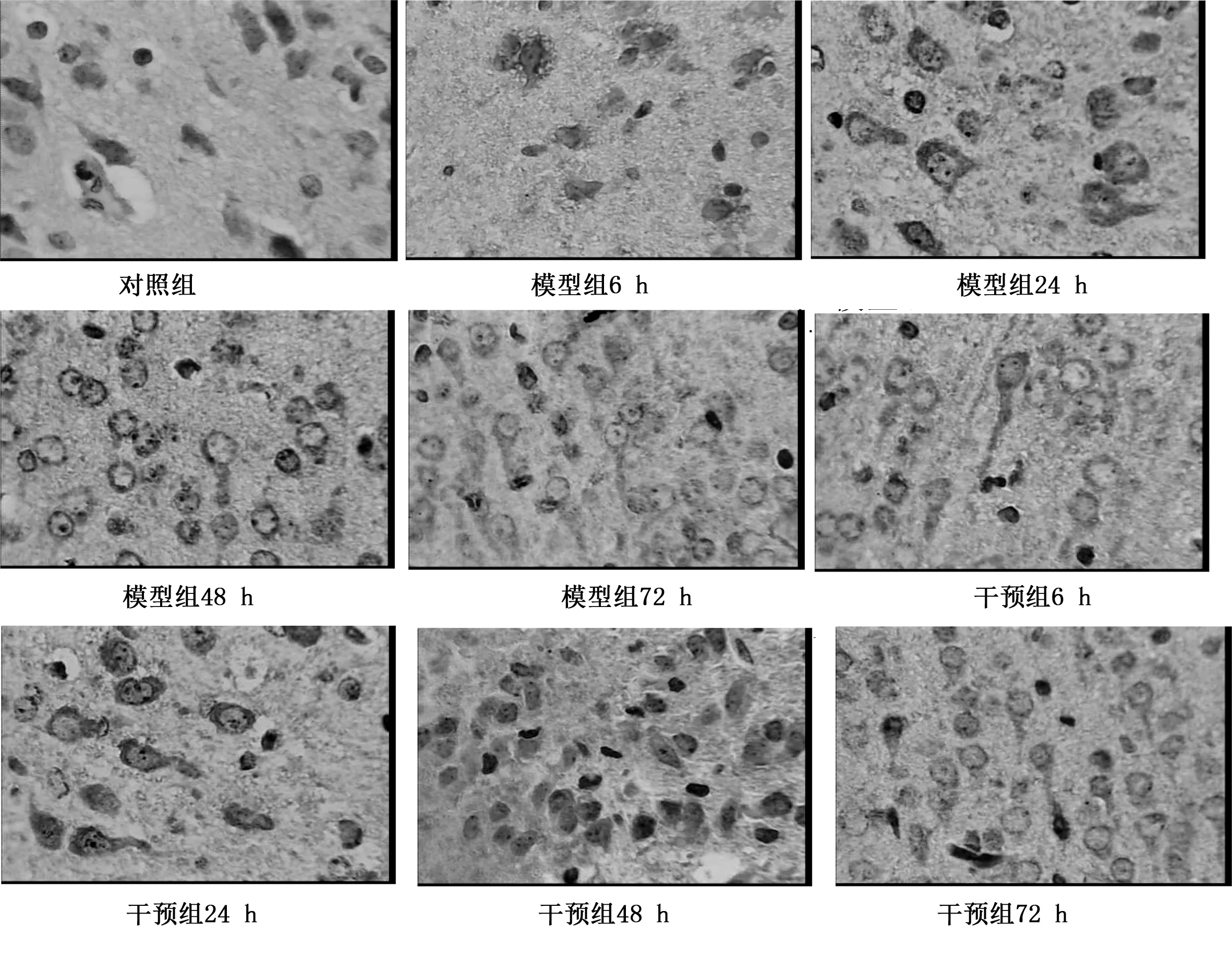
图1 免疫组化检测Bcl-2表达(400×)
2.4 神经细胞凋亡情况 模型组与干预组大鼠于造模后6 h,脑组织出现凋亡细胞,随后凋亡细胞逐渐增多,造模后24 h~48 h其表达进一步增多,造模后72 h达到高峰。与模型组比较,干预组各时间点脑组织的凋亡细胞明显减少,差异均有统计学意义(P<0.05)。对照组各时间点脑组织未见或仅有少量凋亡细胞。详见表2、图2。

表2 3组不同时间神经细胞凋亡指数(±s)

图2 Tunel法定量检测凋亡细胞(400×)
3 讨 论
高胆红素血症是新生儿期临床常见疾病,赵捷等[5]报道其发病率为37.6%。Slusher等[6]研究发现,在足月及接近足月的新生儿中,高胆红素血症的发病率约为25/10万。高胆红素血症对新生儿影响较大,严重者可因并发胆红素脑病造成不可逆脑损伤,并遗留多种神经系统后遗症,甚至可造成新生儿死亡,给社会和家庭带来沉重负担。因此,阐明新生儿高胆红素血症脑损伤发病机制,为临床诊治新生儿高胆红素血症提供理论依据具有重要意义。
近年来,国内外针对新生儿高胆红素血症做了较多研究,但引起脑损伤的确切机制仍不清楚,有研究发现,高胆红素血症时,新生儿体内过量的游离胆红素可通过开放的血-脑脊液屏障进入并沉积于脑组织,从而引起脑细胞能量代谢障碍,产生活性异常的Na+-K+-ATP酶,兴奋性氨基酸持续增多,细胞内严重Ca2+超载[7]。进一步导致线粒体的结构及神经细胞膜的功能被损坏,最终导致脑损伤的发生。
细胞凋亡(apoptosis)又称为“程序性细胞死亡”(programmed cell death),是细胞一种生理性、主动性的“自觉自杀行为”,是机体在生长、发育和受到外来刺激时清除多余、衰老和受损伤的细胞以保持机体内环境平衡和维持正常生理活动过程的一种自我调节机制,但凋亡同样也可以在病理情况下发生。有研究认为,新生儿高胆红素血症与脑细胞凋亡密切相关[8]。Pazar等[9]研究发现新生儿高胆红素血症时脑细胞凋亡明显增多。但是新生儿高胆红素血症脑损伤时是否有脑细胞凋亡参与,其具体机制目前仍没有定论。目前认为细胞凋亡的启动存在两条通路:内源性凋亡通路(以线粒体介导)和外源性凋亡通路(死亡受体介导)。在线粒体介导的内源性凋亡通路中,线粒体功能异常导致细胞色素C(CytC)释放,进而激活Caspase激酶系统,最终导致细胞凋亡的发生。Bcl-2蛋白是内源性凋亡通路中的一种重要蛋白,是抑制细胞凋亡的代表。一般认为, Bcl-2仅在肯定能存活的神经元上表达增高,主要分布在线粒体外膜表面,通过保护其完整性,阻断Bax蛋白活性,阻止活化因子如CytC的释放,从而切断凋亡信号的传播,进而减轻细胞损伤[10]。
神经节苷脂是一类含有唾液酸的膜糖脂的总称,由E·Klenk于1935年首先发现,在脑灰白质中含量很多,并将这类糖脂命名为神经节苷脂。目前已知糖部分是由己糖、氨基糖、唾液酸组成的脑神经节苷脂有8种以上,近年来研究较多的是GM1[11]。既往研究表明,GM1可通过多种机制来对抗各种原因所致的脑组织损伤[12-14]:对抗兴奋性氨基酸的神经毒性作用。GM1有别于竞争性或非竞争性NMDA受体拮抗剂,只选择性地阻滞NMDA受体的病理性兴奋,而不影响该受体对兴奋性氨基酸正常生理反应的信号传递;②防止细胞内Ca2+积聚,减轻脑水肿;③维持神经细胞膜Na+-K+-ATP酶的活性,减少神经细胞膜脂肪酸丢失,防止ATP动力学特性改变;④增加缺血脑组织超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶和过氧化氢酶活性,提高缺氧缺血脑组织对氧自由基的清除能力;⑤通过抑制脑细胞的自噬作用,减轻脑损伤。GM1易于通过血脑屏障,在细胞分化和发育、神经元修复和再生等方面起重要作用。目前GM1临床上已经广泛应用于多种神经系统损伤的治疗。但GM1是否对新生儿高胆红素血症脑损伤具有治疗作用,其具体机制目前仍不十分清楚。
本实验结果显示,模型组与干预组均于造模后6 h Bcl-2表达开始增多,48 h达到高峰,于造模后72 h时仍明显高于对照组;与模型组比较,干预组各时间点Bcl-2表达均增加;与对照组比较,模型组与干预组各时间点Bcl-2表达均显著增多;对照组各时间点脑组织未表达或仅有少量Bcl-2表达。实验结果显示,模型组与干预组大鼠于造模后6 h脑组织出现凋亡细胞,随后凋亡细胞逐渐增多,于造模后72 h达到高峰;对照组各个时间点未见明显凋亡细胞。且大体标本及HE染色均显示,干预组较模型组脑损伤明显减轻。针对实验结果分析认为,脑细胞凋亡参与了高胆红素血症脑损伤的进程,且高胆红素血症时Bcl-2在一定程度上影响了脑细胞凋亡的发生。提示GM1在高胆红素血症脑损伤时发挥了脑保护作用,其可能机制为通过促进抑凋亡蛋白Bcl-2的表达,进而减少脑细胞凋亡,从而发挥其脑保护作用。
综上所述,脑细胞凋亡参与了高胆红素血症脑损伤的进程,其机制与抑凋亡蛋白Bcl-2有关;高胆红素血症时GM1有脑保护作用,其机制可能为通过促进抑凋亡蛋白Bcl-2的表达,进而减少脑细胞凋亡,最终减轻脑损伤。
