sFRP4基因在肉鸡胫骨软骨发育不良中的表达及生物信息学分析
2018-12-24王春霞卢晓晓宁官保马海利高文伟高诗敏李建慧李桂兰赵宇军田文霞
王春霞,喻 进,卢晓晓,宁官保,张 鼎,马海利,高文伟,高诗敏,李建慧,李桂兰,闫 芳,赵宇军*,田文霞*
(1.山西农业大学动物科技学院,山西太谷 030801)
胫骨软骨发育不良(Tibial dyschondroplasia,TD)是家禽胫跗骨近端生长板形成不能矿化及血管化的软骨栓,从而导致站立困难及运动障碍的群发性疾病[1-2]。该病导致肉鸡抗病性能下降和生产性能降低,从而给养禽业造成巨大损失,因此对其发病机理的研究成为当前研究热点之一。为了探究TD的发病机制,田文霞等[3-5]通过使用福美双诱发TD,发病率高,稳定性好,病理变化与正常发病一致,由此成功构建肉鸡TD模型,为深入研究TD发病机理提供可靠、充足的试验基础。基于福美双诱发的TD模型,Tian等[6]应用抑制性消减杂交技术(SSH)结合cDNA芯片筛选差异表达基因发现,在TD发生过程中,sFRP4基因表达上调,同时,Tian等[7]后续通过Affymetrix芯片筛选不同发育阶段差异表达基因发现,sFRP4基因也表达上调,并在诱导TD后第1、2、6天分别上调高达2.8、73.5、11.6倍,这正好验证了前期应用SSH筛选中的基因差异表达结果。
作为sFRP家族蛋白成员之一,分泌型卷曲相关蛋白4(secreted frizzled-related protein 4,sFRP4)是Wnt信号通路的拮抗剂。Wnt信号通路控制着如细胞凋亡、细胞增殖以及干细胞和祖细胞的自我更新等多种过程[8]。除此之外,Wnt信号通路与软骨内骨化的发生有着密切的关系[9]。Tamamura等[10]研究认为Wnt/β-Catenin信号通路对生长板形成、调节软骨细胞成熟以及软骨内骨化都有着至关重要的作用。Kerkhofs等[11]和Andrade等[12]同样证明Wnt信号通路参与调控软骨内骨化。体外研究表明Wnt信号通路与软骨细胞的成熟高度相关,而且活化的β-Catenin与TCF/LEF转录因子可加快软骨细胞分化[13],并促进软骨内骨化[14]。体内研究也表明激活的Wnt信号通路可促进软骨细胞肥大及成熟[15]。sFRP家族蛋白通过与Frizzled(Fz)蛋白竞争性结合Wnt蛋白,发挥抑制Wnt信号通路的生物学作用,同时间接影响与Wnt通路相交联的其他信号通路。Wang等[16]研究证实sFRP1能通过Wnt信号通路调节由糖皮质激素诱导的骨质疏松,可见sFRP家族蛋白对Wnt信号通路有一定的影响。因而研究和分析sFRP4基因及其蛋白的特性与信息,对后续研究Wnt信号通路与TD发病机理之间的关系有着重大意义。
本研究通过real-time PCR对基因芯片筛选的sFRP4基因差异表达结果进行验证,并对sFRP4基因及其预测蛋白进行相关生物信息学分析,为后续的进一步研究提供参考和依据。
1 材料与方法
1.1 材料
1.1.1 组织样品 肉鸡(艾维茵)胫骨软骨生长板组织(福美双诱导TD后第1、2、6天),样品获得见文献[17],由山西农业大学国家动物医学示范中心生物制品实验室提供。
1.1.2 主要试剂 Trizol Reagent,Invitrogen公司产品;SYBR®Green Realtime PCR Master Mix,Toyobo公司产品,TaqDNA聚合酶、dNTP、DNase-I,武汉晶美生物工程有限公司产品。
1.2 方法
1.2.1 引物的设计与合成 所用引物根据NCBI数据库中Gallus的sFRP4基因的序列作模板,用Primer Premier 5.0软件进行引物设计。序列为上游引物5′GCTGAATCTATCTGCTGTTGGG3′,下游引物5′CTAACACTGTAAGCATATTCCTGGC3′,扩增片段136bp;内参基因RPS16引物序列的上游引物5′ACAAACTGCTTGAACCTGTCCTC3′,下游引物5′GCTTTGGAAATAGCTTGACGG3′,扩增片段127bp。引物由上海捷瑞生物工程有限公司合成。
1.2.2 生长板总RNA的提取与质量检测 取本实验室保存的生长板样品,按照Trizol试剂盒操作步骤提取总RNA,并通过琼脂糖凝胶电泳和核酸测定仪检测总RNA质量和浓度,置-70℃保存备用。
1.2.3 Real-time PCR验证差异表达基因 用上述合成的引物进行real-time PCR的扩增体系(总体积25 μL):cDNA 1 μL,SYBR®Green Realtime PCR Master Mix 12.5 μL,上、下游引物各0.5 μmol/L,灭菌水补足体系。反应条件为:95℃ 3 min;94℃ 20 s,60℃ 30 s,72℃ 20 s,40个循环。
1.2.4 Real-time PCR数据分析 以各对照组为参照,使用2-△△Ct法计算sFRP4在各组中的相对表达量,取攻毒组与对照组的差异倍数均值。
1.2.5 鸡生长板sFRP4基因的生物信息学分析 通过NCBI中Gene数据库获得sFRP4基因定位及组成等信息,同时采用在线ORF Finder(http://www.ncbi.nlm.nih.gov/)分析该基因。经ProtParam程序(http://web.expasy.org/protparam/)分析蛋白理化性质,经ProScale程序(http://web.expasy.org/protscale/)分析蛋白疏水性,经DictyOGlyc 1.1(http://www.cbs.dtu.dk/services/DictyOGlyc/)进行蛋白糖基化位点分析,经NetPhos 2.0 Server(http://www.cbs.dtu.dk/services/NetPhos/)进行磷酸化位点分析,经Signal-4.1(http://www.cbs.dtu.dk/services/SignalP/)进行信号肽预测,经TMHMM Server 2.0(http://www.cbs.dtu.dk/services/TMHMM/)分析蛋白的跨膜区,经PROSITE程序(http://prosite.expasy.org/)分析蛋白结构域,同时应用PredictProtein(http://www.predictprotein.org/)与SOPMA(http://npsa-pbil.ibcp.fr)对蛋白二级结构进行预测。运行SWISS-model(http://swissmodel.expasy.org/interactive)预测蛋白三级结构,最后通过STRING(http://string-db.org/),限定相关蛋白数,自动构建与sFRP4蛋白相互作用的蛋白网络。
2 结果
2.1 Real-time PCR验证sFRP4的差异表达
用real-time PCR技术对芯片结果中的表达差异基因sFRP4进行检测,real-time PCR获得的基因差异表达结果与基因芯片中结果基本一致,在第1、2、6天均为上调表达,将两者表达信息对比(图1)。

图1 实时定量PCR与微阵列结果的比较
2.2 鸡sFRP4基因结构信息
sFRP4基因位于2号染色体46 736 104~46 746 404之间,基因全长10 300 bp,外显子有6个,mRNA全长2 847 bp,通过ORF Finder分析得到一个993 bp的开放阅读框,推测编码331个氨基酸。
2.3 鸡sFRP4蛋白基本理化性质
理论分子质量为37 704.7 u,理论等电点为9.50,负电荷氨基酸残基(天冬氨酸+谷氨酸)30个,正电荷氨基酸残基(精氨酸+赖氨酸)53个,原子组成为C1638H2663N489O477S27,原子总数为5 294。N端第1个氨基酸是蛋氨酸,蛋白不稳定系数为63.13(大于40认为该蛋白质不稳定),脂肪系数为73.63,平均亲水性为-0.582。含强酸性氨基酸(D、E)31个,占总氨基酸9.3%,强碱性氨基酸(K、R)54个,占16.2%,极性氨基酸(N、C、Q、S、T、Y)103个,占30.9%,疏水氨基酸(A、I、L、F、W、V)71个,占21.3%(图2)。

图2 各氨基酸组成百分比
2.4 鸡sFRP4蛋白疏水性分析
经分析,sFRP4的最大疏水指数为2.5,最小疏水指数为-2.95。根据指数越小,亲水性越强的规律来看,从图中可以看出亲水性氨基酸均匀分布于整条多肽链,且多于疏水性氨基酸,推测该蛋白为可溶性蛋白(图3)。

图3 sFRP4蛋白质疏水性分析
2.5 鸡sFRP4蛋白糖基化位点分析
糖基化是蛋白质翻译后修饰的方式之一,经过分析预测,O-糖基化位点只有1个(图4)。
2.6 鸡sFRP4蛋白磷酸化位点分析
蛋白质磷酸化主要发生在苏氨酸(Thr)、丝氨酸(Ser)与酪氨酸(Tyr)3种主要磷酸化部位。经分析,该蛋白磷酸化位点共13个,其中Ser11,Thr1,Tyr1(图5)。
2.7 信号肽分析
信号肽一般位于分泌蛋白的N端,当蛋白发生跨膜转移后被切掉。运行Signal P 4.1分析预测,会出现4个分值:Y-score maximum指预测的真实的信号肽切割位点得分;C-score maximum指可能的信号肽切割位点得分;S-score maximum指信号肽组成的可能的大小得分;S-score mean指S-score的平均得分。一般认为S-score mean>0.5,则预测为分泌性蛋白,存在信号肽。经过分析,C值0.728,Y值0.729,S值0.864,S平均值0.729,大于0.5,剪切位点位于20与21残基之间,推测sFRP4蛋白有信号肽(图6)。

图4 sFRP4蛋白的糖基化位点分析

图5 sFRP4蛋白磷酸化位点分析

图6 sFRP4蛋白信号肽的预测
2.8 跨膜区分析
TMHMM Server 2.0程序采用隐马氏模型,分析综合了电荷偏离、膜蛋白拓扑学限制和螺旋长度、跨膜区疏水性等特征,并结合统计学方法对膜内外及跨膜区进行整体预测。预测显示sFRP4蛋白无跨膜区,整个蛋白都位于膜外(图7)。
2.9 二级结构预测
经SPOMAN分析显示,α螺旋占27.19%,延伸链占13.60%,无规则卷曲占58.01%,β转角占1.21%。推测α螺旋与无规则卷曲是sFRP4蛋白主要的二级结构原件,延伸链与β转角则散在于整个蛋白(图8)。

图7 sFRP4蛋白跨膜区的预测
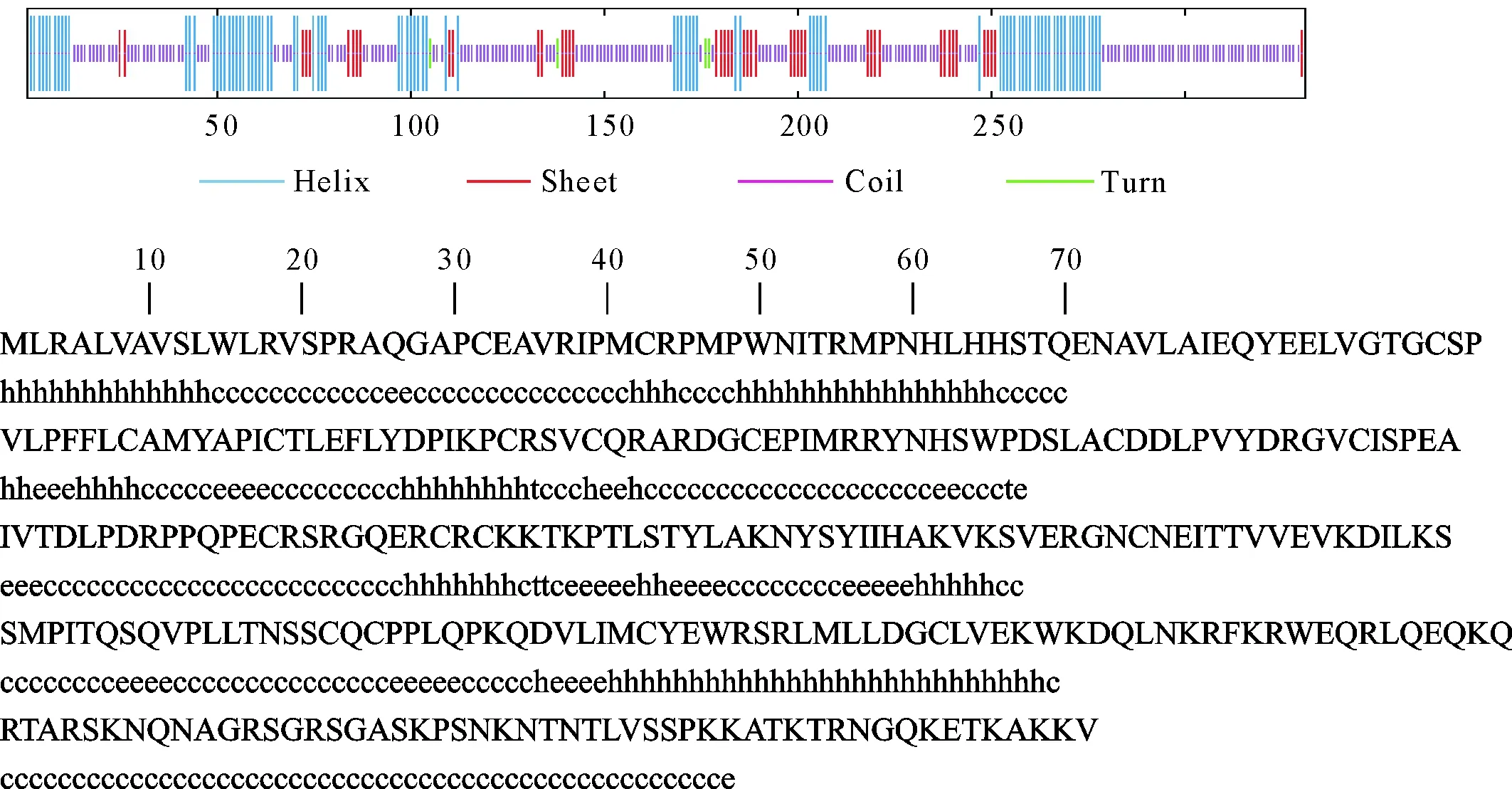
h.α螺旋;c.无规则卷曲;t.β转角;e.β折叠延伸链h.Alpha helix; c.Random coil; t.Beta turn; e.Beta sheet extended strand
2.10 三级结构预测
运行SWISS-model程序,以sFRP3蛋白为模板同源建模,可见α螺旋与无规则卷曲为sFRP4蛋白三级结构主要原件(图9)。

图9 sFRP4蛋白三级结构的预测
2.11 sFRP4蛋白结构域分析
经ScanPtosite程序分析,蛋白质有FZ和NTR两个保守结构域(访问号分别为PS50038,PS50189)(图10)。

图10 sFRP4蛋白质结构域分析
Fz结构域由120个氨基酸组成,由于包含了10个非常保守的半胱氨酸,也叫做CRD(cysteines-rich domine)。Fz结构域的晶体结构显示主要为α螺旋,此外还有β折叠,保守的半胱氨酸形成二硫键。Fz结构域是与Wnt相互作用的部位,对于Wnt配体的结合是必要的。NTR结构域由130个氨基酸组成,共包含6个保守的半胱氨酸,可能在内部形成二硫键。通过该程序对sFRP家族蛋白(sFRP1、sFRP2、sFRP3、sFRP5)进行分析,显示均含有Fz与NTR结构域。
2.12 蛋白相互作用网络
经STRING分析,默认搜索与sFRP4蛋白相关的蛋白限制在10个之内,构建蛋白之间的相互作用网络。分析显示sFRP4蛋白与Fz蛋白竞争性结合Wnt蛋白,结果见图11。
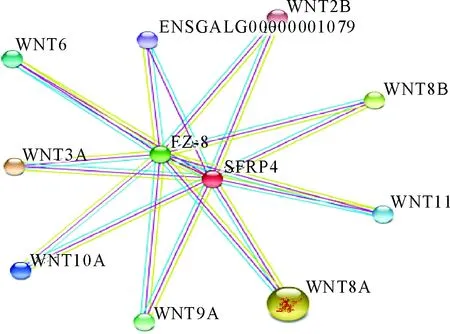
图11 sFRP4蛋白与其相关蛋白相互作用网络
3 讨论
Wnt信号通路在各组织的发育与内稳态中起着至关重要的作用,已经证实软骨形成和软骨内骨化与此通路有很大关系[18]。本课题组应用基因芯片筛选TD发育不同时期差异表达基因发现,sFRP4基因差异表达显著,而sFRP4是Wnt信号通路的拮抗剂,这表明sFRP4可能通过Wnt信号通路从而影响TD的发生与发展。但是,sFRP4通过Wnt信号通路是否是主要影响TD的原因,或者是通过与之交联的其他信号通路发挥作用,这些都还不得而知,并且国内外关于sFRP4的研究鲜见于报告,因而在深入分子水平具体研究之前,sFRP4基因及其蛋白的生物信息学分析是很有必要的。
本研究应用real-time-PCR技术对基因芯片筛选的结果进行验证,结果表明两者变化趋势一致,结论相互印证,说明了基因芯片的可靠性,同时也表明了sFRP4基因差异表达的保真性,为后续研究提供了可靠的数据和理论支撑。sFRP4基因的生物信息学分析显示,其编码331个氨基酸,蛋白平均亲水性-0.582,整条多肽链中亲水性氨基酸多于疏水性氨基酸,表现为亲水性,推测为可溶性蛋白质;通过二级结构、同源建模分析,二级结构主要以α螺旋与无规则卷曲为主。这些都为后续研究如蛋白表达、提纯,以及功能的研究提供有价值的参考。
糖基化是蛋白翻译后的修饰方式之一,总共有四类,其中O-糖基化在高尔基体中进行,以丝氨酸、苏氨酸、羟赖氨酸和羟脯氨酸的羟基为连接点。糖基化的结果使不同的蛋白质带上不同的标记,改变多肽的构象与增加蛋白质的稳定性。分析预测整条多肽链中只有一个糖基化位点,sFRP4蛋白不稳定,可能极少的糖基化位点是该蛋白不稳定的原因之一;同时磷酸化也是蛋白质翻译后的修饰方式,整条多肽链共有13个磷酸化位点,其中大部分位于sFRP4蛋白的两个保守结构域(CRD、NTR)内。研究表明,CRD是Fz蛋白的保守结构域, Wnt蛋白通过CRD结构域与Fz蛋白结合,从而启动Wnt信号通路[19]。sFRP4蛋白具有信号肽,无跨膜区,提示其可能在胞内进行磷酸化等翻译后修饰,随后分泌出胞外,发挥竞争性结合Wnt蛋白的作用,而存在磷酸化位点的CRD保守结构域则是其发挥功能的重要原因。
不同的研究表明,Wnt信号通路对于软骨细胞成熟、肥大,以及骨的形成是不可或缺的[20]。Enomoto等[21]研究表明在鸡发育过程中,Wnt8A过表达可促进软骨细胞成熟、肥大、钙化,同样Wnt9A过表达也会加快软骨细胞的肥大[22]。通过STRING分析蛋白的相互作用网络显示,sFRP4蛋白与Fz蛋白可竞争性结合Wnt3A、Wnt8A、Wnt9A、Wnt10A等蛋白,提示其可能通过竞争性结合Wnt8A等蛋白,从而抑制Wnt信号通路,进而影响正常软骨内骨化。
本研究验证了前期用芯片技术筛选的差异表达基因sFRP4的准确性与可靠性,并对sFRP4基因及其预测蛋白进行了生物信息学分析,为今后研究sFRP4蛋白生物学功能及其参与Wnt信号通路对TD的影响奠定一定的理论基础。
