淡水养殖鱼大肠埃希菌分离鉴定与耐药性研究
2018-12-24邢新月王诗雨祝令伟郭学军孙诗雯
纪 雪,邢新月,梁 冰,王诗雨,祝令伟,刘 军,郭学军,孙诗雯,孙 洋
(军事医学研究院军事兽医研究所/吉林省人兽共患病预防与控制重点实验室,吉林长春 130122)
随着我国水产养殖业的快速发展,形成了多品种、集约式的高压力养殖模式。这种模式在很大程度上导致了鱼类疾病的增加,其中细菌感染性疾病最为多见[1]。为了防控细菌感染,抗菌药物被大量应用于淡水养殖业,随之而来的就是细菌耐药性的日益严重。一方面导致细菌病防控难度的增加,同时也对环境和人类健康带来潜在的危害[2-4]。淡水鱼肠道中携带的主要菌群为哈夫尼亚菌属、气单胞菌属、柠檬酸菌属、芽胞杆菌属和链球菌属等菌群[5],埃希菌菌属相对不占优势,但在鱼生病后,大肠埃希菌作为条件致病菌可严重危害病鱼。国内外对大肠埃希菌的研究多见于人及禽畜等养殖动物等,对淡水鱼类携带大肠埃希菌的研究较少。
大肠埃希菌为革兰阴性杆菌,多为温血动物肠道正常菌群的组成部分,但其容易获得外源毒力因子及耐药相关遗传元件而衍化为病原菌并变得难以治疗[6]。当环境质量下降、寄居部位改变、机体免疫机能下降或菌群失调,都可能会引起大肠埃希菌的感染发病。本研究对长春地区淡水养殖鱼类携带大肠埃希菌的耐药及毒力开展研究,为淡水鱼的临床用药提供科学依据,同时也为淡水鱼携带的致病性大肠埃希菌及其耐药性产生的公共卫生风险评估提供数据支持。
1 材料与方法
1.1 材料
1.1.1 样品来源 自2014年10月至2016年1月,采集自长春市周边养鱼场及水产市场淡水鱼共计322条。其中健康鱼样品 243条,病鱼样品79条。
1.1.2 菌株和培养基 大肠埃希菌CVCC208、CVCC215、CVCC216、CVCC239,购自中国兽药监察所菌种保藏中心;大肠埃希菌EHECO157:H7和大肠埃希菌ATCC25922,军事兽医研究所细菌学研究室保存;LB肉汤培养基、LB琼脂培养基、脑心肉汤培养基和麦康凯琼脂培养基,青岛海博公司产品;CHROMagar尿道定位显色培养基,法国科玛嘉公司产品;MH琼脂,法国梅里埃公司产品;MH液体培养基,索来宝生物科技有限公司产品。
1.1.3 仪器和试剂 EDC-810型PCR扩增仪,北京东胜创新生物科技有限公司产品;BD PhoenixTM-100 System细菌鉴定系统,美国BD公司产品;2×TaqMasterMix试剂包、细菌基因组提取试剂盒,康为世纪公司产品;DNA分子量标准DL 2 000,宝生物工程(大连)有限公司产品;致泻性大肠埃希菌O抗原诊断血清,天津生物芯片有限公司产品;引物由吉林省库美生物科技有限公司合成。
1.2 方法
1.2.1 细菌分离和鉴定 无菌操作取鱼肠道内容物于4 mL离心管内,加入2 mL生理盐水,充分振荡混匀。上清在尿道定位显色培养基平板划线,36℃±1℃培养16 h~18 h,挑取典型单菌落在麦康凯琼脂培养基上进行纯化,纯化后单菌落保菌,并用Phoenix100全自动微生物鉴定系统进行生化鉴定。每份样品保留1株。
1.2.2 大肠埃希菌特异性PCR鉴定 根据文献[7],用大肠埃希菌16S rDNA 特异性引物,对分离株进行PCR鉴定,引物序列F:5′-TGTGGGAACGGCGAGTCGGAATAC-3′;R:5′-GGGCGCAGGGGATGAAACTCAAC-3′。PCR反应体系(25 μL):2×PCR Master Mix酶12.5 μL,上、下游引物各0.5 μL,DNA模板1 μL,ddH2O 10.5 μL。PCR反应条件:95℃10 min;94℃ 40 s,60℃ 40 s, 72℃ 1 min,共30个循环;72℃ 7 min。
1.2.3 生化和药敏试验 用Phoenix100全自动微生物鉴定系统对分离的大肠埃希菌进行生化鉴定和耐药谱检测。
1.2.4 耐药基因检测 参照文献[8],并根据国内流行的四环素耐药基因类型,用PCR对36株分离株进行6种四环素耐药基因的检测。PCR反应条件:94℃预变性3 min;94℃ 1min,57℃ 1 min,72℃ 1 min,共30个循环;72℃延伸10 min。PCR产物用10 g/L琼脂糖凝胶电泳检测。同时依据文献[9],对13株ESBLs表型大肠埃希菌进行blaCTX-M、blaTEM和blaSHV共3种耐药基因进行PCR扩增。blaCTX-M基因阳性菌株再用多重PCR进一步分群。
1.2.5 系统进化分群 参照文献[9],用多重PCR对大肠埃希菌分离株进行系统进化分群。PCR反应体系(25 μL):12.5 μL 2×PCR Master Mix酶,上、下游引物各1 μL,DNA模板1 μL,ddH2O 9.5 μL。PCR反应条件:94℃预变性5 min;94℃ 30 s,55℃ 30 s,72℃ 30 s,共30个循环;72℃ 7 min。PCR产物用10 g/L琼脂糖凝胶电泳检测。
《夜》剧中第一次出现中国元素就是中国佬厨师。那个厨师在整部剧中没有一句台词,仿佛是个隐形人,但他却侧面推动了情节的发展。导游香农为了让那帮女游客下车,让餐馆老板玛克辛提供给他一份含有中国菜的菜单,用中国菜、中国厨师和来自中国上海等独特的中国元素来吸引她们。“中国佬厨师”、“上海人”、“来自特设俱乐部”、“钻研大陆烹饪技术”和“牛肉杂烩和各种热炒都会做”(1982:409)等字眼中给人的印象是一个地道的高级中国厨师,也让我们看到中国热炒的魅力。当然,这些中国元素也间接折射了二战前后华人在美国的生存状态。无论是作为厨师,还是开洗衣店,都不是体面的职业,也缺少稳定的收入。
1.2.6 大肠埃希菌同源性PCR鉴定 用肠杆菌科基因间重复共有序列(ERIC)对大肠埃希菌分离株进行PCR扩增和指纹图谱分析。上游引物序列ERIC1R:5′-ATGTAAGCTCCTGGGATTCAC-3′,下游引物序列ERIC2:5′-AAGTAAGTGACTGGGGTGAGCG-3′。PCR反应体系(25 μL): 12.5 μL 2×PCR Master Mix酶,上、下游引物各1 μL,DNA模板1 μL,ddH2O 9.5 μL。PCR反应条件:94℃5 min;94℃ 30 s,48℃ 80 s,72℃ 2 min,共30个循环;72℃ 10 min。PCR产物用10 g/L琼脂糖凝胶电泳检测。
1.2.7 毒力相关基因检测 用PCR方法对大肠埃希菌分离株的毒力相关基因进行扩增,选择的25种毒力相关基因:eae、F4、F5、F6、F18、F41、LT、STa、STb、EAST1、STX1、STX2和Stx2e基因,以及fimC、fyuA、hlyF、irp2、iroN、iss、iucD、lt、ompT、tsh、va和st基因[10]。
1.2.8 血清型鉴定 参考致泻性大肠埃希菌O抗原诊断血清(63种)使用说明书的操作步骤,用玻片凝集法对ESBL表型大肠埃希菌进行O因子血清凝集试验,同时设5 mg/mL石炭酸生理盐水与菌液的混合液为阴性对照。
2 结果
2.1 细菌分离鉴定结果
用选择性培养基和大肠埃希菌特异性引物,从322份样品中共分离到36株大肠埃希菌分离株,分离率为11.2%。ERIC-PCR指纹图谱分析结果表明36株菌分属于5类带型,即5种克隆株,部分结果见图1。
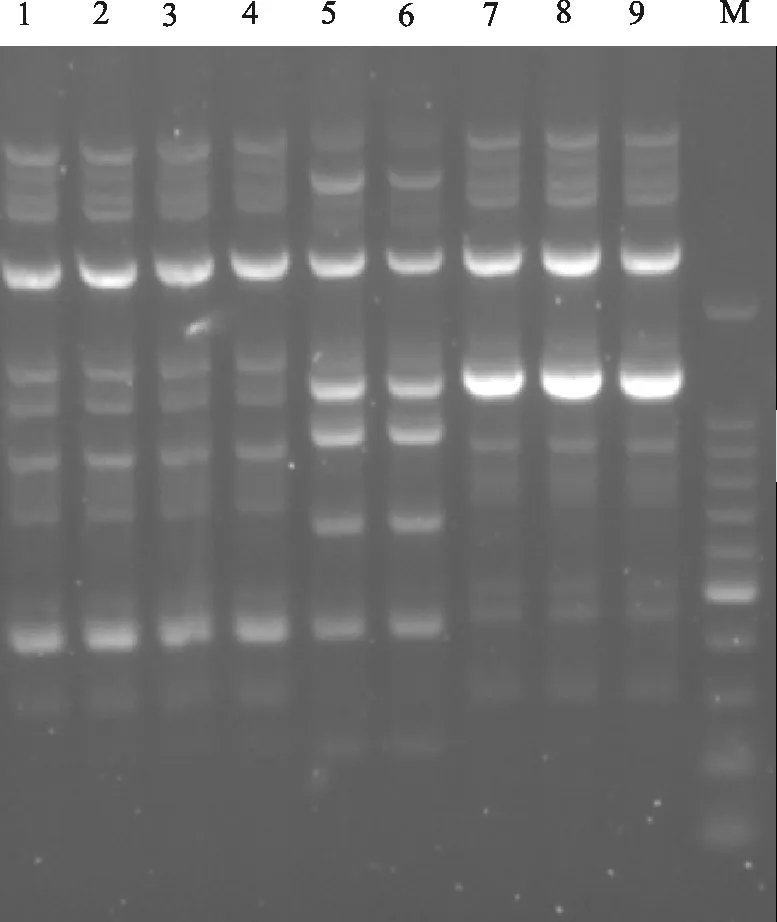
M.DNA 标准DL 2 000;1~9.三类大肠埃希菌克隆株
M.DNA Marker DL 2 000;1-9.Three classes of clones ofE.coli
图1大肠埃希菌Eric PCR鉴定结果(部分数据)
Fig.1 Identification results ofEscherichiacoli
Ericby PCR (Part data)
2.2 耐药性分析
2.2.1 耐药率 对大肠埃希菌分离株进行了氨基糖苷类、β-内酰胺类、磺胺类、氯霉素类、喹诺酮类和四环素类6大类共计19种抗菌药物敏感性检测,各类抗菌药物的耐药情况见表1。其中头孢唑林、氨苄西林、哌拉西林、氨苄西林-舒巴坦和阿莫西林-克拉维酸的耐药率相对其他较高,为36.1%(13/36);其次是头孢噻肟,耐药率为33.3%(12/36);头孢他啶和头孢吡肟耐药率为27.8%(10/36),四环素耐药率为25%(9/36),复方新诺明耐药率为22.2%(8/36);对氨曲南的耐药率相对较低,为13.9%(5/36);而对氯霉素、庆大霉素、环丙沙星、左氧氟沙星相对敏感,其耐药率均为5.6%(2/36);对阿米卡星、亚胺培南、美罗培南和哌拉西林-他唑巴坦全部敏感。经系统判定为ESBLs表型的大肠埃希菌占36.1%(13/36)。

表1 淡水鱼大肠埃希菌对抗菌药物耐药情况
2.2.2 耐药谱 对鱼源大肠埃希菌分离株耐受的抗菌药物种类,对应的耐药菌株数及百分比和主要的耐药模式进行统计和分析,结果见表2。有16株分离株对所有抗菌药物全部敏感(44.4%),1株分离株只对1种抗菌药物耐药(2.8%),6株分离株同时对2种抗菌药物耐药(16.7%),其余分离株对3种以上的抗菌药物耐药。有4株分离株对6种~7种抗菌药物耐药(11.1%),有6株分离株对8种~9种抗菌药物耐药(16.7%),有2株分离株对15种抗菌药物耐药(5.6%)。
2.3 耐药基因检测
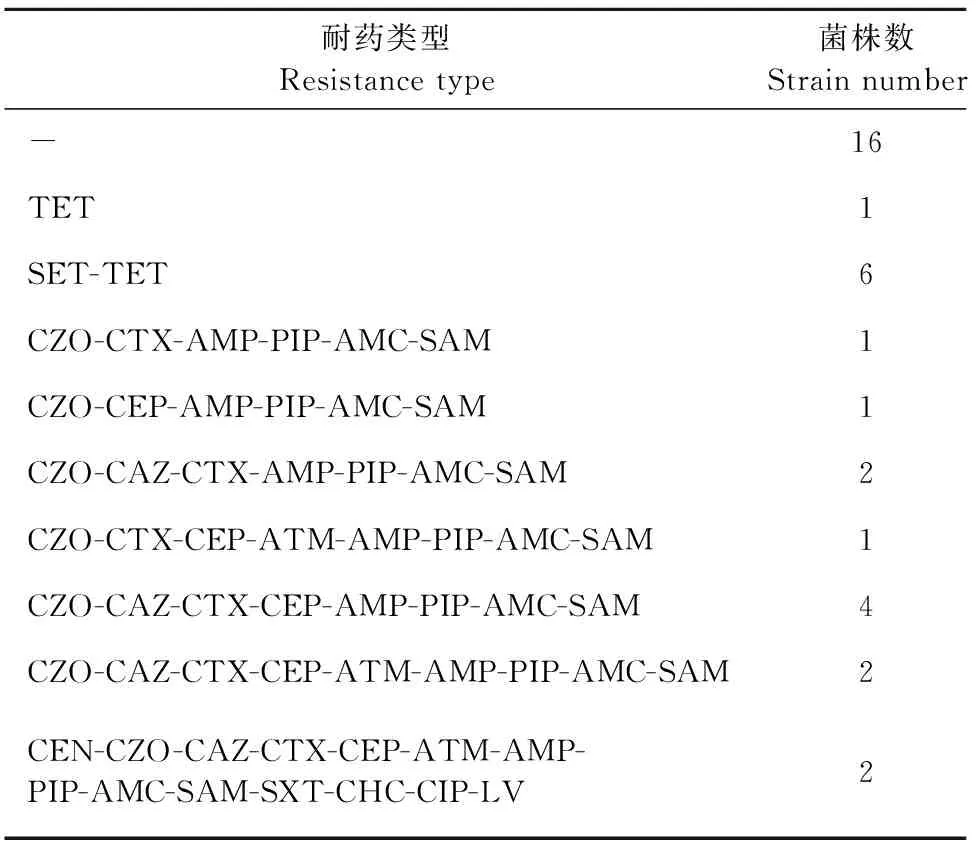
表2 36株鱼源大肠埃希菌的耐药表型
2.4 菌株进化分群
36株大肠埃希菌分离株的分群结果为A群占50%(18/36),B1群占50%(18/36),未检测到B2群和D群。
2.5 毒力相关基因检测
36株大肠埃希菌分离株fimC基因阳性34株(94.4%,34/36),ompT基因阳性11株(30.6%,11/36),iucD基因阳性2株(5.6%,2/36),同时检测到fimC基因和ompT基因的11株(30.6%,11/36),其他毒力相关基因检测为阴性。
2.6 血清型鉴定结果
13株ESBLs表型大肠埃希菌检测到的O抗原血清型有O164、O8、O78和O26共4种,其中O164为优势血清型(76.9%,10/13),O8、O78和O26血清型各1株。
3 讨论
本研究从322份淡水养殖鱼样品中分离获得36株大肠埃希菌,分离率相对较低(11.2%)。其中243份健康鱼中分离到12株大肠埃希菌(5.1%),而79份病鱼样品分离获得24株(30.4%),病鱼大肠埃希菌携带率显著高于健康鱼。健康鱼样本皆为10月~次年1月间收集,而病鱼样本为7月~8月间收集,这种差异与季节因素也具有相关性[11]。
整体来说,大肠埃希菌分离株对β-内酰胺类药物耐药率最高(36%),而氨基糖苷类、氯霉素类和喹诺酮类药物耐药率较低(6%),耐药率显著低于本课题组同期对长春地区猪、鸡大肠埃希菌分离株的测定结果[8-9]。另外,根据Hong XJ等[12]对广东省水库鱼的大肠埃希菌耐药的研究结果,氨苄西林的耐药率最高(51%),其次是四环素(39%)、复方新诺明(42%)和环丙沙星(37%),耐药率均高于本研究,这可能是由于南北环境气候差异,南方气温偏高易于细菌繁殖,使用抗菌药物频繁,导致细菌耐药率高于北方。
进一步分析发现,病鱼携带的大肠埃希菌分离株耐药更为严重,24株有13株为ESBLs耐药菌,仅有4株对测试的抗菌药物敏感,而分离自健康鱼的12株大肠埃希菌对测试的抗菌药物全部敏感。从毒力特性分析,分离株检测到粘附毒力相关因子fimC、离子摄取相关毒力因子icuD和保护因子ompT,这几种毒力基因常见于分离自家禽的致病性大肠埃希菌,其中O26、O78血清型分离株亦是禽源大肠埃希菌的主要血清型,提示部分大肠埃希菌分离株可能来源于养殖水体中污染的家禽粪便。从病鱼分离获得的13株ESBLs表型大肠埃希菌中有11株为O164血清型,该血清型常见于肠侵袭性大肠埃希菌(enteroinvasiveEscherichiacoli,EIEC),这11株菌均携带fimC和ompT毒力基因,其他2株ESBLs表型菌株携带icuD毒力基因,血清型分别为O8和O78,而健康鱼分离株均未检测到ompT和icuD毒力基因。这些ESBLs菌株的致病性及其与耐药表型的关联有待于进一步研究。
本研究尝试对ESBLs分离株进行接合转移以研究其质粒携带耐药基因的水平转移,但试验发现,这些菌株本身具有较高的叠氮钠抗性(最小抑菌浓度为640 μg/mL),与受体菌E.coliJ53具有相同抗性水平而失去筛选标记,因而试验未能成功,但这一失败结果并不表明分离株不能通过质粒介导耐药基因的水平传播。同时提示鱼源大肠埃希菌对防腐剂的耐受性值得关注。
合理使用抗菌药物对水产养殖业细菌性疾病的控制具有较好的效果,但近些年,由于大量盲目的使用抗菌药物,导致细菌耐药性日益严重。大肠埃希菌在多种生态环境中均扮演了耐药基因贮存库的角色,鱼类携带的大肠埃希菌在与其他鱼源病原菌混合感染时,可介导耐药性的传播,扩大危害性。在水产养殖和消费过程中,也对人类的健康构成威胁,因此,在水产养殖生产过程中应合理选择及使用抗菌药物,避免不规范的低剂量预防用药。
