人工针阔混交林土壤微生物群落碳代谢特征1)
2018-12-21张萌萌张钰莹吴迪孙广玉
张萌萌 张钰莹 吴迪 孙广玉
(东北林业大学,哈尔滨,150040)
土壤圈是地球系统的组成部分,土壤微生物是土壤中最活跃的部分,是土壤中分解者的主要成分之一,在推动土壤物质转换、能量流动和生物地化循环中起着重要作用[1]。在土壤生态系统中,土壤微生物在土壤形成、生态系统的生物地球化学循环、污染物质的降解和维持地下水质量等方面都具有重要作用[2-4]。
针阔混交林是指介于针叶林和落叶阔叶林两者之间的一种过渡类型的林型。通常情况下,针阔叶混交林可以分为3大种主要类型:温性针阔混交林、暖性针阔混交林和人工形成的针阔混交林。但是其它的任何以针叶树与阔叶树所形成的林地均可被称为针阔混交林[5]。
在针阔混交林生态系统中,各生物种类相互制约,从某种程度上,可以控制病虫害的大量发生。与针叶林纯林相比,针阔混交林对维持森林生态系统的平衡和稳定性有着十分重要的作用。在研究西南桦(Betulaalnoides)×红椎(Castanopsishystrix)混交林碳贮量时发现,混交林生态系统碳储量及碳固定速度均高于纯林[6];红椎-马尾松(Pinusmassoniana)混交林生物量高于红椎纯林,却低于马尾松纯林[7];杉木(Cunninghamialanceolata)混交林相关研究表明[8],杉木与马尾松混交提高了土壤氮素、磷素和有机质质量分数,杉木和毛竹(Phyllostachysheterocycla)混交会提高土壤氮素和钾质量分数。目前,关于混交林方面的研究多集中在混交林林分生长情况[9]、混交林小气候调节效应[10]、混交林凋落物[11]和混交林植物多样性[12]等方面,而对针阔混交林土壤微生物群落结构及多样性报道较少。土壤微生物作为土壤碳输入与输出的重要桥梁和纽带,与土壤C、N、P等营养元素循环转化的生物化学过程之间存在非常密切的关系,因此,了解针阔混交林土壤微生物碳代谢多样性具有十分重要的意义。本研究选取帽儿山尖砬沟森林培育试验站1987年营建的人工针阔混交林(28 a)为研究对象,探讨针阔混交林土壤微生物群落中的碳代谢微生物多样性变化特征,为人工混交林的培育提供基础资料。
1 研究区概况
试验样地设于黑龙江省尚志市境内的东北林业大学帽儿山林场尖砬沟森林培育试验站(45°21′~45°25′N,127°30′~127°34′E),低山丘陵地貌,温带大陆性季风气候,全年平均气温2.8 ℃,1月平均气温-23 ℃,7月平均气温20.9 ℃。全年无霜期120~140 d。全年平均降水量723 mm,蒸发量1 094 mm。地带性土壤为暗棕壤,平均土层厚度在40 cm左右,剖面呈酸性(pH=4.3~6.0)。地带性顶极群落为阔叶红松林。试验站所在区域经过多次破坏,形成以白桦(Betulaplatyphylla)、红松(Pinuskoraiensis)、水曲柳(Fraxinusmandshurica)及胡桃楸(Juglansmandshurica)等为主要树种的次生林。
选用1987年春营建的试验林中的5种林型,分别为红松纯林、胡桃楸纯林、红松和胡桃楸混交林、水曲柳纯林、红松和水曲柳混交林。混交方式为带状混交,株行距为1.5 m×1.5 m,各混交林试验林型之间被次生林间隔。各林分处于同一地块,坡度平均为7°。
2 研究方法
于2014年7月进行采样,取上述5种林型所对应的7种根际土壤:红松纯林根际土壤、胡桃楸纯林根际土壤、胡桃楸和红松混交林中的胡桃楸林根际土壤、胡桃楸和红松混交林中的红松林根际土壤、水曲柳纯林根际土壤、水曲柳和红松混交林中的水曲柳林根际土壤、水曲柳和红松混交林中的红松林根际土壤。在每个样地随机选取3个20 m×20 m的样方,作为3次重复,运用“10点”取样法在各个样方进行取样,首先去除植株表面0~5 cm的表层土壤,然后轻轻去除根系的周围土壤,将附于根际表面的土壤用软毛刷轻轻刷下,装入无菌夹口袋,放于装有冰袋的泡沫盒中保存,并带回实验室,过2 mm筛后即刻进行BiologMT试验。
微生物群落碳代谢功能多样性,采用有31种碳源的生态板(Biolog-ECO)对红松纯林、胡桃楸纯林、胡桃楸林(胡桃楸-红松混交林)、红松林(胡桃楸-红松混交林)、水曲柳纯林、水曲柳林(水曲柳-红松混交林)、红松林(水曲柳-红松混交林)7种试验林型土壤进行分析[13]。Biolog平板的接种液采用Classen et al.[14]的方法制备。用8通道加样器向Biolog微平板中分别添加150 μL稀释液。最后,放于25 ℃恒温培养箱中,在0、24、48、72、96、120、144、168、192和240 h时用酶标仪测定各孔在590 nm波长下的光吸收值。
根据相关文献[15]~[17]提供的公式计算以下指标:
(1)平均颜色变化率(DAWC),该指标代表微生物的代谢强度,即利用单一碳源的水平。
DAWC∑(Ci-R)/31。
其中,Ci是第i个碳源孔的吸光值,R为对照孔的吸光值。
(2)多样性指数Shannon,该指标代表了物种的丰富度。
H=-∑Pi×ln(Pi)。
其中,Pi为第i个孔的相对吸光值与整个平板的相对吸光值总和的比率。
(3)优势度指数Simpson,该指标可以评估某些最常见种的优势度。
D=1-∑(Pi)2。
其中,Pi为第i个孔的相对吸光值与整个平板的相对吸光值总和的比率。
(4)均匀度指数McIntosh,该指标可以代表群落物种均匀度。
其中,ni是第i个孔的相对吸光度值。
(2)、(3)、(4)选用数据为培养了72 h的BiologMT板各孔吸光度值,因为此刻几乎所有微生物都已进入碳源代谢过程,所以此时的数据能够全面的反映微生物群落的信息[18-19]。
采用Microsoft Excel 2013软件对数据进行分析和作图,通过SPSS 19.0软件进行主成分分析和单因素方差分析。显著性水平定为α=0.05。
3 结果与分析
3.1 不同林型下根际土壤微生物利用总碳源的动力学特征
通过测定BiologMT板中每个孔的吸光度值来计算平均颜色变化率,其能够表征待测土壤样本中微生物群落对某一种碳源的利用情况,反映了微生物群落碳代谢生理功能。根据不同针阔叶人工林土壤微生物群落在整个培养周期过程中的代谢强度,绘制了平均颜色变化率DAWC随时间动态变化曲线(表1)。由表1可知,在整个培养周期过程中,不同林型下土壤微生物群落碳源利用趋势均为“S”型,DAWC值会随着培养时间的延长而增长,最后趋于不变。DAWC值在培养初期(t<24 h)变化甚小,说明土壤微生物未适应当下的生存环境,对碳源底物的利用率低。随着土壤微生物对环境的不断适应,DAWC值呈现快速增长,说明土壤微生物对碳源底物的利用程度不断加大。培养后期,DAWC值增长缓慢,最后趋于不变。在培养72 h,红松和胡桃楸混交林与纯林相比,平均颜色变化率的结果为红松纯林小于红松林(红松-胡桃楸混交林)、胡桃楸纯林大于胡桃楸林(红松-胡桃楸混交林)、胡桃楸纯林大于红松纯林,表明胡桃楸纯林的土壤微生物群落碳代谢活性高于红松纯林,红松纯林低于混交林,而且胡桃楸纯林则高于混交林;培养后期,平均颜色变化率的结果却为红松纯林大于红松林(红松-胡桃楸混交林)、胡桃楸纯林大于胡桃楸林(红松-胡桃楸混交林)。同时表1可知,在整个培养过程中,均表现为红松纯林大于红松林(红松-水曲柳混交林)、水曲柳纯林大于水曲柳林(红松-水曲柳混交林),表明与纯林相比,红松和水曲柳混交后会降低土壤微生物群落的碳代谢活性。
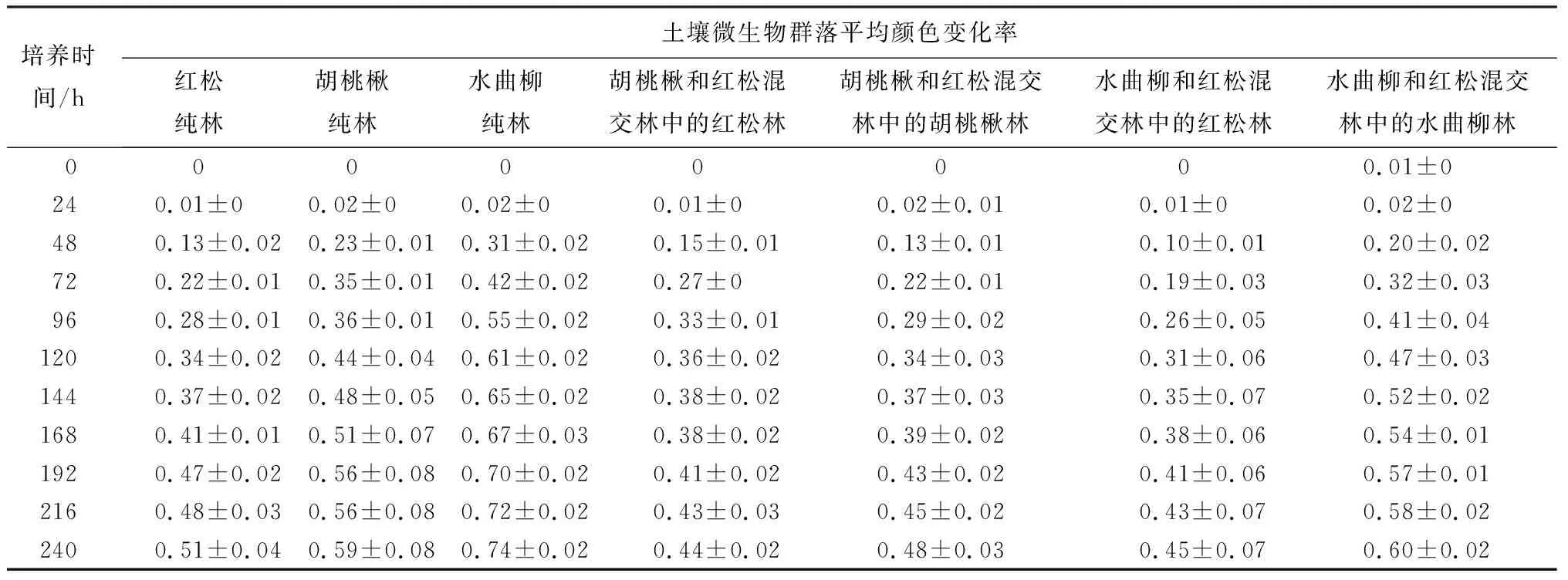
表1 不同林型土壤微生物群落平均颜色变化率随着培养时间变化
注:表中数据为平均值±标准误。
3.2 不同林型下土壤微生物群落多样性指数分析
根据DAWC值(培养72 h)分别计算以下3种指数:Shannon、Simpson和McIntosh(表2)。结果表明,不同林型下相同土壤微生物群落多样性指数均有所不同。Shannon指数表示土壤微生物群落的物种丰富度,该指数越高,说明该条件下土壤微生物种类越多且分布均匀。由表2中可知,Shannon指数表现由高到低分别为水曲柳纯林、胡桃楸纯林、红松纯林;红松纯林、红松林(红松-胡桃楸混交林)、红松林(红松-水曲柳混交林);胡桃楸纯林、胡桃楸林(红松-胡桃楸混交林);水曲柳纯林、水曲柳林(红松-水曲柳混交林)。表明胡桃楸纯林和水曲柳纯林(阔叶林)土壤微生物群落多样性高于红松纯林(针叶林),且水曲柳纯林显著高于其他两种纯林(p<0.05);与纯林相比,红松与胡桃楸混交、红松与水曲柳混交均会降低相应红松林土壤微生物群落多样性,且与红松混交后水曲柳林土壤微生物群落多样性显著低于纯林(p<0.05)。Simpson指数可以用来评估某些最常见物种的优势度,具体比较结果由高到低分别为胡桃楸纯林、红松纯林、水曲柳纯林;红松林(红松-水曲柳混交林)、红松纯林、红松林(红松-胡桃楸混交林);胡桃楸纯林、胡桃楸林(红松-胡桃楸混交林);水曲柳林(红松-水曲柳混交林)、水曲柳纯林,表明胡桃楸纯林土壤常见菌群优势度高于红松,但水曲柳却与此相反,显著低于红松(p<0.05);与红松纯林相比,与胡桃楸混交会降低土壤常见菌群的优势度,而与水曲柳混交则会降低,但均未达到显著水平(p>0.05);与纯林相比,和红松混交会降低胡桃楸林土壤常见菌群的优势度(p>0.05),但会显著提高水曲柳林(p<0.05)。McIntosh指数表示了土壤微生物群落物种均匀度,具体比较结果由高到低分别为水曲柳纯林,胡桃楸纯林,红松纯林;红松林(红松-胡桃楸混交林),红松纯林,红松林(红松-水曲柳混交林);胡桃楸纯林,胡桃楸林(红松-胡桃楸混交林);水曲柳纯林,水曲柳林(红松-水曲柳混交林),表明水曲柳纯林和胡桃楸纯林土壤微生物群落均匀度显著高于红松纯林(p<0.05);与红松纯林相比,和胡桃楸混交会显著提高土壤微生物群落均匀度(p<0.05),然而与水曲柳混交会降低,但未达到显著水平(p>0.05);与纯林相比,和红松混交会显著降低胡桃楸林和水曲柳林土壤微生物群落均匀度(p<0.05)。
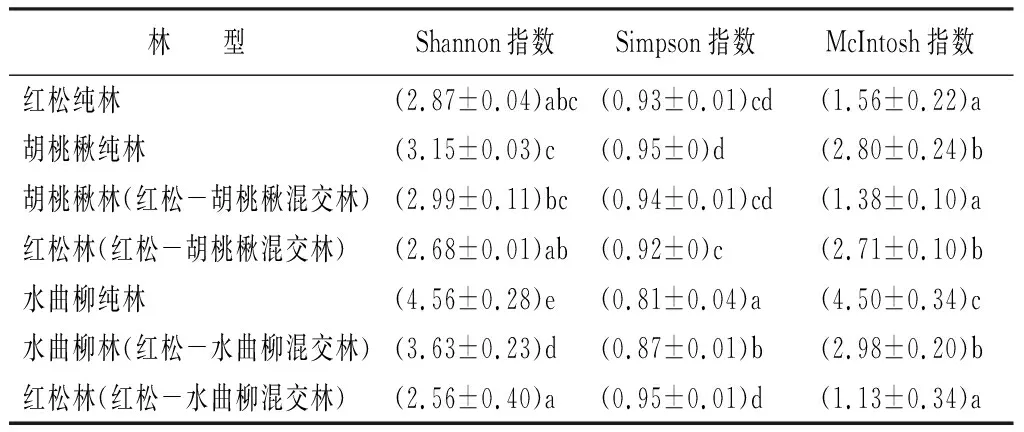
表2 培养72 h的根际土壤微生物群落多样性指数
注:括号中数据为平均值±标准误(3次重复),同列不同小写字母表示差异显著(p<0.05)。
3.3 不同林型土壤微生物对6大类碳源的利用强度
6大类碳源由胺类、氨基酸类、羧酸类、其他化合物类,聚合物类和糖类组成,包括31种碳源类型。整体而言(表3),不同林型土壤微生物群落对糖类、羧酸和氨基酸的利用程度明显高于其他3类。由表3可知,胡桃楸纯林土壤微生物对氨基酸、羧酸、聚合物和糖类的利用程度显著大于红松纯林;红松林(红松-胡桃楸混交林)对胺类、其他化合物和聚合物的利用程度低于红松纯林(p>0.05),而对氨基酸、羧酸和糖类的利用程度高于纯林,且前两种达到显著水平(p<0.05);胡桃楸林(红松-胡桃楸混交林)土壤微生物对6大类碳源的利用程度均低于纯林,且其中对氨基酸、羧酸、聚合物和糖类达到显著水平(p<0.05)。同时由表3亦可知,水曲柳纯林土壤微生物对6大类碳源的利用程度均显著高于红松纯林(p<0.05);红松林(红松-水曲柳混交林)土壤微生物对胺类的利用程度高于纯林,但未达到显著水平(p>0.05),对其他5种碳源的利用程度均低于纯林,其中氨基酸达到显著水平(p<0.05);水曲柳林(红松-水曲柳混交林)土壤微生物对氨基酸的利用程度高于纯林,但未达到显著水平(p>0.05),对其他5种碳源的利用程度均低于纯林,其中胺类、羧酸类和糖类达到显著水平(p<0.05)。
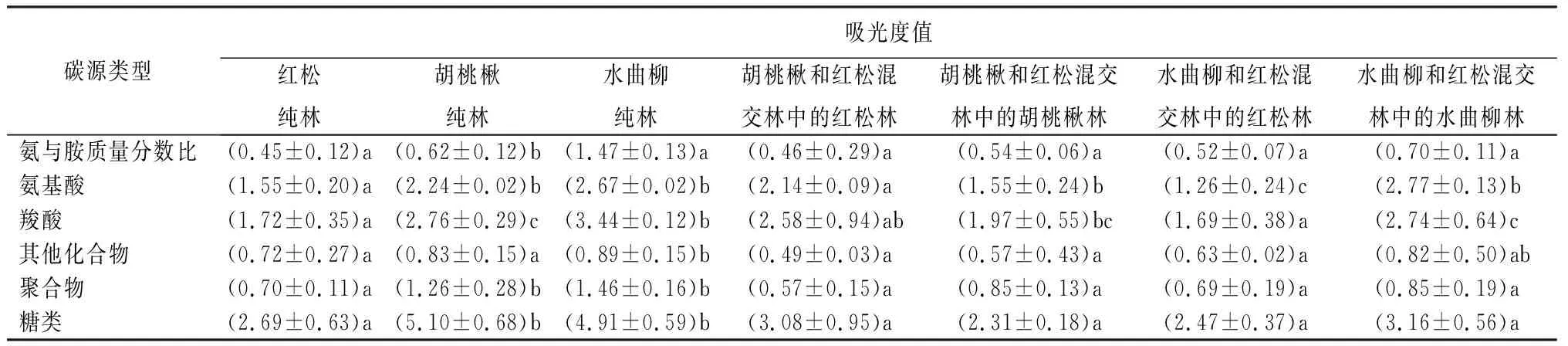
表3 不同混交林土壤微生物对不同碳源的利用强度
注:括号中数据为平均值±标准误(3次重复);同列不同小写字母表示差异显著(p<0.05)。
3.4 不同林型土壤微生物对碳源利用的主成分分析
主成分分析通过降维的方法来把不同样本的多元向量变换成互不相关的主元向量,主元向量空间在降维之后,其中各点的位置就能够直接地将不同样本的土壤微生物群落的代谢特征反应出来[20]。本试验从31种因子中提取出3个主成分因子(表4),分别解释所有变量方差的28.9%、14.8%、10.2%,其中主成分1(PC1)和主成分2(PC2)的累积贡献率达到为43.7%,说明主成分1和主成分2是变异的主要来源,基本可以用来解释变量的大部分信息。

表4 主成分的贡献率和积累贡献率 %
注:PC1,PC2,PC3分别代表从31种因子中提取出的3个主要成分因子。
图1可知,在PC1轴上,胡桃楸纯林、红松林(红松-胡桃楸混合林)、水曲柳纯林和水曲柳林(红松-水曲柳混合林)分布在正方向上,得分系数为1.08~3.54,红松纯林、胡桃楸林(红松-胡桃楸混合林)和红松林(红松-水曲柳混合林)分布在负方向上,得分系数为-0.60~-0.16。在PC2轴上,红松林(红松-胡桃楸混合林)和水曲柳林(红松-水曲柳混合林)分布在正方向上,得分系数为0.64~2.21;红松纯林、胡桃楸纯林、胡桃楸林(红松-胡桃楸混合林)、水曲柳纯林和红松林(红松-水曲柳混合林)分布在负方向上,得分系数-0.56~-0.27。
主成分分析中的因子载荷可以反映不同碳源利用的差异,绝对值越大表明该基质的影响越大,在碳源中起主要分异作用[20]。由表5可知,有PC1载荷在0.5以上的有16种碳源,分属于羧酸(5种)、氨基酸(3种)、糖类(2种)、胺类(2种)、其他化合物(2种)和聚合物(2种)(表3);PC2载荷在0.5以上的有8种,分属于氨基酸(2种)、羧酸(2种)、糖类(2种)、其他化合物(1种)和聚合物(1种)。由此可知,PC1、PC2中因子载荷高的基质能够解释大部分不同人工林型土壤微生物碳源利用的差异,其中占权重较大的基质分别来自羧酸、氨基酸和糖类。因此,可以认为本研究中羧酸、氨基酸和糖类这3类基质是导致微生物代谢呈现差异的碳源。
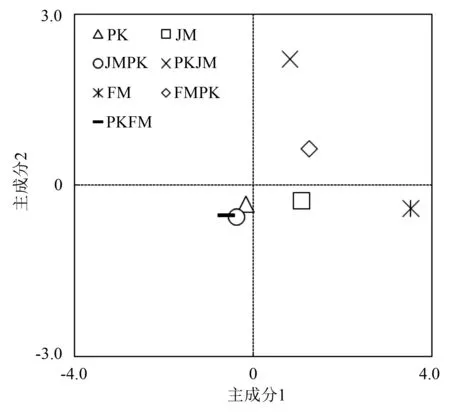
PK为红松纯林;JM为胡桃楸纯林;JMPK为胡桃楸和红松混交林中的胡桃楸林;PKJM为胡桃楸和红松混交林中的红松林;FM为水曲柳纯林;FMPK为水曲柳和红松混交林中的水曲柳林;PKFM为水曲柳和红松混交林中的红松林。
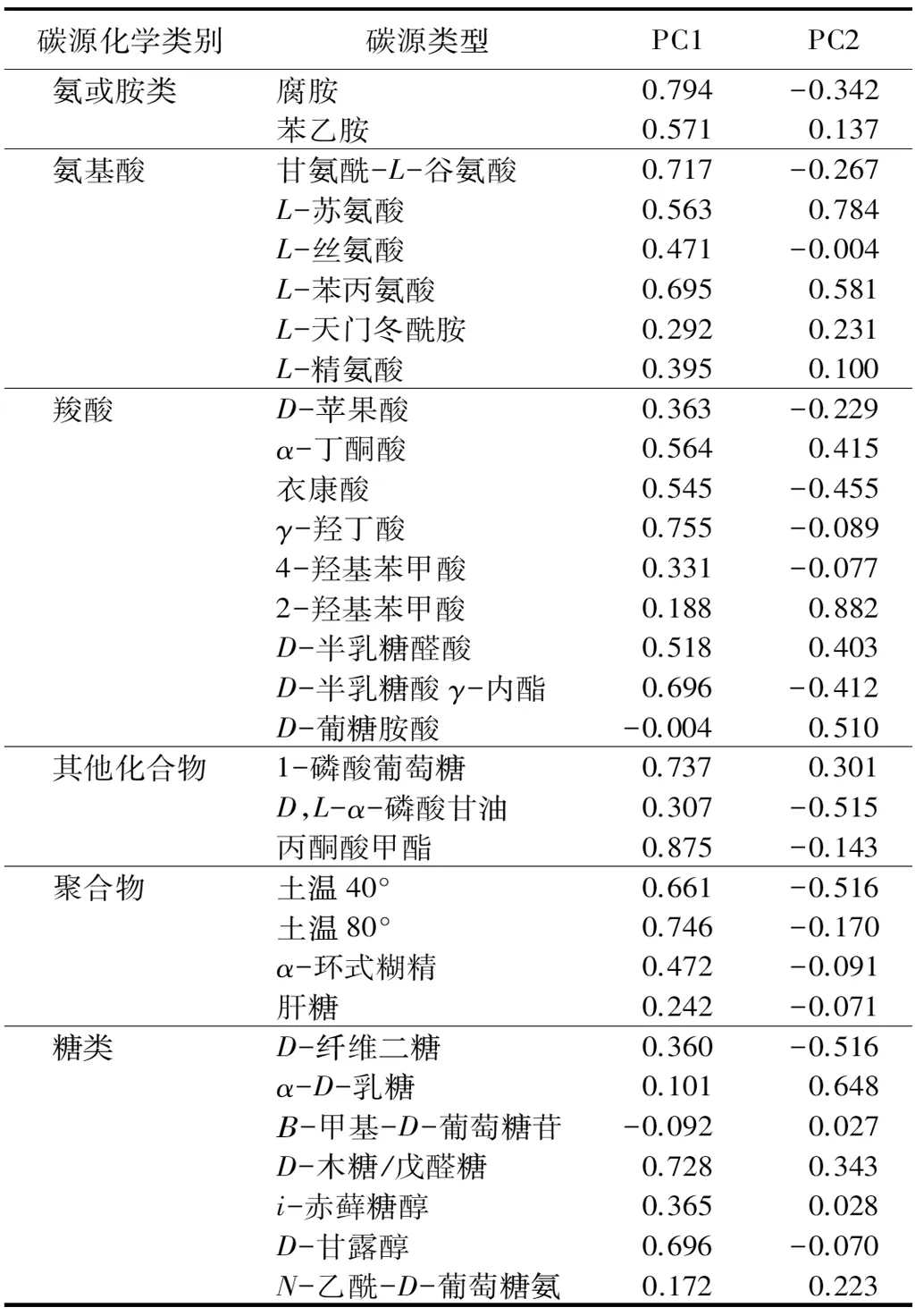
图1 不同混交林林型土壤微生物群落碳源利用主成分分析
4 讨论与结论
以BiologMT法分析营建28年的人工针阔混交林的土壤微生物变化特性,以及土壤微生物对多种碳底物的不同利用类型和程度来反应微生物群落的功能多样性[13],结果发现针叶林和阔叶林之间,混交林和其纯林之间的根际土壤微生物群落的活性存在着明显差异。从土壤微生物的整体活性变化来看,DAWC值变化幅度就能很好地反映土壤微生物利用碳源的能力以及微生物群落整体的代谢活性,一般情况下,DAWC变化幅度越大,微生物利用碳源的能力越强,微生物丰富度亦越高[21]。DAWC的变化幅度与植被类型有关,尤其是植被凋落物的种类和数量以及根系分泌物的成分会干扰土壤微生物的代谢活动,这是影响土壤微生物活性的主要因素[22-23]也有人认为,森林土壤有机碳质量分数会影响到DAWC变化,造成了阔叶林高于针叶林的结果[24]。本试验中,水曲柳和胡桃楸纯林的DAWC值均高于红松纯林,表明阔叶林微土壤微生物群落代谢活性高于针叶林,出现这一结果与凋落物数量、根系分泌物等有很大关系。一般情况下,阔叶林植物凋落物的数量高于针叶林,而且阔叶林根系数量,尤其是细根数量,以及根系代谢活性均高于针叶林[25-26]。相比较于纯林,胡桃楸林(红松-胡桃楸混交林)和水曲柳林(红松-水曲柳混交林)DAWC值均有所降低,表明与红松混交会降低胡桃楸和水曲柳林土壤微生物代谢活性。刘继明等[27]也发现了相似的现象,阔叶林土壤微生物对碳源的代谢能力强于混交林。这一现象可能与地表凋落物性质以及其分解速度改变土壤表层微生物活性有关[28-29]。不同针阔叶混交林土壤微生物活性变化不同,混交可能对土壤微生物活性产生促进作用或抑制作用,促进作用可能是枯落物混合为分解者提供更为有利的微环境,而抑制作用可能是不同枯落叶在混合分解过程中释放了一些次级化合物抑制枯落物分解。
土壤微生物群落多样性可以用Shannon指数、Simpson指数和McIntosh指数来衡量。本研究表明,水曲柳和胡桃楸纯林土壤微生物多样性和均匀度均高于红松纯林,这与张俊艳[30]的研究结果一致,胡桃楸纯林较高的原因可能是,胡桃楸根系分泌物向土壤中分泌大量有机质,其残体也提供了丰富的有机质[31]。红松与胡桃楸或水曲柳混交均能够显著降低红松土壤微生物群落的多样性。这与彭艳等[32]、谢英荷等[33]所得结论相反,混交林土壤群落结构并未在提高微生物群落多样性方面起到促进作用。
主成分分析能够解释不同人工林土壤微生物对碳源利用存在的差异[34]。本研究发现,无论是针阔叶纯林,还是针阔叶混交林,其土壤微生物主要利用的碳源类型均为糖类、羧酸和氨基酸。胡桃楸纯林对氨基酸、羧酸、糖类和聚合物的利用程度显著高于红松纯林,水曲柳纯林对6大类碳源的利用程度均显著高于红松纯林,这可能是胡桃楸和水曲柳土壤微生物碳代谢活性高于红松纯林的原因之一。胡桃楸林(红松-胡桃楸混交林)对氨基酸、羧酸、聚合物和糖类利用程度显著低于胡桃楸纯林,而水曲柳林(红松-水曲柳混交林)对胺类、羧酸类和糖类的利用程度显著低于水曲柳纯林,这可能造成混交后胡桃楸和水曲柳林土壤微生物碳代谢活性纯林。羧酸类中有5种碳源,氨基酸类中有3种碳源,糖类中有2种碳源使不同人工林型土壤微生物群落碳代谢功能在PC1上呈现差异;除氨基酸、羧酸和糖类,聚合物中有1种碳源及其他化合物中1种碳源使不同人工林土壤微生物群落碳代谢功能在PC2上呈现差异。因此,可以发现氨基酸、羧酸和糖类利用程度的不同造成红松和胡桃楸混交林与相应纯林土壤微生物碳代谢功能差异的主要原因。6大类碳源中,氨基酸、羧酸和糖类是PC1、PC2中因子载荷高的基质,说明这3类物质是研究土壤微生物群落碳代谢功能多样性变化的敏感碳源。
综上所述,阔叶林(胡桃楸、水曲柳)土壤微生物碳代谢活性高于针叶林(红松)。人工针阔叶混交林及纯林土壤微生物群落利用的主要碳源类型为糖类、羧酸和氨基酸,利用碳源类型和程度的不同是造成土壤微生物代谢活性差异的原因之一。与针叶林红松混交会降低阔叶林胡桃楸和水曲柳土壤微生物碳代谢活性及群落多样性,反之,亦会降低红松土壤微生物群落碳代谢功能多样性,若需选择,和胡桃楸混交降低程度稍低,可将其作为混交对象。在林地的经营方式和树种选择上应该合理配套,以实现其最大的生态价值。
