ThZFP1蛋白特异性结合的DNA顺式作用元件1)
2018-12-21段肖肖余振强臧丹丹张丹丹陈韵如王衷涵牛亦龙王玉成
段肖肖 余振强 臧丹丹 张丹丹 陈韵如 王衷涵 牛亦龙 王玉成
(林木遗传育种国家重点实验室(东北林业大学),哈尔滨,150040)
柽柳,属柽柳科柽柳属灌木或小乔木,在水土保持和固沙方面有一定优势,是有着极强适应逆境能力的树种,因此常被种植于干旱、盐渍地区[1]。锌指蛋白(ZFP)是一类通过结合锌离子折叠成手指状结构域(锌指结构域)的蛋白。锌指结构域主要由半胱氨酸(Cys)和组氨酸(His)组成。根据在手指的二级结构中C和H残基的数量和顺序(C和H分别代表半胱氨酸和组氨酸)的不同,锌指蛋白被分为9类,包括C2H2、C8、C6、C3HC4、C2HC、C2HC5、C4、C4HC3和CCCH[2-3]。锌指蛋白可以通过与靶分子DNA、RNA序列特异性结合[4],以及与自身或其他锌指蛋白的结合[5],在转录和翻译水平上调控基因的表达、细胞分化以及胚胎发育等。锌指蛋白在植物的非生物胁迫与植物发育方面有重要功能。在之前的研究中,我们发现C3HC4环形锌指蛋白ThZFP1能够响应非生物胁迫,其过表达植株能够显著提高植物的抗旱耐盐能力[6],这表明ThZFP1在非生物胁迫的传导途径中扮演者重要的角色。
转录因子(Transcription factor,TF)在转录水平的调控是真核基因表达调控的主要方式,在细胞生命过程中发挥重要作用。转录调控过程以DNA为模板合成RNA,细胞中具有大量序列特异的DNA结合蛋白,这些蛋白能准确地识别并结合到特异的DNA序列,即DNA和蛋白质之间的相互作用。近年来,酵母单杂交技术已经被广泛应用于克隆和鉴定各种动植物的转录因子[7-11]。目前一般采用以DNA为中心的方法,即由已知DNA片段确定与之互作的蛋白[12-13],具有简单高效的优点,可以在体内检测蛋白质与DNA的相互作用,但是不能确定与特定的TF结合的DNA顺式作用元件的类型。因此,我们开发了以转录因子为中心的酵母单杂交(TF-Centered Y1H)方法[14],此方法可以揭示TF或TFs所识别的顺式作用元件,并将其广泛应用于研究DNA与蛋白质之间的相互作用。基因枪法是指用钨粉或金粉包裹外源DNA,而后依靠基因枪装置,利用高压氦气冲击波加速微弹去穿透植物细胞壁和细胞膜,使外源DNA进入植物细胞并整合到植物细胞染色体组中,从而达到稳定遗传和表达的目的。
本研究利用以TF为中心的反向Y1H方法,得到ThZFP1蛋白特异性结合的DOF和ARR1AT顺式作用元件,并运用基因枪技术和GUS酶活测定对上述结果进行验证,为更深入研究ThZFP1的调控网络奠定基础。
1 材料与方法
大肠杆菌感受态DH5α、pCMBIA 1301载体和pGADT7-Rec2载体、pHIS2-DNA随机文库均由本实验室保存;烟草由本实验室培养;In-Fusion Advantage PCR Cloning Kit、酵母单杂交试剂盒购自Clontech公司;酵母质粒提取试剂盒购自北京原平皓生物公司;X-α-Gal、3-AT、氨基酸、PEG3350、DMSO均购自Sigma公司。Kan和Amp购自Sigma公司,其它试剂为国产分析纯;DNA合成及测序在上海生工股份有限公司完成。
1.1 构建pGADT7-Rec2-ThZFP1载体
以柽柳cDNA为模板,设计Rec2-ThZFP1-F和Rec2-ThZFP1-R引物(如表1),将回收的ThZFP1基因片段和单酶切回收的pGADT7-Rec2片段用In-Fusion酶连接,构建成pGADT7-Rec2-ThZFP1载体。取上述连接液进行大肠杆菌转化。菌液涂在含50 mg/L Amp的固体LB培养基上筛选。随机挑取筛选培养基上的单菌落进行扩大培养,以Rec2-ThZFP1-F和Rec2-ThZFP1-R为引物,进行菌液PCR。将得到的阳性菌株送生工测序,并提取质粒。

表1 构建pGADT7-Rec2-ThZFP1重组载体的引物序列
1.2 ThZFP1结合的顺式作用元件特异性
pGADT7-Rec2-ThZFP1与pHIS2-DNA随机文库共转化酵母Y187,方法按酵母单杂交试剂盒(Clontech)。挑取SD/-His/-Leu/-Trp+3-AT选择培养基上的单克隆菌落,提取相应酵母单菌落的质粒并送上海生工股份有限公司测序。
1.3 识别的顺式作用元件与ThZFP1的特异性验证
将得到的识别顺式作用元件序列依次进行左缺失和右缺失,通过酵母单杂交技术来确定识别顺式作用元件的核心序列。构建pHIS2与元件1(简称A)、元件2(简称B),将pHIS2载体用EcoRI和SacI进行双酶切。将A和B的序列从左边的序列依次缺失,然后再从右边的序列依次缺失,用2次重复的形式串联,并在插入序列的两端分别引入EcoRI和SacI的酶切位点,直接合成两条互补的寡核苷酸。分别设计用于构建重组报告载体pHIS2-A(左右缺失)和pHIS2-B(左右缺失)的引物。然后,用酵母单杂交技术研究ThZFP1结合的元件序列。

表2 构建重组报告载体pHIS2-A/B的左右缺失的引物序列
1.4 ThZFP1与其识别的顺式作用元件在烟草中的互作验证
将上述研究的元件序列以3次重复串联的方式融合46 bp 35 s小启动子,所用的引物序列见表3,连接到pCAMBIA1301载体上构建报告载体,与pROKII-ThZFP1利用基因枪技术共同转化到烟草叶片中,测定GUS基因表达情况。
1.5 GUS酶活的测定
将进行基因枪轰击过的烟草,放在暗处培养48 h后,测定GUS酶活。取上述叶片利用液氮充分研磨,并加入600 μL酶提取液,充分震荡混匀后,离心后取上清液即为酶液。取50 μL酶液中加入37 ℃预热的450 μL MUG检测液,充分混匀,取50 μL上述混合液与950 μL的Na2CO3混合,并将此时记为0点,以无菌H2O为对照值并调零,并用同样的方法在5、10、20、30、45、60 min时间点,用荧光分光光度计测激发波长365 nm和发射波长455 nm下的荧光值。

表3 3次重复串联的方式融合46 bp 35 s小启动子的序列
2 结果与分析
2.1 柽柳ThZFP1识别的顺式作用元件的确定
利用TF-Centered Y1H进行确定ThZFP1结合的元件序列,方法为构建pGADT7-Rec2-ThZFP1载体,将其与pHIS2-DNA随机文库共转化酵母Y187,进行酵母单杂交,并挑取SD/-His/-Leu/-Trp+3-AT选择培养基上的阳性克隆菌落,提取相应酵母单菌落的质粒,阳性质粒转化到大肠杆菌体中测序,去除载体序列后,得到与pGADT7-Rec2-ThZFP1重组载体互作的插入序列分别为5’-CCGGAATCGG-3’、5’-AGAAAGAG-3’。
2.2 柽柳ThZFP1识别的顺式作用元件的核心序列的确定
为进一步确定ThZFP1结合的核心序列,将获得的序列依次进行左边界缺失和右边界缺失,即将5’-CCGGAATCGG-3’、5’-AGAAAGAG-3’序列从左边的序列依次缺失,然后再从右边的序列依次缺失,用2次重复的形式串联,通过构建pHIS2-A/B重组载体,利用酵母单杂交技术来确定识别顺式作用元件的边界序列。可以看出,5’-AATCGG-3’可以和ThZFP1互作,而5’-ATCGG-3’不能互作,说明其左边界为5’-AAT…-3’(图1),而5’-CCGGAATCG-3’可以与ThZFP1互作,但5’-CCGGAATC-3’则不能与ThZFP1互作,说明其右边界序列为5’-…ATCG-3’(图1),最后得到5’-CCGGAATCGG-3’插入序列与ThbZIP1互作的核心序列为5’-AATCG-3’。同理,5’-AGAAAGAG-3’插入序列与ThbZIP1互作的核心序列为5’-AAAG-3’(图2)。经过PLACE比对它们分别为ARR1AT和DOF元件。
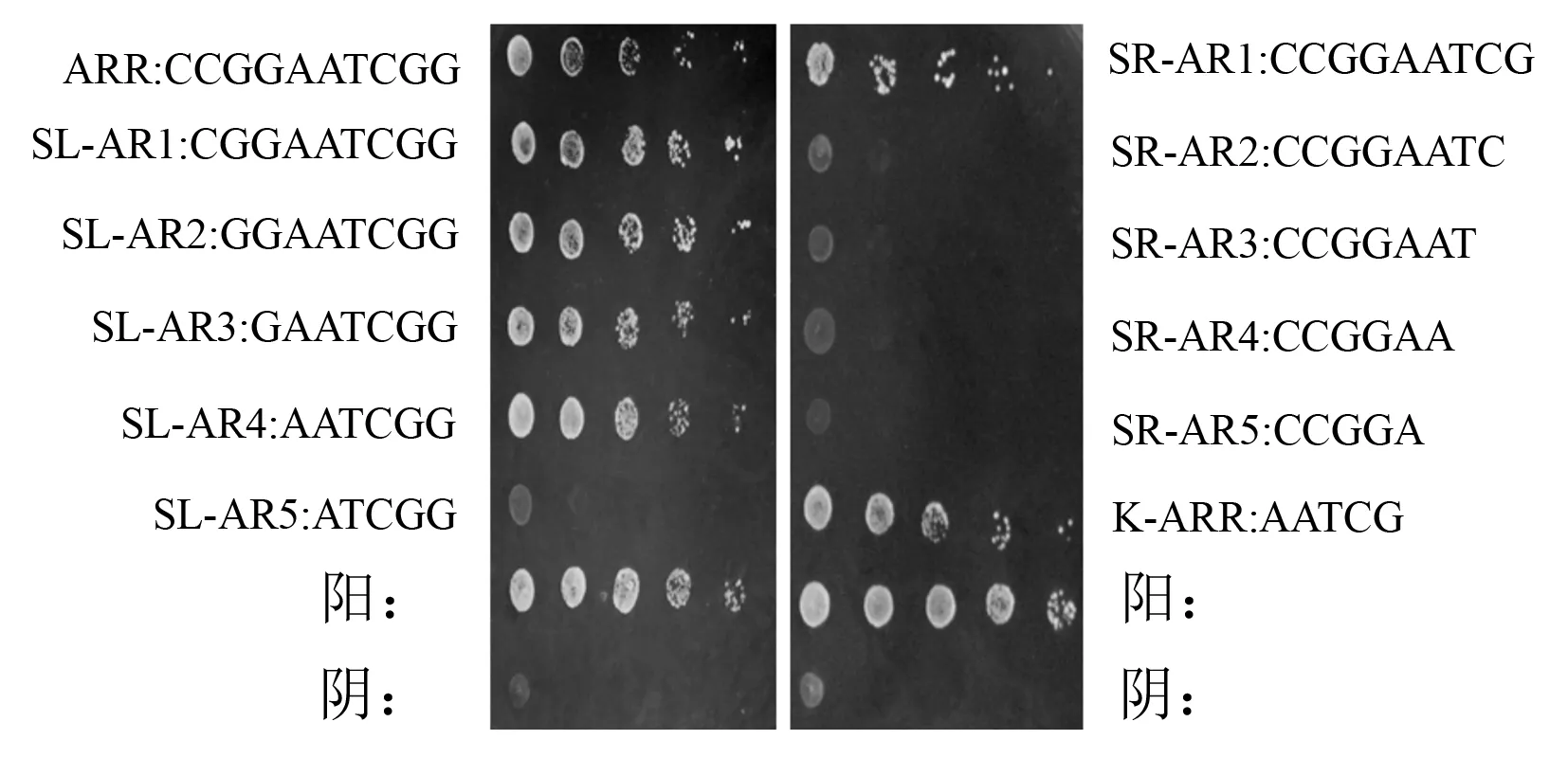
图1 元件A(ARR1AT)的核心序列确定

图2 元件B(DOF)的核心序列确定
2.3 ThZFP1与其识别的顺式作用元件在烟草中的互作验证
为了进一步验证ThZFP1与这些元件的互作,我们将ARR1AT、DOF元件及部分缺失突变的元件以3次重复串联的方式融合pCAMBIA1301-46bp载体,使元件融合46 bp小启动子并驱动GUS,作为reporter载体,将ThZFP1的ORF构建到pROK2,使其为35S启动子驱动(pROK2-ThZFP1),作为effector载体,将reporter载体分别与pROK2-ThZFP1报告载体利用基因枪技术共同转化到烟草叶片中(如图3),测定GUS活性,来研究这些元件与ThZFP1的结合,结果显示,这些元件均能与ThZFP1的结合(如表4)。结果进一步证明,ThZFP1能够与ARR1AT、DOF元件互作,但不能与突变元件互作,说明它们的互作是特异性的。

图3 基因枪技术共同转化到烟草叶片中
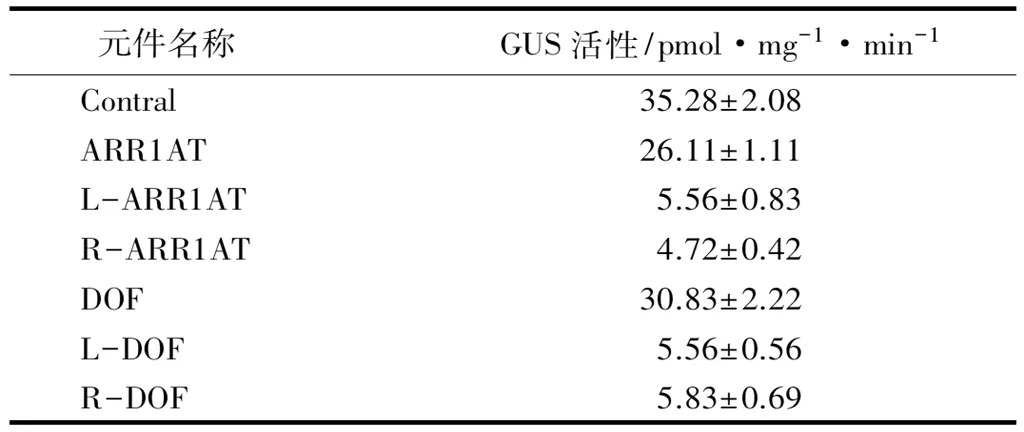
元件名称GUS活性/pmol·mg-1·min-1Contral35.28±2.08ARR1AT26.11±1.11L-ARR1AT5.56±0.83R-ARR1AT4.72±0.42DOF30.83±2.22L-DOF5.56±0.56R-DOF5.83±0.69
注:表中数据为平均值±标准差。
3 结论与讨论
我们利用TF-Centered Y1H技术对ThZFP1结合的DNA序列进行了互作的研究。将pGADT7-Rec2-ThZFP1和pHIS2-DNA随机文库同时转入Y187酵母细胞内,并通过TDO+3-AT培养基进行筛选,以研究ThZFP1蛋白与pHIS2-DNA随机文库的互作情况。通过测序结果比对可知,ThZFP1可以与pHIS2-DNA随机文库中的两种顺式作用元件互作,通过将这两种顺式作用元件依次进行左右缺失后,与pGADT7-Rec2-ThZFP1共转化Y187酵母感受态细胞内,得到这两种顺式作用元件的核心序列,经PLACE分析,其分别为ARR1AT、DOF两种顺式作用元件。为了验证我们得到的上述结论,将ARR1AT、DOF两种顺式作用元件和部分碱基缺失的序列与pCAMBIA1301-46bp小启动子相连构建载体,与pROK2-ThZFP1利用基因枪技术共同转化到烟草叶片中,测定GUS基因表达情况,说明ThZFP1蛋白能够与pHIS2-文库中的ARR1AT、DOF两种顺式作用元件互作。
以上研究说明,ThZFP1作为一个转录因子,可以和ARR1AT、DOF两种顺式作用元结合,并能够通过与这两种元件的结合来调控基因的表达,我们以往研究发现ThZFP1具有抗逆能力[6],说明,ThZFP1通过与这两种顺式作用元件结合来调控基因的表达,从而调控一系列抗逆反应。
