阿西替尼辅助肾部分切除术治疗转移性肾细胞癌的疗效分析
2018-12-21谢福晨陈学栋郭桂军
谢福晨,陈学栋,郭桂军
(1. 浙江省丽水市人民医院 泌尿外科,浙江 丽水 323000;2.赣南医学院第一附属医院泌尿外科,江西 赣州 341000)
转移性肾细胞癌是泌尿系统高度恶性肿瘤之一,患者5年生存率<10%[1]。据报道,分子靶向药物治疗可显著改善高危转移性肾细胞癌患者的预后,并降低术后复发转移风险[2-5]。多项临床研究表明,对多种药物治疗无效的转移性肾细胞癌患者,阿西替尼有较好的疗效[3-4]。目前临床上对阿西替尼用于转移性肾细胞癌的报道较少。本研究主要针对其辅助肾部分切除术进行临床研究,探究其临床价值。
1 资料与方法
1.1 一般资料
选取2016年1月—2018年1月浙江省丽水市人民医院和赣南医学院第一附属医院收治的转移性肾细胞癌患者120例。纳入标准:①首次确诊的转移性肾细胞癌患者。②未接受过相关药物、手术治疗。③无阿西替尼过敏症状。④美国东部肿瘤协助组(ECOG)评分0~3分。⑤患者及其家属同意并签署知情同意书。排除标准:①精神疾病史等而无法配合治疗。②严重基础疾病而无法耐受手术治疗。根据所用药物的不同分为对照组和观察组,对照组使用舒尼替尼(H20130258,美国辉瑞公司),观察组使用阿西替尼(H20150221,美国辉瑞公司),每组60例。其中,对照组男性37例,女性23例;平均年龄(59.1±7.59)岁。观察组男性36例,女性24例;平均年龄(61.1±6.59)岁。所有患者伴器官或组织局部转移,无重要脏器功能不全。两组患者一般资料比较,差异无统计学意义(P>0.05),具有可比性。
1.2 方法
对照组口服舒尼替尼50 mg/次,1次/d,服药4周,停药2周;观察组口服阿西替尼5 mg/次,2次/d,服药间隔时间12 h。根据患者不良反应情况调整用药,随访过程中若出现严重药物相关不良反应(≥3级)可适当调整剂量或者暂时停药。治疗持续至手术前或疾病进展。每3周复查血常规、肝肾功能、尿常规,评价血液学和不良反应。不良反应的严重程度根据通用术语标准不良事件(CTCAE)进行分级。两组患者由本科经验丰富的同一名医师完成肾保留切除术。
1.3 观察指标
1.3.1 临床疗效 服药后每个治疗周期(6周)复查肾脏CT或MRI评价肾脏肿瘤最大径的变化,依照实体肿瘤疗效评估标准(RECIST)进行评估[2]。①完全缓解(complete response, CR):所有靶病灶消失,无新病灶出现,且肿瘤标志物正常,维持≥4周。②部分缓解(partial response, PR):靶病灶最大直径之和减少≥30%,维持≥4周。③病情稳定(stable disease, SD):靶病灶最大直径之和缩小未达PR,或增大未达PD标准。④疾病进展(progressive disease,PD):靶病灶最大直径之和增加≥20%,或出现新病灶。客观缓解率(observe the objective remission rate,ORR)=(CR+PR)/总例数 ×100%,疾病控制率(disease control rate, DCR)=(CR+PR+SD)/总例数×100%。
1.3.2 免疫学相关指标 于治疗前1周及术后2周采集患者外周血,采用流式细胞仪检测其中T淋巴细胞CD3、CD4、CD8和HLA-DR的阳性率,了解治疗前后机体免疫水平[6]。
1.3.3 生活质量 采用Karnofsky(KPS)评分评估治疗前,以及治疗后1、3、6和12个月患者的生活质量。满分为100分,得分越高表明健康状况越好,且治疗后较治疗前提高>20分表明有效[7]。
1.3.4 无进展生存期(progression-free survival, PFS)和总中位生存期(and overall survival, OS) 参考文献[8],比较两组患者的PFS和OS。
1.4 统计学方法
数据分析采用SPSS 13.0统计软件,计量资料以均数±标准差(±s)表示,组间比较用独立样本t检验或重复测量设计的方差分析;计数资料以百分比或率表示,比较用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组患者的临床疗效评估
所有患者治疗时间>1个周期,于1个周期后进行评估。对照组CR 10例,PR 20例,SD 22例,PD 8例;观察组CR 20例,PR 26例,SD 12例,PD 2例。对照组ORR为50.0%,观察组为76.7%,经χ2检验,差异有统计学意义(P<0.05),观察组高于对照组。对照组DCR为90.0%,观察组为96.7%,经χ2检验,差异有统计学意义(P<0.05),观察组高于对照组。见表1。
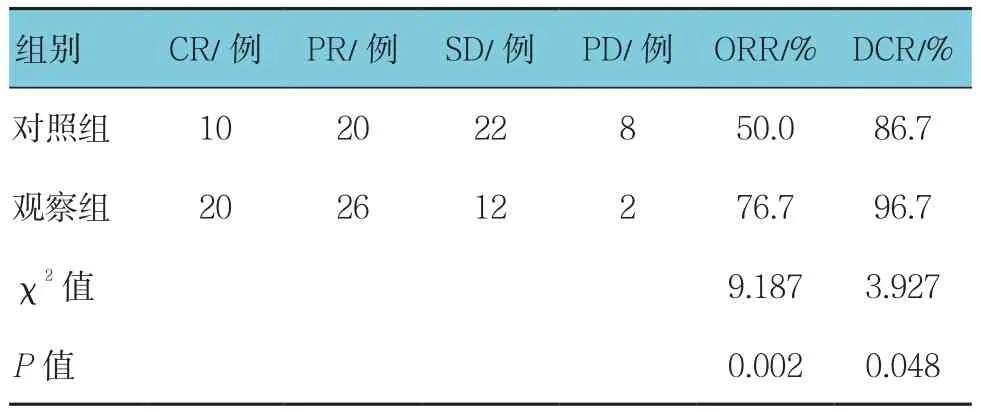
表1 两组患者的临床疗效比较 (n =60)
2.2 两组患者免疫学相关指标评估
对照组与观察组治疗前后的CD4+、CD8+和CD3+差值比较,经t检验,差异有统计学意义(P<0.05),观察组高于对照组。对照组与观察组治疗前后的HLA-DR+差值比较,经t检验,差异无统计学意义(P>0.05)。见表 2。
表2 两组患者治疗前后外周血T细胞表型变化(n =60,±s)

表2 两组患者治疗前后外周血T细胞表型变化(n =60,±s)
组别 CD4+ CD8+ CD3+ HLA-DR+对照组治疗前 30.1±8.2 27.9±8.8 60.9±8.7 10.6±9.1治疗后 41.6±8.9 32.4±5.1 63.3±8.9 9.4±6.5差值 11.5±8.1 4.5±5.2 2.4±8.0 -0.8±8.4观察组治疗前 30.2±8.5 28.0±8.7 60.8±8.6 10.8±9.2治疗后 45.1±9.9 35.6±8.9 67.5±9.2 9.3±6.6差值 14.9±8.1 7.6±7.6 6.7±7.6 -0.5±7.8 t值 2.056 2.252 2.714 0.183 P值 0.044 0.028 0.008 0.856
2.3 两组患者生活质量评估
对照组和观察组治疗前,以及治疗后1、3、6和12个月KPS评分比较,采用重复测量设计的方差分析,结果:①不同时间点的KPS评分有差别(F=954.920,P=0.000);②对照组与观察组的KPS评分有差别(F=452.718,P=0.000),观察组较对照组KPS评分高,生活质量较好;③两组KPS评分变化趋势有差别(F=92.625,P=0.000)。见表3和附图。
表3 两组患者各时间点的KPS评分比较 (n =60,±s)
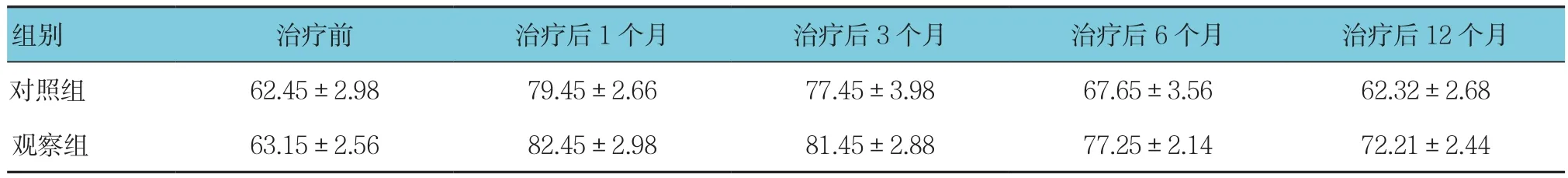
表3 两组患者各时间点的KPS评分比较 (n =60,±s)
组别 治疗前 治疗后1个月 治疗后3个月 治疗后6个月 治疗后12个月对照组 62.45±2.98 79.45±2.66 77.45±3.98 67.65±3.56 62.32±2.68观察组 63.15±2.56 82.45±2.98 81.45±2.88 77.25±2.14 72.21±2.44
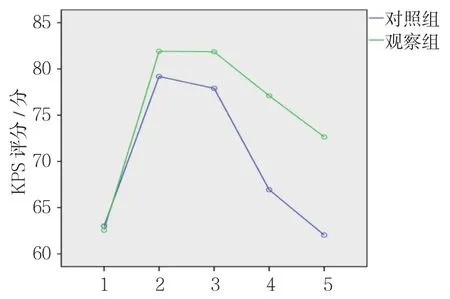
附图 两组患者KPS评分变化趋势
2.4 两组患者PFS和OS比较
对照组与观察组PFS和OS比较,经t检验,差异有统计学意义(P<0.05),观察组长于对照组。见表4。
表4 两组患者PFS和OS比较 (n =60,月,±s)

表4 两组患者PFS和OS比较 (n =60,月,±s)
对照组 10.53±2.62 14.19±5.23观察组 13.56±3.71 17.83±4.61 t值 5.168 4.044
3 讨论
目前,手术是治疗肾癌的基本手段,尤其对于转移性肾细胞癌[9],但其本身存在一定风险,再加上术后仍有一定的复发、转移率,故需要药物的辅助治疗[10]。大量的临床研究证实,舒尼替尼对肾癌的治疗具有明显疗效,大多数指南已经推荐其作为转移性肾细胞癌的一线治疗药物。因此本研究采用舒尼替尼与阿西替尼进行对比,以便更加准确地评估其疗效[11]。
血管内皮生长因子受体(vascular endothelial growth factor receptor, VEGFR)与病理性血管的生成、肿瘤生长及癌症的发展关系密切,而阿西替尼作为第2代口服小分子多靶点酪氨酸激酶抑制剂,就是通过阻断VEGFR来发挥作用[12-13]。本实验将阿西替尼应用于转移性肾细胞癌行肾部分切除术患者,并与舒尼替尼进行对比研究,PR 22例,CR 20例,并且患者免疫学相关指标也与服用舒尼替尼患者相当。在生活质量方面,较治疗前明显提高,并且能够保持较长时间的稳定。患者PFS和OS也达到较好的临床标准。
综上所述,阿西替尼辅助肾部分切除术治疗转移性肾细胞癌患者临床疗效显著。但本研究样本量较少,研究时间也不是特别充裕,对于阿西替尼药物相关不良反应等研究不够深入,但其作为转移性肾细胞癌的临床辅助用药疗效较好。
