多发性硬化诊断和治疗中国专家共识(2018版)
2018-12-21中国免疫学会神经免疫分会中华医学会神经病学分会神经免疫学组
中国免疫学会神经免疫分会中华医学会神经病学分会神经免疫学组
多发性硬化(multiple sclerosis,MS)是一种以中枢神经系统(CNS)炎性脱髓鞘病变为主要特点的免疫介导性疾病,病变主要累及白质。其病因尚不明确,可能与遗传、环境、病毒感染等多种因素相关。MS病理上表现为CNS多发髓鞘脱失,可伴有神经细胞及其轴索损伤,MRI上病灶分布、形态及信号表现具有一定特征性。MS病变具有时间多发(DIT)和空间多发(DIS)的特点[1-3]。
1 MS的临床分型
MS好发于青壮年,女性更为多见,男女患病比例为1∶1.5~1∶2[3]。CNS各个部位均可受累,临床表现多样。其常见症状包括视力下降、复视、肢体感觉障碍、肢体运动障碍、共济失调、膀胱或直肠功能障碍等[3]。临床分型如下[4]:
1.1复发缓解型MS(relapsingremittingmultiplesclerosis,RRMS) 此型疾病表现为明显的复发和缓解过程,每次发作后均基本恢复,不留或仅留下轻微后遗症。MS患者80%~85%最初病程中表现为本类型。
1.2继发进展型MS(secondaryprogressivemultiplesclerosis,SPMS) 约50%的RRMS患者在患病10~15年后疾病不再有复发缓解,呈缓慢进行性加重过程。
1.3原发进展型MS(primaryprogressivemultiplesclerosis,PPMS) 此型病程大于1年,疾病呈缓慢进行性加重,无缓解复发过程。约10%的MS患者表现为本类型。
1.4其他类型根据MS的发病及预后情况,有以下2种少见临床类型作为补充,其与前面国际通用临床病程分型存在一定交叉。
1.4.1良性型MS(benign MS):少部分MS患者在发病15年内几乎不留任何神经系统残留症状及体征,日常生活和工作无明显影响[5]。目前对良性型MS无法做出早期预测[6]。
1.4.2恶性型MS(malignant MS):又名爆发型MS(fulminant MS)或Marburg变异型MS(marburg variant MS),疾病呈爆发起病,短时间内迅速达到高峰,神经功能严重受损甚至死亡[5]。
2 MS的诊断
2.1诊断原则首先,应以客观病史和临床体征为基本依据;其次,应充分结合各种辅助检查特别是MRI与脑脊液(CSF)特点,寻找病变的空间多发与时间多发证据;第三,还需排除其他可能疾病。此外,除满足以上3项条件外,应尽可能寻找电生理、免疫学等辅助证据。
在考虑MS诊断时,所有患者均应行头部MRI检查。目前推荐应用1.5 T及以上场强MRI扫描仪;头部基本序列应该包括平扫(2D矢状面FLAIR序列,2D横断面T1、T2、DWI)及增强(横断面T1);扫描层数为全脑覆盖(约30~32层),层厚4 mm;中心定位线为平行胼胝体膝部、压部下缘连线;推荐注射造影剂后延迟5 min做增强扫描。有条件的单位,除DWI外,推荐其他所有序列的MRI检查采用3D扫描后薄层重建。脊髓MRI检查对于所有患者并非必要,但在脊髓受累为首发症状、原发性进展性病程以及在MS少见的人群(老年人或亚种人群)中考虑MS,或者需要进一步资料增加诊断的可靠性时,应行脊髓MRI检查。推荐序列包括矢状面T1、T2,连续横断面T1、T2,以及增强后矢状面、横断面T1。
2.2诊断标准
2.2.1成人MS:推荐使用2017年McDonald MS诊断标准(表1)[7],其适合于典型发作MS的诊断,如果患者满足2017年McDonald标准,并且临床表现没有更符合其他疾病诊断的解释,则诊断为MS;如有因临床孤立综合征怀疑为MS,但并不完全满足2017年McDonald标准,则诊断为可能的MS;如果评估中出现了另一个可以更好解释临床表现的诊断,则排除MS诊断

表1 2017年McDonald MS诊断标准[7]
注:CNS:中枢神经系统;MS:多发性硬化;PPMS:原发进展型MS
a:不需要额外的检测来证明空间和时间的多发性。然而除非MRI不可用,否则所有考虑诊断为MS的患者均应该接受脑MRI检查。此外,临床证据不足而MRI提示MS,表现为典型临床孤立综合征以外表现或具有非典型特征的患者,应考虑脊髓MRI或脑脊液检查,如果完成影像学或其他检查(如脑脊液)且结果为阴性,则在做出MS诊断之前需要谨慎,并且应该考虑其他可替代的诊断
b:基于客观的2次发作的临床发现做出诊断是最保险的。在没有记录在案的客观神经系统发现的情况下,既往1次发作的合理历史证据可以包括具有症状的历史事件,以及先前炎性脱髓鞘发作的演变特征;但至少有一次发作必须得到客观结果的支持。在没有神经系统残余客观证据的情况下,诊断需要谨慎
c:尽管脑脊液特异性寡克隆带阳性本身并未体现出时间多发性,但可以作为这项表现的替代指标
以往2001年、2005年及2010年McDonald MS诊断标准同样适用。对于存在NMO谱系疾病(NMO spectrum disorders,NMOSD)可能的人群,如脊髓受累超过3个椎体节段以上、典型第三脑室周围器官(CVO)受累症状、颅内缺乏典型MS病变、严重视神经炎、合并多项自身免疫疾病或相关抗体阳性者,包括复发性长节段性横贯性脊髓炎(recurrent longitudinally extensive transverse myelitis,rLETM)和复发性视神经炎(recurrent optic neuntis,rON)等疾病,MS应与其进行鉴别。建议疾病急性复发期及免疫治疗前进行血清水通道蛋白4(AQP4)抗体的检测。
因不同国家/种族人群中的验证研究并无证据显示2010年版McDonald标准不能用于这些人群。因此,2017年McDonald MS诊断标准同样适合不同国家/种族人群,但应注意排除与其相似的疾病,尤其是在非洲裔美国人、亚裔、拉丁美洲裔和儿童患者中排除NMOSD。
2017年版McDonald MS诊断标准对CSF的诊断价值作了更新,强烈建议下列情况下进行CSF检查:临床和MRI证据不足以支持MS的诊断,尤其是考虑开始治疗时;发病症状不典型,包括进展性病程(PPMS);临床、影像学和实验室检查不符合典型的MS;MS少见人群(如儿童、老年人和非白种人)。亚洲国家(包括中国)MS患者CSF寡克隆区带阳性率低于白种人,其在亚洲MS中的诊断价值仍有待更多研究证实。
2.2.2儿童MS:儿童MS中95%为RRMS,80%与成人MS特点相似,其MRI相关空间多发、时间多发标准同样适用;但约15%~20%的儿童MS,尤其是小于11岁的患儿,疾病首次发作类似于急性脑病或急性播散性脑脊髓炎(acute disseminated encephalomyelitis,ADEM)过程,所有MS患儿中约10%~15%可有长节段脊髓炎的表现,推荐对患儿进行动态MRI随访,当观察到新的、非ADEM样发作方可诊断MS[8]。髓鞘少突胶质细胞糖蛋白(MOG)抗体在儿童MS检出率高于成人MS。
2.2.3临床孤立综合征(clinical isolated syndrome,CIS):CIS系指由单次发作的CNS炎性脱髓鞘事件组成的临床综合征。临床上既可表现为孤立的视神经炎、脑干脑炎、脊髓炎或某个解剖部位受累后导致的临床事件,亦可出现多部位同时受累的复合临床表现。其常见的临床表现有视力下降、肢体麻木、肢体无力、尿便障碍等;病变表现为时间上的孤立,并且临床症状持续24 h以上[9]。神经系统查体、影像(MRI或视觉相干断层成像)或神经生理学检查(视觉诱发电位)所示应与CIS的解剖位置相对应。临床应当谨慎将仅有患者主观改变的症状作为当前或以前的疾病发作证据。一半以上的欧美CIS患者最终发展为MS。CIS的临床表现与预后密切相关,预后良好者多表现为:仅有感觉症状,临床症状完全缓解,5年后仍没有活动障碍,MRI表现正常。预后较差者往往表现为:多病变,运动系统受累,不完全缓解,有大病变者[10-15]。

表2 需与MS鉴别的疾病
注:MS:多发性硬化;NMOSD:视神经脊髓炎谱系疾病;ADEM:急性播散性脑脊髓炎
2.3.4放射学孤立综合征(RIS):患者无神经系统表现或其他明确解释,MRI中出现强烈提示MS的表现时,可考虑为RIS。目前多数专家认为,需要临床受累才能诊断MS,而一旦发生典型RIS,既往时间和空间多发性的MRI证据即能够支持MS的诊断。大约1/3 RIS患者发病后5年内能够诊断MS,通常为RRMS[7]。
3 鉴别诊断
对于早期的MS,尤其应注意与其他临床及影像上同样具有时间多发和空间多发特点的疾病进行鉴别(表2),尽可能完善实验室及其他相关辅助检查,如AQP4抗体、其他自身免疫相关抗体筛查,排除其他疾病可能,切忌仅凭脑室周围多发长T2信号就片面做出MS诊断。
4 MS的治疗
对于MS应该在遵循循证医学证据的基础上,结合患者的经济条件和意愿,进行早期、合理治疗。MS的治疗分为:(1)急性期治疗;(2)缓解期治疗:即疾病修正治疗(disease modifying therapy,DMT);(3)对症治疗;(4)康复治疗。本文中研究证据及治疗推荐分级,均参考美国神经病学会针对免疫修正治疗中的分级[16]。
4.1急性期治疗
4.1.1治疗目标:MS的急性期治疗以减轻恶化期症状、缩短病程、改善残疾程度和防治并发症为主要目标。
4.1.2适应证:并非所有复发均需处理。有客观神经缺损证据的功能残疾症状,如视力下降、运动障碍和小脑/脑干症状等方需治疗。轻微感觉症状无需治疗,一般休息或对症处理后即可缓解[17]。
4.1.3主要药物及用法:(1)糖皮质激素(以下简称“激素”):一线治疗。①研究和推荐级别:几项研究证实,激素治疗期内能促进急性发病的MS患者神经功能恢复(Ⅰ级推荐),但延长激素用药时间对神经功能恢复无长期获益(Ⅱ级推荐)[18]。②治疗原则:大剂量,短疗程。③推荐用药方法:大剂量甲泼尼龙冲击治疗(A级证据,Ⅰ级推荐)[18],具体用法如下:a.成人从1 g/d开始,静脉滴注3~4 h,共3~5 d,如临床神经功能缺损明显恢复可直接停用。如临床神经功能缺损恢复不明显,可改为口服醋酸泼尼松或泼尼松龙60~80 mg,1次/d,每2 d减5~10 mg,直至减停,原则上总疗程不超过3~4周。若在减量的过程中病情明确再次加重或出现新的体征和(或)出现新的MRI病变,可再次给予甲泼尼龙冲击治疗或改用二线治疗。b.儿童按体质量20~30 mg/(kg·d),静脉滴注3~4 h,1次/ d,共5 d,症状完全缓解者,可直接停用,否则可继续给予口服醋酸泼尼松或泼尼松龙,1 mg/(kg·d),每2 d减5 mg,直至停用[19]。口服激素减量过程中,若出现新发症状,可再次甲泼尼龙冲击治疗或给予1个疗程静脉大剂量免疫球蛋白治疗(IVIG)[20]。激素治疗的常见不良反应包括电解质紊乱,血糖、血压、血脂异常,上消化道出血,骨质疏松,股骨头坏死等。(2)血浆置换:二线治疗。急性重症或对激素治疗无效者可于起病2~3周内应用5~7 d的血浆置换(D级证据,Ⅲ级推荐)[18]。(3)IVIG:缺乏有效证据,仅作为一种备选治疗手段,用于妊娠或哺乳期妇女不能应用激素治疗的成人患者或对激素治疗无效的儿童患者[20]。推荐用法为:静脉滴注0.4 g/(kg·d),连续用5 d为1个疗程,5 d后,如果无效,则不建议患者继续使用,如果有效但疗效不是特别满意,则可继续每周用1 d,连用3~4周[21]。
4.1.4注意鉴别假复发:假复发是指在感染或其他导致体温升高的状态、压力或疲劳下出现神经系统异常症状,但查体无新体征、影像学检查无客观病灶的现象。典型假复发症状一般持续<24 h,但个别情况下(如感染未控制、持续处于高温状态、长时间压力较大和长期睡眠剥夺等),也可持续超过24 h。治疗上除消除引起假复发的诱因外,无须其他治疗。
4.2缓解期治疗
4.2.1治疗目标:MS为终身性疾病,其缓解期治疗以控制疾病进展为主要目标,推荐使用DMT治疗。
4.2.2主要药物及用法:国际上现已经批准上市的DMT药物共有13种(表3)。目前中国食品药品监督管理局已经批准国内上市的DMT药物有口服特立氟胺(teriflunomide)和注射用重组人β-1b干扰素。
(1)特立氟胺:为DMT中的一线口服治疗药物。全球多中心TOWER研究(入选1169例复发型MS,其中包括1138例RRMS和9例有复发的SPMS患者,A级证据)显示,与安慰剂相比,特立氟胺7 mg/d和14 mg/d均可有效降低RRMS和有复发的SPMS患者的年复发率(22.3%和36.3%),14 mg/d治疗组还可有效延迟持续12周残疾进展的发生时间[22]。中国32家医院参与了TOWER研究,共入组148例RRMS患者,与安慰剂相比,特立氟胺14 mg/d显著降低中国RRMS患者年复发率71.2%,而7 mg/d治疗组未能有效降低年复发率,14 mg/d治疗组还延迟了持续12周残疾进展的发生时间,风险率相对降低68.1%,与总体人群分析结果的趋势一致[23]。TOPIC研究(A级证据)显示,与安慰剂相比,特立氟胺7 mg/d和14 mg/d均可有效降低CIS患者进入临床确诊的MS(CDMS)的风险,降低复发或新发MRI病灶的风险[24]。
1)推荐意见:已确诊的复发型MS患者(RRMS和有复发的SPMS患者)可给予特立氟胺治疗。2)治疗原则:早期、长期。3)推荐用法:中国患者推荐14 mg,口服,1次/d。4)常见不良反应及处理:常见不良反应为腹泻、呕吐、头发稀疏、丙氨酸氨基转移酶(ALT)水平升高[22-24]。腹泻和呕吐可适当给予对症处理。重度肝损伤患者不应给予特立氟胺治疗。开始治疗前,应检测患者ALT
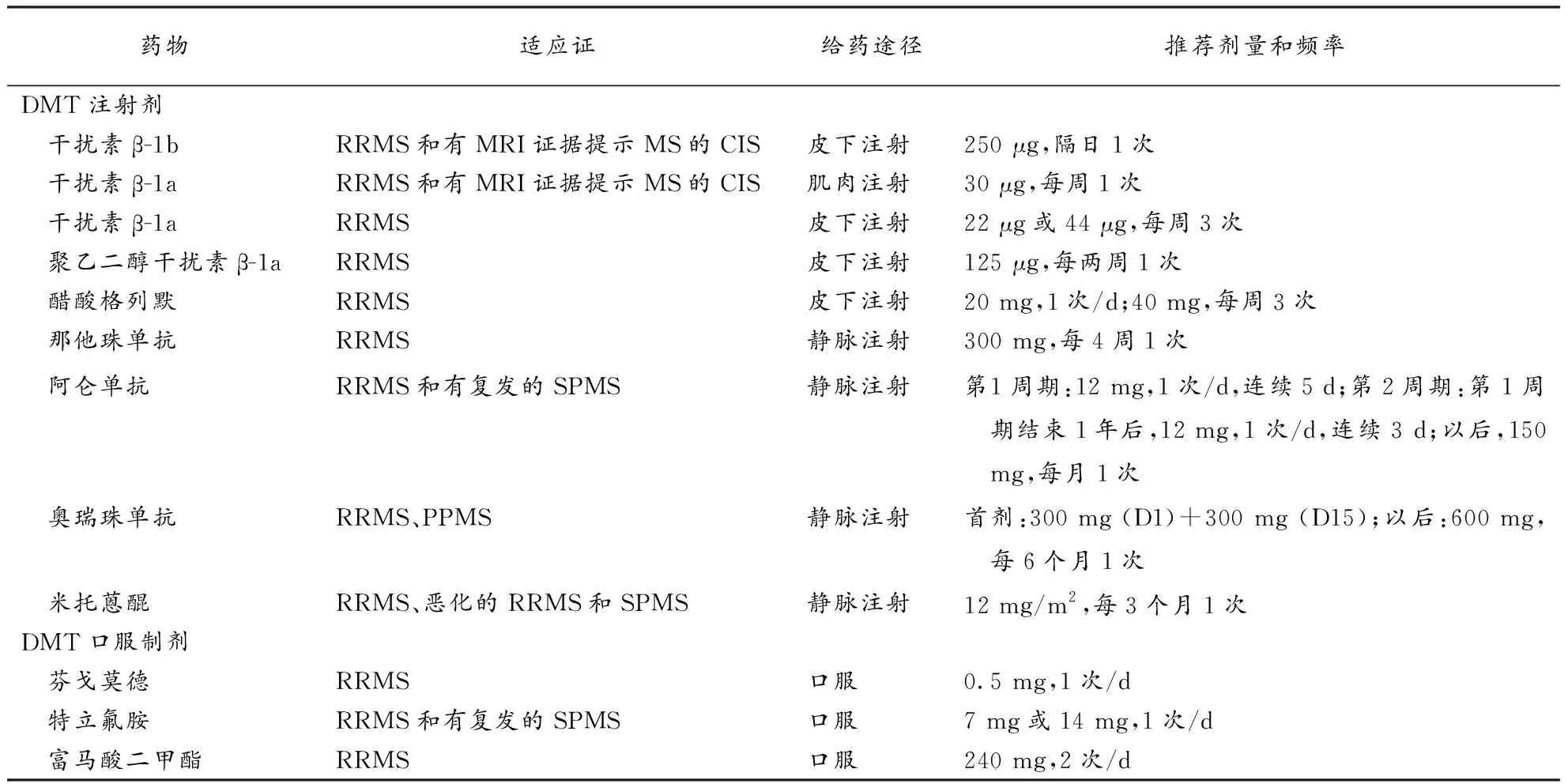
表3 国际上已批准上市的用于MS的DMT药物
注:MS:多发性硬化;DMT:疾病修正治疗;RRMS:复发进展型MS;PPMS:原发进展型MS;SPMS:继发进展型MS;CIS:临床孤立综合征和胆红素水平,开始治疗后,应每月监测ALT水平,至少持续6个月。因特立氟胺具有潜在致畸性,因此,妊娠或正在计划妊娠患者禁用特立氟胺。特立氟胺可以通过药物加速消除程序,在11 d内达到风险最小的血药浓度(0.02 mg/L)[24]。开始用药前,育龄女性应行妊娠试验,阴性者方可开始用药。开始治疗后,发现妊娠的患者或者计划妊娠的女性和男性患者应停用特立氟胺,并连续11 d采用考来烯胺或活性炭粉治疗,以加速药物清除,血清特立氟胺浓度<0.02 mg/L之前应避免妊娠[24]。
(2)注射用重组人β-1b干扰素:为DMT中的一线治疗药物。BENEFIT研究(A级证据)证实,与安慰剂相比,注射用重组人β-1b干扰素可有效降低CIS患者进入CDMS的比例(28% 和45%,HR=0.5,95%CI:0.36~0.70),显著减少MRI T2活动病灶数目和T2病灶容积[26]。关键研究(A级证据)显示,与安慰剂相比,注射用重组人β-1b干扰素可有效降低RRMS患者年复发率34%,显著减少新增T2病灶数目83%和T2病灶容积17.3%,并有延缓残疾进展〔以扩充残疾功能量表(EDSS)评分评价〕的趋势[26-29]。两项有关SPMS的研究均发现,与安慰剂相比,注射用重组人β-1b干扰素可显著降低患者的年复发率、MRI新增T2病灶数目和T2病灶容积,但在延缓残疾进展方面,结论不一[30-31]。来自欧洲的研究显示注射用重组人β-1b干扰素可有效减少肯定1分EDSS进展的患者比例和延缓患者进入坐轮椅的时间,但来自北美的研究却未能证实该药可有效延缓患者残疾进展的时间[30-31]。此外,一项来自国内的多中心回顾性研究显示,注射用重组人β-1b干扰素可减少中国CIS和RRMS患者临床复发和MRI病灶活动,改善RRMS患者残疾程度[32]。
1)推荐意见:①有可能发展为MS的高危CIS(不满足MS诊断标准但MRI病灶高度提示MS)或已确诊的RRMS或仍有复发的SPMS患者可给予注射用重组人β-1b干扰素治疗(Ⅰ级推荐)。②注射用重组人β1b干扰素对临床无复发的SPMS患者的疗效不清(Ⅳ级推荐)[33]。2)治疗原则:早期、序贯、长期。推荐用法:推荐剂量为250 μg,皮下注射,隔日1次。起始剂量为62.5 μg,皮下注射,隔日1次,以后每注射2次后,增加62.5 μg,直至推荐剂量。3)常见不良反应及处理:①注射部位反应:常见,严重者甚至可引起注射局部坏死。注射前30 min将药物从冰箱取出、用药前后冰敷、变更注射部位、注射部位皮肤避免直接日照和加强无菌注射技术等可有效改善注射部位反应。②流感样症状:常见于首次注射或增加剂量时。随着注射时间的延长,流感样症状可逐渐减轻直至完全消失。应从小剂量开始、睡前给药和适当应用解热镇痛类药物(如对乙酰氨基酚、布洛芬等)可改善流感样症状。应注意避免常规使用对乙酰氨基酚,因其可能增加注射用重组人β1b干扰素相关肝功异常的发生。③无症状肝功能异常:多为一过性,减量或停药后可恢复正常。应注意定期监测肝功能。④其他:部分患者还可出现白细胞减少和甲状腺功能异常,应注意定期监测血常规和甲状腺功能,推荐开始用药的前6个月每月进行检查。
(3)阿仑珠单抗(Alemtuzumab):在RRMS患者中评价阿仑珠单抗12 mg/d的2项研究(CARE-MS 1和CARE-MS 2,A级证据)中,证明了阿仑珠单抗的疗效。两项研究均为为期2年的随机化、开放性、评定者设盲、活性对照药(44 μg 每周3次皮下给予干扰素β-1a)对照研究。与干扰素β-1a 44 μg治疗组相比,阿仑珠单抗治疗组年复发率相对降低54.9%(CARE-MS 1,P<0.0001)及49.4%(CARE-MS 2,P<0.0001),第2年时发生残疾进展的患者相对风险降低42%(CARE-MS 2,P=0.0084)及30%(CARE-MS 1,P=0.22)[32]。
1)推荐意见:已确诊的复发型MS患者(RRMS和有复发的SPMS患者)可给予阿仑珠单抗治疗。2)推荐用法:12 mg/d,静脉输注,持续2个疗程。首个疗程:12 mg/d,连续5 d(总剂量60 mg)。第二疗程:首个疗程12个月后,给予12 mg/d,连续3 d(总剂量36 mg)。3)主要不良反应及处理:主要不良反应为输液反应、感染和自身免疫性疾病。为了监测潜在严重不良作用的早期体征,在治疗基线时和末次治疗后48个月进行下述定期实验室检查:①全血细胞计数(CBC)及其分类计数(治疗开始前和随后每月1次)。②血清肌酐水平(治疗开始前和随后每月1次)。③尿液分析与尿细胞计数(治疗开始前和随后每月1次)。④甲状腺功能检查,如促甲状腺激素(TSH)水平测定(治疗开始前和随后每3个月1次)。⑤进行基线和每年1次的皮肤检查,以监测黑素瘤。
(4)米托蒽醌(mitoxantrone):第一个被FDA批准用于治疗MS的免疫抑制剂。
1)推荐意见:几项研究证实,米托蒽醌治疗可以减少RRMS患者的复发率(Ⅱ级推荐);延缓RRMS、SPMS和PRMS患者的疾病进展(Ⅲ级推荐),但由于其严重的心脏毒性和白血病等不良反应,建议用于快速进展、其他治疗无效的患者(Ⅱ级推荐)[34-38]。2)推荐用法:8~12 mg/m2,静脉注射,每3个月1次,终身总累积剂量限制在104 mg/m2以下,疗程不宜超过2年。3)主要不良反应及处理:主要不良反应为心脏毒性和白血病,2010年一项系统性综述显示应用米托蒽醌治疗,心脏收缩功能障碍、心力衰竭和急性白血病的发生风险分别为12.0%、0.4%和0.8%[39]。使用时应注意监测其心脏毒性,每次注射前应检测左室射血分数(LVEF),若LVEF<50%或较前显著下降,应停用米托蒽醌。此外,因米托蒽醌的心脏毒性有迟发效应,整个疗程结束后,也应定期监测LVEF。
4.2.3治疗策略[32]:(1)DMT应在能给患者提供随访、评估、监测药物不良反应及毒性作用和及时妥善处理治疗中问题的临床机构开展。(2)对于不满足MS诊断标准但MRI病灶高度提示MS的CIS患者给予注射用重组人β1-b干扰素治疗。(3)活动性RRMS患者(复发或MRI检查发现强化病灶、新发T2病灶或原T2病灶容积增大)应尽早开始DMT。(4)对于仍有复发的SPMS患者,在充分沟通药物疗效的不确定性、安全性和耐受性后可给予注射用重组人β-1b干扰素或米托蒽醌治疗。
4.2.4治疗评价:患者在接受正规DMT过程中,疾病出现频繁复发或病情恶化(>3 次/年),EDSS评分在1年内增加1分以上或颅内活动病变数量较前明显增加,界定为治疗无效或失败[41]。评价治疗失败的最短治疗时间为6~12个月。
4.2.5妊娠期和哺乳期治疗:对于MS患者,因妊娠期有雌激素的保护作用,故不反对患者妊娠,但应向患者明确告知除醋酸格列默外,任何DMT药物均不建议在妊娠期应用。对于计划妊娠但复发风险较高患者,可使用醋酸格列默或干扰素至确认妊娠前;对于计划妊娠但复发风险非常高的患者,可考虑整个妊娠期间应用醋酸格列默或干扰素(弱推荐)治疗[32]。对于病情持续高度活跃的患者,建议延迟妊娠;坚持妊娠或计划外妊娠患者,在充分讨论潜在风险后,可考虑整个孕期使用那他珠单抗;若能在末次输液至分娩4个月定期严格随访的患者,阿伦珠单抗亦可作为计划妊娠而病情高度活跃患者的替代治疗。哺乳期患者,由于其没有了雌激素的保护,有可能进入疾病较为活跃阶段,不建议人工哺乳,且产后应尽早开始DMT治疗,以预防复发。
4.3对症治疗
4.3.1痛性痉挛:可应用卡马西平、 替扎尼定、加巴喷汀、巴氯芬等药物治疗。
4.3.2慢性疼痛、感觉异常等:可用阿米替林、普瑞巴林、选择性5-羟色胺及去甲肾上腺素再摄取抑制剂(SNRI)及去甲肾上腺素能与特异性5-羟色胺能抗抑郁药物(NaSSA)类药物治疗。
4.3.3抑郁、焦虑:可应用选择性5-羟色胺再摄取抑制剂、SNRI、NaSSA类药物以及心理辅导治疗。
4.3.4乏力、疲劳(MS患者较明显的症状):可用莫达非尼、金刚烷胺治疗。
4.3.5震颤:可应用盐酸苯海索、盐酸阿罗洛尔等药物治疗。
4.3.6膀胱直肠功能障碍:配合药物治疗或借助导尿等处理。
4.3.7性功能障碍:可应用改善性功能药物等治疗。
4.3.8认知障碍:可应用胆碱酯酶抑制剂等治疗。
4.4康复治疗及生活指导MS的康复治疗同样重要。对伴有肢体、语言、吞咽等功能障碍的患者,应早期在专业医生的指导下进行相应的功能康复训练。在对疾病的认识上,医务工作者应耐心对患者及亲属进行宣教指导,强调早期干预、早期治疗的必要性,合理交代病情及预后,增加患者治疗疾病的信心,提高治疗的依从性。医务工作者还应在遗传、婚姻、妊娠、饮食、心理及用药等生活的各个方面提供合理建议,包括避免预防接种,避免过热的热水澡、强烈阳光下高温暴晒,保持心情愉快,不吸烟,作息规律,适量运动,补充维生素D等。
执笔邱伟、徐雁
参与讨论人员(按姓氏笔画顺序排序)
卜碧涛、王丽华、王佳伟、王津存、王维治、王满侠、方树友、龙友明、成江、刘广志、刘卫彬、刘洪波、安中平、许贤豪、杜彦辉、李宏增、李泽宇、李明利、李春阳、李柱一、李海峰、肖保国、吴卫平、吴晓牧、汪鸿浩、沈帆霞、初曙光、张华、张旭、张星虎、张美妮、张晓君、陈少琼、陈向军、金涛、周文斌、周红雨、郑雪平、郑维红、赵玉武、胡学强、段瑞生、施福东、秦新月、莫雪安、高枫、高聪、郭力、唐玉兰、黄德晖、戚晓昆、董会卿、程琦、楚兰、管阳太、檀国军、魏东宁
