重症肌无力患者血清铁水平与AChR-Ab、IL-6的关系
2018-12-21黄攀徐敏何晓英
黄攀 徐敏 何晓英
重症肌无力(myasthenia gravis,MG)是一种神经-肌肉接头传递功能障碍性疾病,主要表现为部分或全身骨骼肌无力和易疲劳,于活动后症状加重,经休息后症状减轻[1]。目前该病的患病率为(77~150)/100万,男女发病比例为2︰3左右[2]。目前对于MG的发病机制尚未完全明确,但MG是一种以B淋巴细胞为主要介导方式的自身免疫性疾病已得到公认。B细胞产生的多种细胞因子及抗体在MG的发病中具有重要作用,其中较为常见的便是乙酰胆碱受体抗体(AChR-Ab)、白细胞介素6(IL-6)。血清铁(serum iron,SI)是一种人体所需的微量元素,在体内主要参与血红蛋白的合成。近期研究显示,一些自身免疫性疾病如系统性红斑狼疮(SLE)、类风湿性关节炎(RA)的患者更容易出现SI水平下降[3],而有关于MG患者SI水平的变化情况及其与AChR-Ab、IL-6的关系尚无研究报道。因此,本研究拟通过分析MG患者外周SI的变化情况及其与 AChR-Ab、IL-6的关系,探讨SI在MG发病中的作用,为进一步阐明MG的发病机制提供依据。
1 对象和方法
1.1研究对象(1)MG组:选取2015-07—2018-03德阳市人民医院神经内科收治的MG患者76例,男31例、女45例,年龄22~62岁,平均(31.86±4.32)岁。纳入标准:①符合重症肌无力诊断和治疗的中国专家共识[1];②MG患者临床资料完整者;③经CT或MRI检查证实无脑梗死、脑出血疾病者;④神志清楚,能配本研究者;⑤患者本人或家属签署知情同意书;⑥未经补铁治疗。排除标准:①合并严重心、肝、肾、肺功能不全者;②合并严重内科系统疾病者;③合并恶性肿瘤;④不能配合者。Osserman分型Ⅰ型(眼肌型)15例,ⅡA型(轻度全身型)25例,ⅡB型(中度全身型)18例,Ⅲ型(急性重症型)12例,Ⅳ型(迟发重症型)6例。MG患者病情严重程度采用重症肌无力定量评分(QMSS)量表进行评定,该量表总分13分,得分越高则病情越严重。(2)健康对照组:选取健康体检者50名,其中男20名、女30名,年龄23~61岁,平均(32.12±4.28)岁。两组在年龄、性别方面匹配。
本研究经德阳市人民医院伦理委员会批准。所有研究对象或家属均签署知情同意书。
1.2方法血清样本的收集及检测:清晨抽取各纳入者外周静脉血5 mL,于室温下任其自然凝固15 min,其后3000 r/min的速度下离心10 min,离心后收集上层血清并储存在-80℃超低温冰箱中用于SI及血清IL-6、AChR-Ab水平的检测。SI的检测由德阳市人民医院检验科专业人员采用日立7600全自动生化仪进行比色法检测,试剂盒购于德国罗氏诊断有限公司,根据相关标准以SI<8.95 μmol/L作为SI缺乏的标准[6];IL-6采用酶联免疫吸附法检测,试剂盒购于武汉金开瑞生物工程有限公司;按照试剂盒说明书采用放射免疫法检测AChR-Ab的表达水平及阳性表达情况,试剂盒购于英国的RSR公司,对于血清AChR-Ab的浓度>0.5 nmol/L为视为AChR-Ab表达阳性。
根据SI的表达水平将两组患者分别分为SI缺乏组和SI对照组。比较SI缺乏与SI正常患者的血清中IL-6、ACh-Ab的阳性率及表达水平,并对SI水平与血清中IL-6、ACh-Ab水平进行相关分析。
1.3统计学处理采用SPSS17.0中文版进行分析。计量资料符合正态分布,以均数±标准差表示,组间比较使用t检验;计数资料采用百分比表示,比较采用χ2检验;相关性分析采用Spearman相关性分析方法。以P<0.05为差异有统计学意义。
2 结果
2.1两组患者中SI、AChR-Ab、IL-6水平比较具体见表1。MG组患者中SI缺乏56例(SI缺乏组),正常20例(SI正常组)。MG组患者SI缺乏率明显高于健康对照组(P<0.01),提示MG患者SI缺乏率高于健康人群。MG患者AChR-Ab阳性率及表达水平、IL-6水平均明显高于对照组(P<0.01)。
2.2MG组中不同SI表达水平患者外周血清中AChR-Ab及IL-6水平比较SI缺乏组AChR-Ab、IL-6表达水平均显著高于SI正常组(均P<0.01)。具体见表2。

表1 MG组与对照组外周血SI、AChR-Ab、IL-6水平比较
注:MG:重症肌无力:SI:血清铁;AChR-Ab:乙酰胆碱受体抗体;IL-6:白细胞介素6。表2同
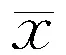
表2 MG组不同SI表达水平患者外周血清AChR-Ab、IL-6水平比较(±s)
2.3MG组患者SI水平与AChR-Ab、IL-6水平的相关性分析MG患者SI水平与AChR-Ab、IL-6水平均呈负相关(分别r=-0.776,r=-0.663,均P<0.01)。
3 讨论
MG是一种自身免疫性疾病,其发病机制为机体产生针对自身乙酰胆碱受体(AChR)的异常免疫应答反应破坏了机体的自我耐受,引起运动终板突触后膜上的AChR大量流失,进而导致神经-肌肉传递功能障碍[7]。MG中介导自身免疫反应主要方式有体液免疫和细胞免疫两种,而AChR-Ab和IL-6则是这两种途径中的代表性因子。研究显示,超过50%的眼肌型MG和85%的全身型MG患者外周血清中均存在AChR-Ab阳性表达[8]。IL-6是由Th2细胞分泌的一种细胞因子,它能激活静止的T细胞,并可进一步诱导活化的T细胞向终末分化的方向发展,导致AChR-Ab的分泌增加进而参与MG的致病[9-10],检测MG 患者外周血清中IL-6的水平可以在一定程度上评估MG病情严重程度及疗效[11]。在本研究中,MG患者外周血清中AChR-Ab及IL-6水平均明显高于健康对照组,这是因为MG患者免疫功能紊乱,T、B细胞大量被活化,使得AChR-Ab和IL-6大量产生[12],这也支持AChR-Ab、IL-6与MG的发病关系密切。
本研究中还发现,MG患者SI水平明显低于健康对照组(P<0.05)。MG患者往往合并咀嚼无力、吞咽困难等情况,此类患者经口进食量明显减少,长此以往导致机体微量元素铁的缺乏。同时,MG患者还可能因长期的疾病负担产生焦虑、抑郁等负面情绪,进而引起患者食欲下降,微量元素的摄入减少[13]。此外,MG患者还常合并肺部感染、使用糖皮质激素及免疫制剂等,这些均可以引起SI吸收和利用障碍[14]。
近年来,有研究显示在SLE、类风湿性关节炎(RA)等免疫性疾病患者中更容易出现SI缺乏,本研究中MG患者外周血清中SI缺乏阳性率亦明显高于健康对照组。而且,本研究中MG患者外周血清中SI水平与血清AChR-Ab及IL-6水平均呈负相关关系,提示MG患者SI通过抗体或细胞因子发挥着免疫调节作用。推测其可能机制如下:(1)微量元素铁具有调节免疫功能的作用,长期缺铁可能引起免疫调节功能及免疫监视功能的下降,导致自身抗体或者活化补体的产生进而诱导自身免疫性疾病[15];(2)铁元素是微生物生长繁殖不可或缺的微量元素,铁缺乏患者更容易诱发感染倾向,导致机体产生更多的炎性细胞因子如IL-6、IL-4、干扰素-γ(IFN-γ)等,而这些炎性细胞因子可通过前述的免疫途径加重MG的病情[16-17]。反之,MG病情加重又可因进食、激素的使用而进一步造成SI的缺乏,导致恶性循环的形成。
综上所述,MG患者外周血清中SI表达水平降低,且SI水平与AChR-Ab、IL-6均呈负相关关系,但有关于MG的发病与SI缺乏存在何种关系尚不明确,仍需进一步研究探讨。
