两种支撑体在多节段脊髓型颈椎病前路手术重建中的比较研究*
2018-12-20宋海涛高卫良吴玉泉曲绍政刘彦斌盛文博
宋海涛,张 伟,李 民,高卫良,吴玉泉,曲绍政,刘彦斌,盛文博
颈椎前路椎体次全切除减压、椎间植骨融合术(anterior cervical corpectomy and fusion,ACCF)治疗脊髓型颈椎病 (cervical spondylotic myelopathy,CSM)是目前公认的“金标准”[1],用于重建颈椎前柱的材料早期有自体髂骨、腓骨、同种异体骨,目前临床多用各种设计形状的钛网,但均存在一定的不足[2,3]。 纳米羟基磷灰石/聚酰胺 66(nano-hydroxyapatite/polyamide-66,n-HA/PA66)是一种由四川国纳科技有限公司研制的复合材料 (国食药监械(准)字2005第3460204号),其形态结构及弹性模量与人体皮质骨相近,且具有良好的骨传导性[4]。笔者从2014年1月—2017年10月应用钛笼和n-HA/PA66支撑体作为重建材料治疗多节段脊髓型颈椎病84例,比较两种重建材料在ACCF手术中的临床疗效,为临床选择合适的重建材料提供理论依据。
1 资料与方法
1.1 一般资料 2014年1月—2017年10月在笔者所在医院行ACCF治疗的多节段脊髓型颈椎病(multiple segmental cervical spondylotic myelopathy,MSCSM)患者 84 例。纳入标准:(1)存在 MSCSM的典型临床表现及体征;(2)正规保守治疗3个月无效;(3)患者一般资料完整。排除标准:(1)单纯椎间盘突出患者;(2)连续型后纵韧带骨化患者;(3)骨折及肿瘤患者。根据患者所采用重建材料的不同分为A组(钛网组,43例)和B组(n-HA/PA66组,41例)。该次研究经医院伦理委员会审查并批准实施。两组患者的性别、年龄、病程、病变节段、是否有并发症等一般资料比较均无统计学差异 (P>0.05),具有可比性。见表1。
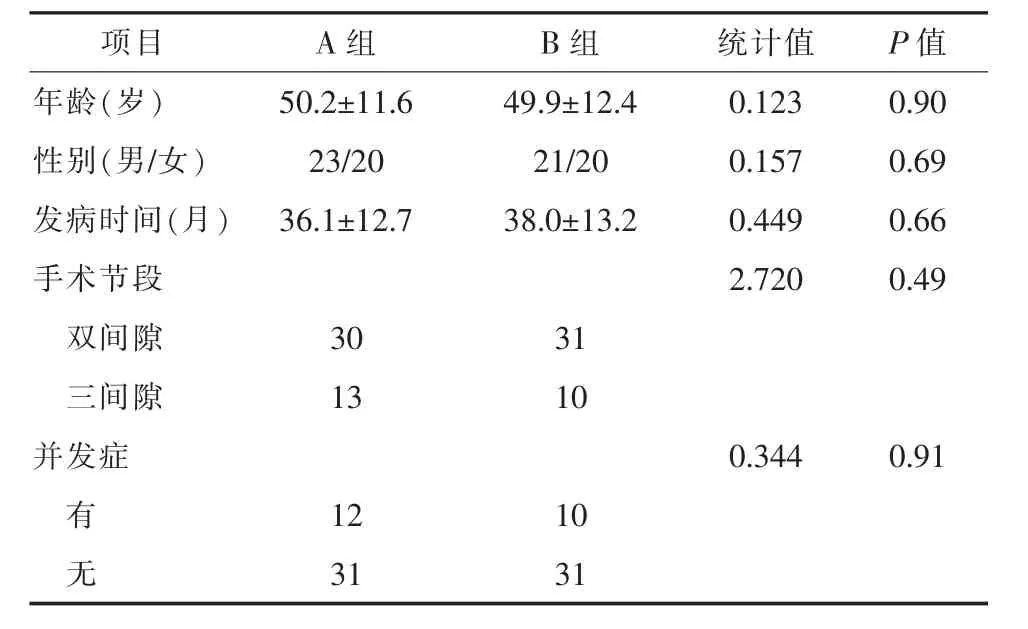
表1 两组患者一般情况比较
1.2 手术方法 全麻仰卧位,作右侧颈前部横行皮肤切口3~4 cm,沿血管鞘和内脏鞘之间分离达椎体前方,次全切除椎体及两端椎间盘(切除椎体制备骨粒备用),注意保护终板完整性,椎体开槽宽度14~16 mm,减压完成后测量减压槽长度。A组选用修剪后填充自体骨粒的钛笼(直径14 mm,康辉医疗器械有限公司)植入骨槽内,B组选用外径14 mm、合适长度的n-HA/PA66笼状支撑体,并在管腔内填充自体骨粒(图1)。钛板、螺钉(史赛克,美国)将融合节段的上下端椎体固定。

图1 n-HA/PA66支撑体
1.3 术后处理及效果观察 患者术后3 d带颈托下床活动,颈托固定3个月。术后1个月、3个月、6个月、1年时随访,拍摄颈椎正侧位片、CT。比较两组手术时间及出血量。脊髓神经功能评估采用JOA评分,颈部疼痛改善情况用VAS评分,测定颈椎矢状位节段角[5]评估颈椎生理曲度改善,植骨融合采用 Pitizen’s 标准[6]。
1.4 统计学方法 应用 SPSS 22.0进行数据统计分析,计量资料用(x±s)表示,组内比较用配对样本t检验,组间比较使用独立样本t检验,分类变量(性别、手术节段)、计数资料(椎间融合率)采用χ2检验。P≤0.05为差异有统计学意义。
2 结果
2.1 一般情况 A组手术时间 (80.15±9.31)min,术中出血量 (190.52±11.05) ml,B 组手术时间(64.19±8.51) min,术中出血量为(160.18±9.25) ml,手术时间及出血量A均高于B组(P<0.05)。两组患者均获得随访,随访时间9~18个月。
2.2 临床疗效 患者术后1个月、术后3个月、术后6个月及末次随访,两组JOA评分均高于术前(P<0.05),VAS 评分均较术前明显降低(P<0.05);两组术前JOA评分、VAS评分及术后6个月前JOA评分、VAS 评分无明显差异(P>0.05),末次随访时B组术后JOA评分高于A组、VAS评分低于A组(P<0.05,表2)。两组术后病变节段前凸角改善明显,两组间术前及术后早期差异不明显,但6个月后A组改善差于B组(表3)。
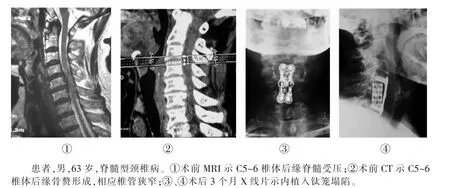
图2 钛笼组1例患者手术前后影像资料
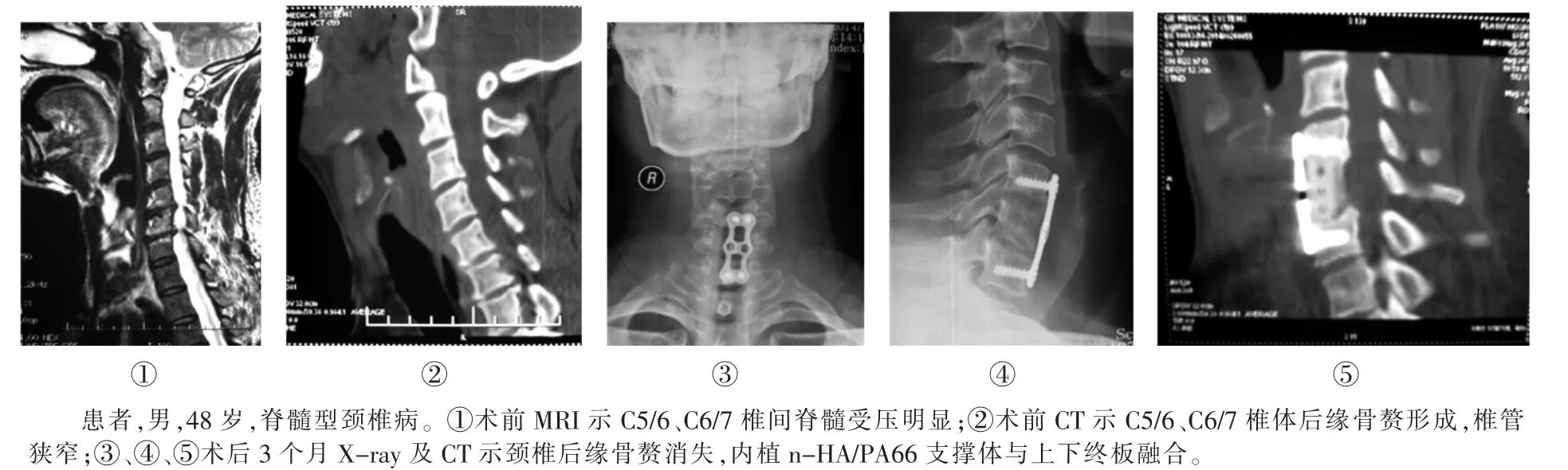
图3 n-HA/PA66支撑体组1例患者手术前后影像资料
表2 两组患者不同时间点JOA评分及VAS评分

表2 两组患者不同时间点JOA评分及VAS评分
注:与同组术前相比,*P<0.05;与 A 组比较,△P<0.05。
?
表3 两组患者病变节段矢状位节段角变化

表3 两组患者病变节段矢状位节段角变化
注:与同组术前相比,*P<0.05;与 A组比较,△P>0.05,#P<0.05。
?
3 讨论
3.1 颈前路减压重建术在MSCSM中应用MSCSM由于病变节段多、存在椎体后缘骨赘、脊髓受压重,临床表现更加严重、病情发展极快,手术是首选治疗方式,目的在于迅速解除脊髓压迫、保留并促进脊髓功能恢复、保持颈椎稳定性,手术可分为前路、后路及前后联合手术[2,7]。该研究 84 例患者均确诊为MSCSM,影像学提示脊髓压迫主要来源于前方,故采用前路手术能更有效解除脊髓压迫。颈椎前路减压后重建是保证手术成功的关键步骤之一,颈椎重建方法最早期主要应用自体腓骨、髂骨,存在植骨块骨折或吸收,供体区域损伤、延长住院时间等;同种异体骨来源受限,容易诱发宿主产生免疫排异反应,融合率低,同时有可能导致交叉感染等使应用受到限制[3,8]。近十多年来,各种形状、规格的钛笼应用大大方便了颈椎的结构重建,不但简化了手术操作,而且避免了供区损伤,但其主要缺陷有:易产生应力遮挡、下沉、塌陷等并发症,延迟了椎体的融合,导致前柱高度丢失,不能透过X线、不利于观察植骨的融合情况[9]。
3.2 n-HA/PA66人工椎体支撑体的生物力学活性及机械特点 n-HA/PA66复合生物材料,由纳米级羟基磷灰石和聚酰胺按一定比例聚合形成复合物,具有良好的生物相容性和生物活性,与机体组织有较强的亲和力,不但能起到钙盐沉积的支架作用,而且还能诱导新骨的形成;聚酰胺具有与骨胶原相类似的结构,与人体组织有良好的相容性,且具有较高的韧性和强度[4,10]。该复合材料的力学性能,包括抗压、抗弯强度和弹性模量与人体皮质骨类似,分散了接触面的应力分布,能够有效减少下沉发生率,同时纳米人工骨具有良好的生物活性,提高融合率,保证融合节段的长期稳定性[11,12]。颈椎n-HA/PA66椎体支撑体设计为中空圆柱状,管壁厚度2.5 mm、外径为10~14 mm,与椎体终板为面面结合(环状接触面、与钛笼的点接触不同),能有效减少支撑面塌陷[12]。支撑体上、下端预制齿状突起,增加在终板界面的摩擦、避免移位,结合钛板固定减少支撑体移位、脱出;支撑体下端面成7°角,与颈椎骨性结构解剖学平面保持一致,植入方便,并与颈椎力线重合,便于恢复颈椎的生理前凸。同时因其具有透射X线的特性,在随访过程中便于观察植骨的融合情况,上下端钛丝标志线便于观察支撑体位置变化,在临床应用中有独特的优点[13]。
3.3 两种重建方法治疗MSCSM的疗效比较 该研究中两组手术均取得较好效果,其中手术时间及出血量钛笼组均高于n-HA/PA66组,分析与术中钛笼的修剪制备花费过多时间,而n-HA/PA66支撑体则有多个长度规格,间隔1 mm,便于术中选择,有效节约时间。Zhang等[14]报告应用钛网和n-HA/PA66进行ACCF手术治疗CSM患者117例,随访25~70个月,结果显示,末次随访时单椎体切除术后钛网组下沉比例为24%,明显高于n-HA/PA66组的4%,在双椎体切除术后则为38%和5%,认为n-HA/PA66相对于钛网,能够更好地维护融合节段高度,降低支撑体下沉,在ACCF手术中能更好地替代钛网进行颈椎重建。Yang等[4]报告应用n-HA/PA66笼状支撑体重建胸腰椎爆裂骨折51例,随访时间超过2年,融合率达到90.2%,融合时间5.6个月,后凸矫正11.8°±7.1°,末次随访时角度丢失1.9°±2.1°,认为n-HA/PA66支撑体笼具有较高的融合率和较低的下沉率,是胸腰椎切除术后重建的理想材料。该研究结果表明,两种重建支撑体在ACCF术中均能提供颈椎的即刻稳定、保持减压效果,n-HA/PA66组术后3个月实现椎间融合、无塌陷,钛笼组部分存在塌陷、移位、不融合,导致颈椎前凸角丢失、甚至节段性后凸,导致颈部不适症状发生。
