藤椒冷榨油饼粕中多酚的纯化及体外抗氧化活性
2018-12-20徐丹萍王春霞付本宁蔡沁玥文秋萍
徐丹萍,蒲 彪 ,叶 萌,王春霞,付本宁,蔡沁玥,文秋萍
(1. 四川农业大学 食品学院,四川雅安 625014;2. 四川农业大学 林学院,成都 611130)
花椒是芸香科(Rutaceae)花椒属(ZanthoxylumL.)植物。花椒古称椒、秦椒、大椒、椒聊、凤椒、丹椒等,是中国原产的一种具有浓郁辛香的落叶灌木或小乔木树种,常作为调味品、香料、入药、木本油料[1]。藤椒学名叫竹叶花椒(Zanthoxylumarmatum),是青花椒的一种,在中国辽宁以南、五岭以北大多数省区均有栽培[2]。藤椒果皮榨油的方法主要有有机溶剂浸提法、传统机械压榨法,这2种方法均会对营养物质造成一定破坏,限制油脂的品质。冷榨制油技术是在室温至65 ℃温度下经榨油机压榨获得油脂和饼粕的方法,获得的油脂品质好、纯度高、得率大、营养成分丰富,相对于传统方法具有自己独特的优势[3]。冷榨法得到的饼粕中同样含有蛋白质、油脂、多糖、矿质元素、抗氧化生物活性物质等多种营养成分,可用作食品添加剂[4];在工业上可用于制造生物柴油、润滑油、涂料、增塑剂等[5-6]。目前,国内冷榨油饼粕主要用于动物饲料或作物肥料,其营养价值未被充分开发利用,造成极大的浪费。多酚类化合物是植物次级代谢产物之一,具有多种生理活性,素有“第七营养素”之称,具有抑菌、抗突变、抗肿瘤、抗病毒、降血糖降血脂、防辐射、清除自由基及抗衰老等作用,是重要的生物活性成分[7-8]。本研究主要对藤椒果皮冷榨油饼粕中的多酚类物质进行提取和纯化,并优化提取和纯化条件,检测提取物的抗氧化活性,为花椒资源的有效利用和冷榨油饼粕的进一步开发提供一定数据支持。
1 材料与方法
1.1 材料与试剂
藤椒(Zanthoxylumarmatum)干果皮(以下简称藤椒)及藤椒冷榨油饼粕(以下简称饼粕)由洪雅幺麻子藤椒油食品有限公司提供。
没食子酸、无水乙醇、碳酸钠、铁氰化钾、三氯乙酸、三氯化铁、邻苯三酚、石油醚(沸程40~60 ℃)等均为分析纯,成都市科龙化工试剂厂。
1,1-二苯基-2-三硝基苯肼(DPPH)、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)、2,6-二叔丁基-4-甲基苯酚(BHT),纯度≥98.00%美国Sigma 公司;树脂HPD600、AB-8、D-101河北沧州宝恩吸附材料科技有限公司。
1.2 仪器与设备
微波科学实验炉ORW08S-3H,南京澳润微波科技有限公司;台式真空干燥箱DZF-6050-T,上海丙林电子科技有限公司;离心机Thermo MULTIFUGE X3,美国Thermo公司;旋转蒸发器RE 52-99,上海亚荣生化仪器厂;全波长酶标仪Varioskan flash,美国Thermo公司;16 mm×200 mm层析柱,成都麦德生科技有限公司;电子天平CP225D,德国Sartorius股份公司;自动部分收集器BSZ-100,上海沪西分析仪器厂有限公司;气浴恒温振荡器ZD-85,金坛市科析仪器有限公司;紫外-可见分光光度计UV-3100型,上海美普达仪器有限公司;超声波清洗器AS10200A,天津奥特赛恩斯仪器有限公司。
1.3 方 法
1.3.1 多酚得率测定 按照福林酚法测定多酚质量浓度[9]。用乙醇将没食子酸标准储备液配制成0.01、0.02、0.04、0.06、0.08、0.10 mg/mL系列梯度的没食子酸工作液,吸取不同质量浓度的没食子酸工作液1.00 mL分别与5.00 mL福林酚试剂混合,摇匀,反应5 min,加入4.00 mLω=7.50%的Na2CO3溶液,室温反应60 min。测定混合液在765 nm下吸光度值。以没食子酸质量浓度为横坐标,吸光度值为纵坐标绘制标准曲线。
将饼粕在45 ℃条件下真空干燥,粉碎至60目,用石油醚索氏提取,经旋转蒸发后获得脱脂饼粕粉。取一定量脱脂饼粕粉,按一定条件进行提取,提取液用乙醇定容,获得一定浓度的样品液。按照福林酚法以1.00 mL样品液替代没食子酸工作液测定多酚质量浓度。根据标准曲线计算样品液中多酚质量浓度,并按式(1)计算多酚得率(以没食子酸计)。
多酚得率=C×V/M
(1)
式中,C为样品液中多酚质量浓度(mg/mL);V为样品液体积(mL);M为脱脂粉质量(g)。
1.3.2 多酚提取工艺条件优化 单因素试验:以乙醇为溶剂,采用微波辅助提取法提取脱脂饼粕粉中的多酚并进行工艺优化。单因素试验以饼粕多酚得率为指标,分别考察料液比[质量(g)∶体积(mL)]为1∶10、1∶15、1∶20、1∶25、1∶30、1∶35、1∶40],微波功率(200、300、400、500、600、700、800 W),微波处理时间(60、120、180、240、300、360、420 s),提取温度(25、30、40、50、60、70、80 ℃),乙醇体积分数(40%、50%、60%、70%、80%、90%、100%)5个影响提取效果的关键因素对饼粕中多酚得率的影响[10]。考察某一单因素时,仅改变该单因素条件,其他因素条件固定,各固定因素的条件分别为:料液比1∶25,微波功率500 W,微波处理时间240 s,提取温度50 ℃,乙醇φ=70%。
正交试验设计:通过单因素试验选择各因素较优的4个水平,通过正交试验进一步确定较优的提取工艺条件。采用五因素四水平L16(45)正交设计试验,考察料液比(A)、微波处理时间(B)、乙醇体积分数(C)、微波功率(D)、提取温度(E)对藤椒冷榨油饼粕多酚得率的影响,确定最佳提取工艺条件。正交试验设计因素水平如表1。在最佳工艺条件下进行验证试验,获得饼粕多酚在最优提取条件下的得率。每个水平进行3次平行试验。
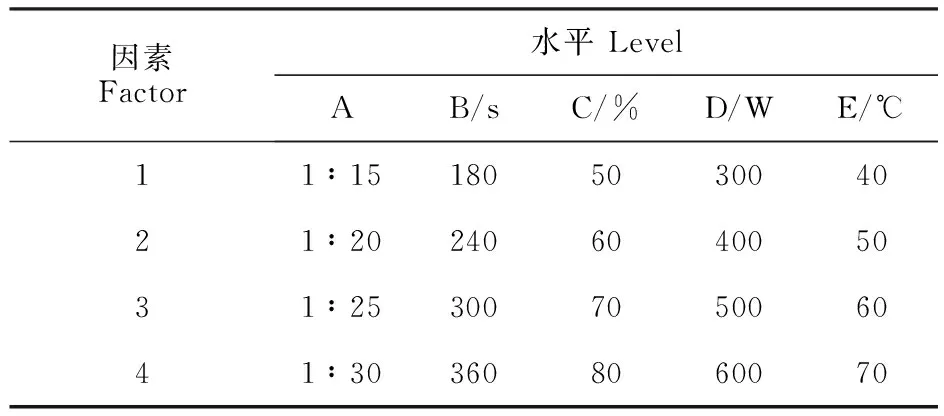
表1 饼粕多酚提取正交试验设计因素水平Table 1 Factors and levels of orthogonal experiment design for polyphenol extraction
按照饼粕多酚的最佳提取工艺条件提取藤椒多酚,根据“1.3.1”测定多酚质量分数,按式(1)计算藤椒多酚得率。
1.3.3 多酚纯化工艺条件优化 多酚的纯化方法:采用乙醇沉淀法对去除多酚提取液中蛋白质、多糖等杂质,利用大孔树脂进一步纯化,并优化大孔树脂纯化条件[11]。据报道,极性树脂HPD600、弱极性树脂AB-8、非极性树脂D-101均对多酚具有一定纯化效果[12-14]。
大孔树脂优选:选择极性树脂HPD600、弱极性树脂AB-8、非极性树脂D-101对多酚进行吸附纯化。利用经“1.3.2”优化得到的条件提取多酚得到多酚粗提液,粗提液经减压浓缩至一定体积,加入乙醇至φ=80%,静置2 h后离心取上清液,重复操作3次。上清液减压浓缩后冷冻干燥,用无水乙醇将冻干物配制成质量浓度为1.00 mg/mL 的多酚溶液。
分别精密称取预处理好的3种大孔树脂1.00 g,置于250 mL 具塞锥形瓶中,加入1.00 mg/mL多酚溶液50.00 mL,25 ℃恒温振摇吸附6 h,利用标准曲线计算多酚质量浓度。吸附后的大孔树脂用蒸馏水清洗2~3次,加入φ=80%乙醇50.00 mL,25 ℃恒温振摇解吸6 h,取解析液测定多酚质量浓度,按下式计算树脂的吸附量、吸附率、解吸率、回收率。
吸附量=(C0-C1)/M×V1
(2)
吸附率=(C0-C1)/C0×100%
(3)
解吸率=(C2×V2/(C0-C1)×V1×100%
(4)
回收率=(C2×V2)/(C0×V1)×100%
(5)
式中,C0为起始多酚质量浓度(mg/mL);C1为平衡多酚的质量浓度(mg/mL);V1为吸附液体积(mL);M为树脂干质量(g);C2为解吸液质量浓度(mg/mL);V2为解吸液体积(mL)。
树脂静态吸附-解析条件优化:上样液pH对静态吸附的影响。优选的大孔树脂预处理后取1.00 g于250 mL具塞锥形瓶中,加入pH分别为2、3、4、5、6、7、8,质量浓度为1.00 mg/mL的饼粕多酚样液50.00 mL,密封,25 ℃恒温振摇吸附6 h,取上清液测定多酚质量浓度,计算吸附率,确定上样液最优pH。
上样液浓度对树脂静态吸附的影响。精密称取优选并预处理好的大孔树脂1.00 g于250 mL具塞锥形瓶中,加入前面确定的上样液最优pH,质量浓度为0.50、1.00、1.50、2.00、2.50、3.00 mg/mL的饼粕多酚溶液50.00 mL,密封,25 ℃恒温振摇吸附6 h,取上清液测定多酚质量浓度,计算吸附率,分析样品上样质量浓度对大孔树脂吸附饼粕多酚的影响。
解析液乙醇浓度对树脂静态解吸的影响。精密称取优选并预处理好的大孔树脂1.00 g于250 mL具塞锥形瓶中,加入前面确定的上样液最优pH,和确定的最优浓度的饼粕多酚溶液50.00 mL,密封,25 ℃恒温振摇吸附6 h,过滤,树脂用蒸馏水清洗2~3次,加入体积分数为20%、40%、60%、80%、95%乙醇50.00 mL,25 ℃恒温振摇解吸6 h,取样测定多酚质量浓度,计算解吸率,分析洗脱液浓度对大孔树脂解吸饼粕多酚的影响。
树脂动态吸附-解吸条件优化:上样溶液流速对吸附的影响。选用16 mm×200 mm层析柱,称取5.00 g 优选的大孔树脂,湿法上柱,200 mL蒸馏水冲柱。确定的最优pH、上样液体积分数条件下,控制上样流速分别为0.50、1.00、1.50、2.00 mL/min。检测流出液多酚质量浓度,分析上样溶液流速对大孔树脂吸附饼粕多酚的影响。
洗脱液流速对洗脱的影响。样品溶液按上述确定的条件上样,吸附平衡1 h后,在确定的乙醇最优浓度条件下,控制洗脱流速分别为0.50、0.75、1.00、1.25 mL/min进行洗脱检测流出液中多酚质量浓度,分析洗脱液流速对洗脱的影响。
饼粕多酚和藤椒多酚的纯化:按照优化的多酚纯化工艺条件,对饼粕多酚和藤椒多酚分别进行纯化,洗脱液经减压浓缩冷冻干燥,取适量纯化物配制为溶液,采用福林酚法测定多酚的质量浓度,按式(6)计算多酚纯度。
多酚纯度/%=C×V/M×100
(6)
式中,C为样液多酚质量浓度(mg/mL);V为样液体积(mL);M为多酚纯化物质量(mg)。
1.3.4 多酚体外抗氧化活性测定 样品溶液制备:将饼粕多酚和藤椒多酚纯化物分别按倍比稀释法配制成一系列梯度浓度溶液,做体外抗氧化活性分析。同时配制一定浓度梯度的BHT溶液做阳性对照。
总还原能力的测定:采用铁氰化钾法[15]。分别取一系列浓度梯度的样液2.50 mL,加入2.50 mL 0.20 mol/L的磷酸盐缓冲液(PBS)(pH 6.6)和2.50 mLω=5%铁氰化钾溶液,混匀,在50 ℃条件下保温20 min,再加入2.50 mLω=10.00%的三氯乙酸,充分混匀后,以3 000 r/min离心10 min。取上清液2.50 mL,加入0.50 mLω= 0.10%的三氯化铁,并在700 nm波长处测吸光度(A)值。
D=[1-(Ax-Ax0)/(A0-A00)]×100%
(7)
ABTS+·的清除:参照罗少宏[17]的方法,并作一定改进。准确量取1.00 mL不同浓度样品溶液,分别加入10.00 mL ABTS离子液,充分混匀后避光反应6 min,测定6 min后溶液在734 nm处的吸光度分别计作Ax;以样品溶剂代替样品溶液做对照,并记吸光度值为Ax0。以PBS(0.10 mol/L ,pH=7.4)代替ABTS离子液做空白,测试方法不变,计作A0。同时以BHT做对照。ABTS+·清除率(D)按式8计算。
D=[1-(Ax-Ax0)/A0]×100%
(8)
DPPH·的清除:0.20 mL不同浓度样品溶液与5.00 mL 0.10 mmol/L DPPH·无水乙醇溶液混合,于室温下避光放置30 min,测定其在517 nm下的吸光度值(Ax);以0.20 mL样品溶剂代替样品为空白对照(Ax0);以0.20 mL样品与5 .00 mL无水乙醇混合液为样品本底吸收校正(A0)。DPPH·清除率(D)按式(8)计算[17]。
2 结果与分析
2.1 多酚提取工艺条件优化
由微波辅助提取工艺单因素试验结果(图1)可知,通过单因素试验选取的5个因素的条件分别是料液比1∶25,微波处理时间300 s,乙醇体积分数60%,微波功率600 W,提取温度60 ℃。

图1 微波处理工艺各因素对多酚提取效果影响Fig.1 Effect of different factors of microwave treatment on extraction of polyphenols
2.1.2 饼粕多酚微波辅助提取正交试验结果 根据极差分析(表2)可知,在试验设计范围内,微波辅助提取饼粕多酚的各因素对得率影响的主次顺序为A>D>B>E>C,即产生影响的最重要因素是料液比,其次是微波功率、微波处理时间、提取温度,乙醇体积分数对饼粕多酚得率的影响相对较小。从正交试验方差分析结果(表3)可以看出,各因素对多酚得率的影响均极显著,说明这5个因素对饼粕多酚得率均有较大影响。
通过正交试验可以确定提取条件的优化组合为A3B4C1D2E3,即料液比1∶25、微波处理360 s、乙醇体积分数50%、微波功率400 W、提取温度60 ℃,按照此条件进行3次最佳提取工艺验证试验,分酚得率为(6.83±0.09) mg/g,优于正交试验中各个条件下的多酚得率,表明该工艺条件稳定,利用该正交试验优化微波辅助提取饼粕多酚的工艺是可行的。同时,按上述工艺条件提取藤椒多酚,得率为(15.45±0.09) mg/g。
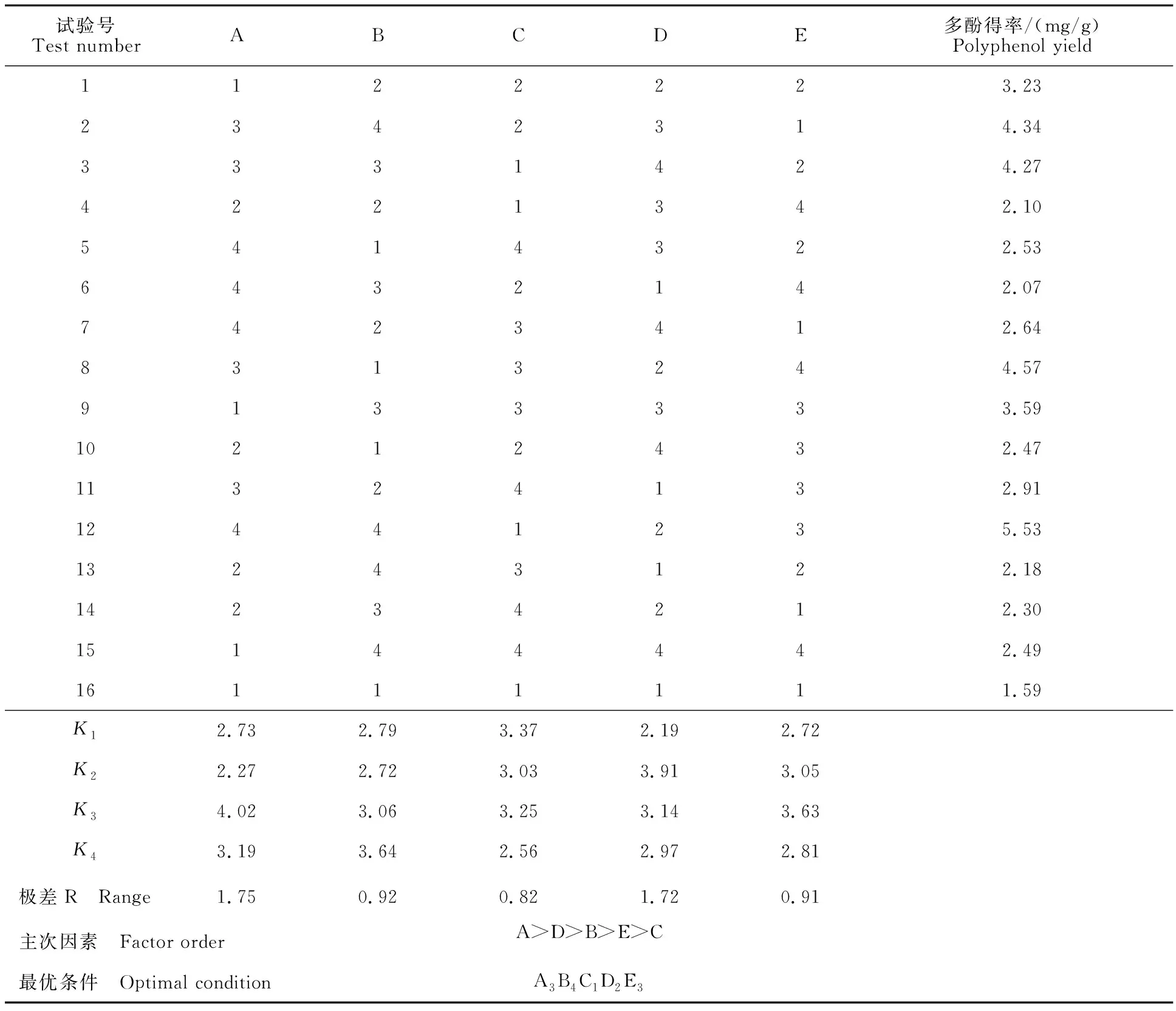
表2 正交试验结果与极差分析Table 2 Results and analysis of orthogonal experiment

表3 方差分析Table 3 Analysis of variance
注:0.01 Note: * Significant at level of 0.01 2.2.1 大孔树脂优选 3种树脂对饼粕多酚的纯化效果见表4。大孔树脂与待分离物质的结合力强弱与基团的极性有关。由表4可以看出,极性树脂HPD600对多酚的吸附率最低,弱极性树脂AB-8对多酚具有较好的吸附效果。就解吸率而言,树脂D-101表现最佳,其次是树脂AB-8。虽然树脂AB-8的解吸率低于D-101,但是树脂AB-8的吸附量、吸附率、回收率的值在3种树脂中均最高。综合各方面因素,本试验选用树脂AB-8进行多酚吸附纯化试验。Yi等[13]采用AB-8树脂对PinusKoraiensisPinecones中的多酚进行纯化,发现AB-8树脂在2 h内吸附和解吸速率增长最快,之后达到饱和,具有很好的吸附性和解吸性能。 表4 不同树脂对饼粕多酚吸附效果的影响Table 4 Effect of different resins on adsorption of polyphenols 注:同列不同小写字母表示差异显著(P<0.05)。 Note: Different lowercase letters in the same column indicate significant differences (P<0.05). 2.2.2 树脂静态吸附-解吸工艺的确定 由图2中吸附率随pH的变化趋势可知,当pH为4,即溶液呈酸性时,树脂AB-8对饼粕多酚的吸附率最高。原因可能是饼粕多酚呈弱碱性,在酸性条件下较易被吸附,而在碱性环境下,多酚解离为离子状态,不利于树脂的吸附作用[18]。选择pH为4作为多酚吸附的最佳pH。 由吸附率随上样液质量浓度的变化趋势可以看出,树脂对多酚的吸附率随着多酚上样液浓度的增加呈先上升后下降的趋势。当多酚质量浓度较低时,多酚分子向树脂内部的扩散较慢,吸附率低;随着质量浓度的增加,加速了多酚分子向树脂内部的扩散,吸附率逐渐上升;当质量浓度继续增加,因树脂的吸附量有限,多酚分子间、多酚与杂质间竞争增加,吸附作用受到阻碍[19]。选上样液质量浓度为1.5 mg/mL(上样液多酚质量浓度为0.53 mg/mL)。 从解析率随乙醇体积分数的变化趋势得到,当解吸液乙醇体积分数小于60%时,解吸率随乙醇体积分数增加而升高,主要原因是饼粕多酚随着乙醇体积分数增加,溶解量增大,同时增大了大孔树脂的溶胀,使多酚更易被洗脱下来。乙醇体积分数超过60%时,增加乙醇体积分数,吸附在树脂上的弱极性色素被一并洗下,影响产品纯度,解吸率反而下降。因此,选择60%作为解吸液乙醇的体积分数。 图2 不同条件对树脂静态吸附-解吸效果的影响Fig.2 Effect of different conditions on static adsorption and desorption of resin 2.2.3 树脂动态吸附-解吸工艺的确定 样液流速对吸附效果的影响及洗脱液流速对解析效果的影响如图3。当流出液中多酚的质量体积分数达到上样液多酚质量浓度的1/10时,被认为已经产生泄漏,称为到达泄漏点[20]。而在动态吸附过程中,上样液的流速直接影响着泄漏点的出现时间。图3中,上样溶液流速越低,泄漏点出现需要的流出液体积越多,时间越长。但流速过小,操作时间长,效率低,流速过大,样品纯化效果降低。因此选择1.00 mL/min作为上样流速。 图3 上样液流速对动态吸附效果的影响Fig.3 Effect of sample solution flow rate on dynamic adsorption 洗脱液流速对解吸效果的影响如图4。当洗脱流速为1.25 mL/min时,洗脱带较宽,且有明显的拖尾现象,说明过快的洗脱速度不利于洗脱液与树脂上的多酚的充分作用;当洗脱流速为1.00、0.75 mL/min时,两者洗脱峰较为相似,洗脱峰较集中,拖尾现象不明显;当洗脱流速为0.50 mL/min时,洗脱液能够充分溶解被树脂吸附的多酚,解吸峰集中、对称,然而洗脱时间过长,影响效率。综合上述分析,考虑选择的流速1.00 mL/min作为多酚的最佳洗脱流速。 图4 洗脱液流速对动态解吸效果的影响Fig.4 Effect of eluent flow rate on dynamic desorption 2.2.4 多酚的纯化 综合上述研究,采用AB-8弱极性树脂对藤椒冷榨油饼粕中的多酚进行纯化,上样液pH为4、上样液质量浓度为1.50 mg/mL(多酚实际质量浓度0.53 mg/mL),以1.00 mL/min流速上样,上样结束后吸附平衡1 h,用60%乙醇以1.00 mL/min的流速进行洗脱。经过纯化,饼粕多酚的纯度由35.70%±2.87%提高到76.30%±3.28%。采用同样的方法纯化藤椒多酚,藤椒多酚的纯度由29.52%±1.72%增加到70.20%±2.74%。 2.3.1 多酚的还原力 物质的还原能力与抗氧化活性之间存在十分密切的关系,还原力强,表示其具有强的抗氧化性[21]。在Fe3+- Fe2+氧化还原体系中,可通过显色反应来判断还原程度,吸光度越大,还原能力越强。由图5样品质量浓度变化对多酚还原力的影响曲线图可以看出,在质量浓度为0.05~0.50 mg/mL时,多酚提取物、BHT均在较低质量浓度下有较高的还原力,且还原力均是随质量浓度的增大而增大。其中,BHT作为合成抗氧化剂常被用作天然提取物的体外抗氧化活性对比分析。在低质量浓度(小于0.14 mg/mL)条件下,3种受试物的还原力大小依次:藤椒多酚>饼粕多酚>BHT,而随着质量浓度的增加,BHT的还原力变化幅度较其余两者更大。 各受试物还原能力与其浓度的相关性分析见表5,各受试物的还原能力与其浓度的相关系数均大于0.9,表明在试验浓度范围内存在量效关系。 图5 样品浓度变化对多酚还原力的影响Fig.5 Effect of sample concentration on reduction of polyphenol 样品Sample回归方程Regression equation相关系数Correlation coefficientBHTy=1.137 60 x+0.070 870.978 62饼粕多酚 Biscuit polyphenolsy=0.771 81 x+0.139 800.981 44藤椒多酚Zanthoxylum armatum polyphenolsy=0.854 91 x+0.147 400.995 98 注:回归方程中“x”代表各受试物质量浓度,“y”代表各受试物的还原能力。 Note: In the regression equation, “x” represents mass concentration of each test substance, and “y” represents reducing ability of each test substance. 图6 样品质量浓度变化对多酚清除作用的影响Fig.6 Effect of sample mass concentration on removal of from polyphenols 2.3.3 多酚清除ABTS+·的能力 由图7可见,随多酚质量浓度的增加,ABTS+·的清除率有一定变化:藤椒多酚和饼粕多酚对ABTS+·的清除能力增长趋势基本相同,质量浓度小于0.20 mg/mL 时,饼粕多酚和藤椒多酚对ABTS+·的清除率急剧增加,多酚质量浓度继续增加,清除率基本趋于稳定。BHT对ABTS+·的清除率随多酚质量浓度增加变化不明显,质量浓度高于0.40 mg/mL后,三者的清除率基本持平。总体来说,藤椒多酚对ABTS+· 的清除优于饼粕多酚,两者对ABTS+·的IC50值分别为:0.052、0.063 mg/mL,而BHT对ABTS+·清除效果最优,IC50值低于0.005 mg/mL。 图7 样品质量浓度变化对多酚清除ABTS·+作用的影响Fig.7 Effect of sample mass concentration on removal of ABTS·+ from polyphenols 2.3.4 多酚清除 DPPH·的能力 随样品中多酚质量浓度增加对DPPH·清除率变化如图8。由图可知,在0.05~0.50 mg/mL范围内,样品溶液对DPPH·的清除率随质量浓度的增加逐渐升高,质量浓度大于0.4 0 mg/mL时,对DPPH·的清除率达到90.00%以上。饼粕多酚IC50值为0.126 mg/mL,藤椒多酚IC50值为0.090 mg/mL,而BHT的IC50值则为0.054 mg/mL。在同样的提取条件下,饼粕多酚清除DPPH·的能力低于藤椒多酚,可能是由于多酚在藤椒冷榨过程中更多的留在了藤椒油中。 图8 样品质量浓度变化对多酚清除DPPH·作用的影响Fig.8 Effect of sample mass concentration on removal of DPPH· from polyphenols 利用微波辅助提取技术,采用正交试验对藤椒冷榨油饼粕中的多酚类物质的提取条件进行优化,结果表明,料液比对饼粕多酚的得率影响最大,其次依次是微波功率、微波处理时间、提取温度和乙醇体积分数,各因素对多酚得率的影响均极显著。微波辅助提取藤椒冷榨油饼粕多酚的最佳工艺条件是料液比1∶25、微波处理360 s、乙醇体积分数50%、微波功率400 W、提取温度60 ℃,在此条件下的多酚得率为(6.83±0.09) mg/g。按上述工艺条件提取藤椒多酚,得率为(15.45±0.09) mg/g。 通过对比3种不同极性的大孔树脂(HPD600、AB-8、D-101)对饼粕多酚的纯化效果,结果表明,AB-8型大孔树脂对藤椒多酚的纯化效果最好。AB-8纯化饼粕多酚的最佳工艺条件为:上样液pH为4、多酚浓度为0.53 mg/mL,以1.00 mL/min流速上样,采用60%乙醇以1.00 mL/min的流速进行洗脱。纯化后,饼粕多酚的纯度由(35.70±2.87)%提高到(76.30±3.28)%。同样的方法纯化藤椒多酚,藤椒多酚的纯度由(29.52±1.72)%增加到了(70.20±2.74)%。 藤椒冷榨油饼粕中残留有一定的多酚类物质和抗氧化活性,具有一定的开发利用潜力。2.2 多酚纯化工艺条件优化




2.3 多酚体外抗氧化活性





3 结 论

