美洲商陆致中国仓鼠肺细胞染色体畸变实验研究
2018-12-18程泽星
于 蒙, 程泽星
(扬州大学附属医院, 江苏 扬州, 225001)
美洲商陆属商陆科多年生宿根草本,其含有商陆皂甙和商陆多糖,具有较强的免疫活性作用。研究[1-2]显示,由美洲商陆植物根茎中分离、提纯的碱性核糖体失活蛋白(PAP)对多种动植物病毒具有广谱抗性,可通过抑制人体免疫缺陷病毒的复制而治疗艾滋病。目前,有关美洲商陆药理作用的研究较多,但在遗传毒性方面的研究鲜有报道。本研究设计中国仓鼠肺细胞染色体致突变实验研究,现将结果报告如下。
1 材料与方法
1.1 材料
试验细胞为中国仓鼠肺细胞(CHL), 由中科院上海细胞库提供。受试物为美洲商陆根(干燥),横切成薄片, FW 135型中草药粉碎机粉碎,过150目筛。其粉末灰白色,气微甜,含量99.00%, 经浸出物测定和商陆皂苷甲(C42H66O16)含量测定合格后, 4 ℃保存备用[3-4]。主要试剂包括丝裂霉素C(MMC)、环磷酰胺(CP)、四唑盐(MTT),购自Sigma公司; Dulbecco′s Modifed Eagle Medium(DMEM)培养基,购自GIBCO公司; 多氯联苯(Aroclor1254)购自百灵威科技有限公司; 其余试剂均为国产分析纯。
1.2 研究方法
1.2.1 大鼠肝微粒体酶的诱导和S9的制备: 选择健康雄性成年SD大鼠3只,体质量200~220 g, 采用Aroclor1254作为诱导剂,溶于玉米油中,浓度为200 mg/mL, 按500 mg/kg无菌操作行腹腔注射。动物诱导后每天给予正常的饮食和饮水,诱导后第5天颈椎脱臼处死动物,处死前12 h停止饮食,正常饮水。
无菌条件下取出肝脏,按每克肝脏加入无菌的0.15 mol/L氯化钾溶液(0 ℃) 3 mL, 组织匀浆器20 000转/min混匀1 min制成肝匀浆,在4 ℃条件下,以9 000 g离心10 min, 取其上清液(S9)分装于无菌塑料管中,每管1 mL, -80 ℃保存备用。S9活力经诊断性诱变剂鉴定符合实验要求。
每10 mL 10%S9混合液由以下成分组成: DMEM不完全培养液6.0 mL, 1.65 mol/L氯化钾溶液0.2 mL, 0.4 mol/L氯化镁溶液0.2 mL, 0.05 mol/L葡萄糖-6-磷酸溶液1.0 mL, 0.025 mol/L辅酶Ⅱ(氧化型)溶液1.6 mL, 大鼠肝S91.0 mL。需用时无菌操作配制, 0 ℃保存备用。
1.2.2 试验分组: 购买的CHL细胞置于CO2培养箱(5% CO2)中37 ℃孵育。收集对数生长期细胞,进行细胞生长半数抑制浓度(IC50)测定和染色体畸变试验。通过细胞生长指标检测美洲商陆对CHL细胞的毒性,依据IC50设定染色体畸变试验高剂量组,同时设阳性对照组(直接诱变剂MMC和间接诱变剂CP)和阴性对照组[灭菌水和二甲基亚砜(DMSO)]。
1.3 IC50测定
1.3.1 剂量设计: 依据体外哺乳动物细胞染色体畸变试验国家标准(GB/T 21794-2008)染毒浓度剂量设计原则,将终浓度5 mg/mL设定为96孔板IC50测定的最高剂量,下设6个剂量组(2.5、1.0、0.2、0.04、0.008、0.001 6 mg/mL), 另设阴性对照组及阳性对照组,每个剂量组分为加入代谢活化系统(+S9)和不加入代谢活化系统(-S9) 2个系列,每个剂量组设5个平行孔。
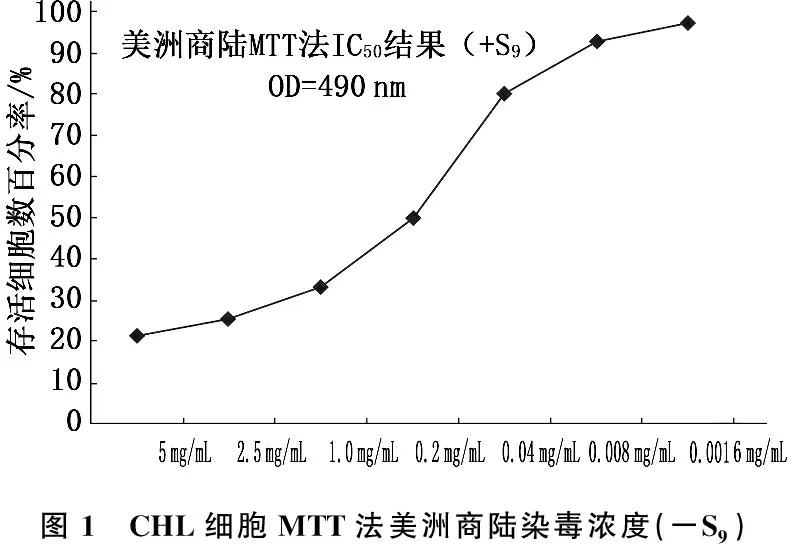
1.3.2 IC50试验方法: 倒置显微镜下观察细胞生长状况,收集对数生长期细胞,用DMEM完全培养液调整细胞悬液浓度至5×104~6×104/mL, 吸取细胞悬液接种于96孔板中,每孔200 μL, 每个浓度设5个平行孔(边缘孔用PBS溶液填充), 5% CO2、37 ℃孵育16 h, 弃去旧的培养液。在不加入代谢活化系统的条件下(-S9), 每孔加入不含10%小牛血清的培养液199 μL, 试验组每孔依次加入受试物溶液1 μL, 阴性对照组每孔加溶剂(无菌水和DMSO)1 μL, 阳性对照组每孔加丝裂霉素C(0.4 mg/mL) 1 μL, 继续培养24 h。吸去旧培养液,每孔加入180 μL DMEM完全培养液和20 μL MTT溶液(5 mg/mL), 混匀后继续培养4 h, 终止培养。小心吸去孔内培养液,用PBS溶液洗细胞1次,每孔加入150 μL DMSO, 置摇床上低速振荡10 min, 使蓝紫色结晶充分溶解,酶联免疫检测仪[吸光度(OD) 490 nm]检测各孔的吸光值。见表1。

表1 美洲商陆对CHL细胞的细胞毒性实验 n=5)
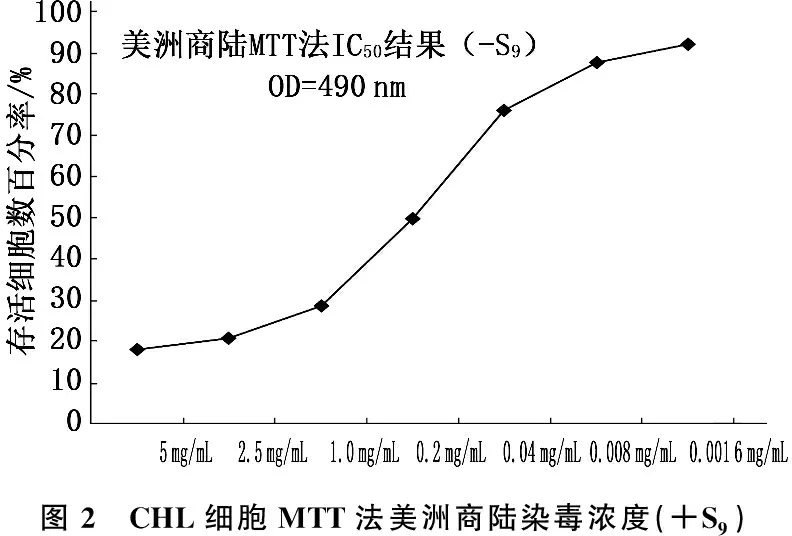
在加入代谢活化系统的条件下(+S9), 阳性对照为环磷酰胺(20 mg/mL), 每孔依次加入受试物溶液1 μL和10% S9混合液20 μL, 用不含10%小牛血清的培养液补足至200 μL,继续培养24 h。弃去旧的培养液,每孔加入180 μL DMEM完全培养液和20 μL MTT溶液(5 mg/mL), 混匀后继续培养4 h, 终止培养。小心吸去孔内培养液,用PBS溶液洗细胞1次,每孔加入150 μL DMSO, 置摇床上低速振荡10 min, 使蓝紫色结晶充分溶解,酶联免疫检测仪(OD 490 nm)检测各孔的吸光值。见表2。

表2 美洲商陆对CHL细胞的细胞毒性实验
1.4 染色体畸变试验
1.4.1 剂量设计: 依据剂量设计原则,抑制50%CHL细胞生长的受试物浓度设为染色体畸变试验的高剂量组(终浓度, 200 μg/mL), 下设4 个剂量组,另设溶剂对照组(无菌水和DMSO)和阳性对照组(直接诱变剂MMC和间接诱变剂CP)。
1.4.2 染毒方法与体积: 染毒方法按GB/T 21794-2008进行,在加入代谢活化系统(+S9)和不加入代谢活化系统(-S9)的条件下,给处在增殖期的CHL细胞染毒受试物,染毒时间6 h,并在开始染毒后24 h采样。上述结果如均为阴性,则需要在不加入代谢活化系统(-S9)的条件下进行一次延长染毒时间至一个半正常细胞周期的试验(染毒时间24 h), 每个剂量组设2个平行样品。
1.4.3 不加入代谢活化系统条件下(-S9)细胞染毒试验方法: 倒置显微镜下观察细胞生长状况,收集对数生长期细胞,用DMEM完全培养液调整细胞悬液浓度,使细胞浓度调至5×104~6×104/mL, 吸取细胞悬液接种到6孔板中,每孔依次加入细胞悬液2 mL和DMEM完全培养液8 mL, 每个浓度设2个平行孔, 5% CO2、37 ℃孵育24 h, 弃去旧的培养液,加入新的DMEM完全培养液10 mL, 5% CO2、37 ℃孵育24 h。细胞密度达80%~90%时,吸去6孔板中的培养液,每孔加入不含10%小牛血清的培养液9.98 mL, 试验组每孔依次加入受试物溶液20 μL, 阴性对照组每孔加入溶剂(灭菌水和DMSO)20 μL, 阳性对照组每孔加入丝裂霉素C(1 mg/ml) 20 μL, 细胞分别染毒6、24 h后,吸去旧的培养液,用Hanks液洗细胞3次,加入10 mL DMEM完全培养液,放回培养箱继续培养,于24 h内收获细胞。收获细胞前4 h, 加入细胞分裂中期阻断剂秋水仙素,终浓度为1 μg/mL。
1.4.4 加入代谢活化系统条件下(+S9)细胞染毒试验方法: 倒置显微镜下观察细胞生长状况,收集对数生长期细胞,用DMEM完全培养液调整细胞悬液浓度,使细胞浓度调至5×104~6×104/mL, 吸取细胞悬液接种到6孔板中,每孔依次加入细胞悬液2 mL和DMEM完全培养液8 mL, 每个浓度设2个平行孔, 5% CO2、37 ℃孵育24 h, 弃去旧的培养液。加入新的DMEM培养液, 5% CO2、37 ℃孵育24 h, 细胞密度达80%~90%时,吸去6孔板中的培养液,每孔加入不含10%小牛血清的培养液8.98 mL和10% S9混合液1.0 mL。试验组每孔依次加入受试物溶液20 μL; 阴性对照组每孔加入溶剂(灭菌水和DMSO)20 μL; 阳性对照组每孔加入环磷酰胺(50 mg/mL)20 μL。细胞染毒6 h, 结束后吸去旧的培养液,用Hanks液洗细胞3次,加入10 mL DMEM完全培养液,放回培养箱继续培养, 24 h内收获细胞,收获细胞前4 h, 加入细胞分裂中期阻断剂秋水仙素,终浓度为1 μg/mL。
1.4.5 收集细胞: ① 弃去6孔板内培养液, 0.25%胰蛋白酶溶液消化细胞2~3 min, 待细胞变圆、间隙变大后吸去胰蛋白酶溶液,加5 mL DMEM完全培养液终止胰蛋白酶作用,用吸管轻轻吹打混匀。② 吸取细胞悬液入离心管中, 1 000转/min离心7 min, 弃去上清液,加入37 ℃预热的0.075 mol/L的氯化钾溶液10 mL, 混匀, 37 ℃水浴低渗处理25 min。③ 预固定,细胞低渗处理后加入新鲜配制的固定液(甲醇∶冰醋酸=3∶1)1 mL, 混匀后静置20 min。④ 固定, 1 000转/min离心7 min, 弃上清,加固定液5 mL, 混匀后静置20 min。重复上述步骤再固定一次。⑤ 弃去大部分上清液,留下0.3~0.5 mL, 充分打匀制成细胞混悬液,在洁净的冷冻玻片上方15~20 cm处滴3~5滴细胞悬液于玻片上,轻吹细胞悬液扩散平铺于玻片上,将玻片在酒精灯上微热烘烤,自然晾干,每个样本制片2 张。⑥ 自然晾干的涂片用Giemsa应用液染色10 min, 蒸馏水冲洗,晾干,待检。
1.5 阅片
采用双盲法阅片。在低倍镜下按顺序寻找背景清晰、各个染色体分散、互不重叠、长短收缩适中、两条单体分开、清楚地显示出着丝点位置的染色体区域,在油镜下进行细胞中期染色体畸变分析。染色体畸变类型包括多倍体、断片、交换、环状染色体、微小体、内复制、染色体碎裂、双着丝点染色体等。读片时应记录每一观察细胞的染色体数目,对于畸变细胞还应记录显微镜视野的坐标位置及畸变类型。2个平行样品各计数100个中期相细胞,每个剂量组分别计数200个分散良好的中期分裂相细胞。
1.6 数据分析

1.7 结果评价
在相同的试验条件下,阳性结果至少进行3次重复测试,阴性结果至少进行2次重复测试,才能对受试药品作出最终评价判定。首先观察阳性对照组和阴性对照组的试验结果,要求阴性对照组的染色体畸变率应在质控范围(≤5%), 并且阳性对照组的染色体畸变率与阴性对照组的染色体畸变率有显著差异(P<0.01)。下例情况下可判定受试物在本试验系统中具有致突变性: 染色体畸变细胞数的增加与浓度相关或含染色体畸变的细胞数的增加是可重复的。
2 结 果
半数抑制浓度是指药物能将细胞生长、病毒复制等抑制50%所需的药物浓度(IC50)[5-9], 本研究结果显示,随着美洲商陆对CHL细胞的染毒浓度逐渐降低, CHL细胞存活细胞数增多,表明美洲商陆染毒浓度的高低与CHL细胞存活细胞数呈负相关,见图1、2。在加入和不加入代谢活化系统的条件下,给处在增殖期的CHL细胞染毒受试物,染毒时间6 h, 并在开始染毒后24 h收集细胞,检测美洲商陆致CHL细胞染色体畸变数目和染色体畸变类型,结果阴性。依据GB/T 21794-2008国标试验要求,在不加入代谢活化系统的条件下进行一次延长染毒时间至一个半正常细胞周期的试验(染毒时间24 h), 收集CHL细胞,镜检,染色体畸变试验结果阴性。在加入和不加入代谢活化系统的条件下细胞暴露于受试物, CHL细胞的5个剂量组染色体畸变率与阴性对照组比较,差异无统计学意义(P>0.05), 未出现剂量-反应关系, 2次试验结果一致。阳性对照组染色体畸变率显著高于美洲商陆各剂量组和阴性对照组(P<0.01)。见表3、4、5。
3 讨 论
根据国家药典中美洲商陆的药理学特性,利用细胞完整性和细胞生长(存活细胞计数)指标来测定美洲商陆对CHL细胞的毒性。本研究结果表明,给处在增殖期的CHL细胞染毒,随着受试物染毒, CHL细胞的浓度逐渐降低, CHL细胞存活数增高。在不加入代谢活化系统的条件下(-S9), 阳性对照(丝裂霉素C, 2 μg/mL) OD值(0.70±0.06), IC50=84.78, 美洲商陆(0.2 mg/mL)OD值(0.41±0.04), IC50=49.94; 在加入代谢活化系统的条件下(+S9), 阳性对照(环磷酰胺, 100 μg/mL)OD值(0.70±0.03), IC50=85.21, 美洲商陆(0.2 mg/mL)OD值(0.41±0.02), IC50=49.96。表明不需要外源性代谢活化的阳性对照物丝裂霉素C和需要外源性代谢活化的阳性对照物环磷酰胺,对CHL细胞的毒性浓度设计合理,阳性试验系统敏感。在加入和不加入代谢活化系统的条件下,美洲商陆浓度在0.2 mg/mL时对CHL细胞的毒性无显著差异,存活细胞数一致。
表3 美洲商陆第1次染毒6 h对CHL细胞染色体畸变试验结果
表4 美洲商陆第2次染毒6 h对CHL细胞染色体畸变试验结果
表5 美洲商陆染毒24 h对CHL细胞染色体畸变试验结果
CHL细胞是中国仓鼠胚胎肺成纤维细胞株,染色体众数为(22±2)的二倍体细胞,其细胞周期约16 h, 克隆形成率约95%, 是目前运用较为广泛的一株哺乳动物细胞。依据体外哺乳动物细胞染色体畸变试验方法(GB/T 21794-2008), 收集受试物各剂量组(200.0~1.6 μg/mL)、溶剂对照组(灭菌水和DMSO)、阳性对照组(直接诱变剂MMC和间接诱变剂CP)的中期分裂相细胞进行染色体畸变数和染色体畸变类型分析。溶剂对照组染色体结构畸变细胞百分率在规定的质控范围内(≤5%), 与相关文献[10-12]报道一致。美洲商陆致CHL细胞的染色体畸变实验表明,在加入和不加入代谢活化系统的条件下, CHL细胞暴露于受试物6 h, CHL细胞生长正常。美洲商陆染色体畸变细胞数与溶剂对照组相比,差异无统计学意义(P>0.05); 染色体畸变细胞数与阳性对照组相比,差异有统计学意义(P<0.05)。在不加入代谢活化系统(-S9)的条件下将染毒时间延长至24 h, 收集CHL中期分裂相细胞、镜检,显示CHL细胞染色体畸变细胞数百分率与阴性对照组相比,差异无统计学意义(P>0.05), CHL细胞染色体畸变细胞数百分率与阳性对照组相比,差异有统计学意义(P<0.05)[13-15]。
综上所述,选用CHL细胞进行体外哺乳动物细胞染色体畸变试验符合临床药物毒理学试验标准。在本实验条件下,美洲商陆不诱发体外培养的哺乳动物细胞染色体结构畸变,本实验研究对美洲商陆碱性核糖体失活蛋白基因水平上的研究有促进作用。
