丹皮酚改善大鼠痛风性关节炎与调节核因子κB活化的关系研究
2018-12-18殷钟意郑旭煦
陈 刚,殷钟意,郑旭煦
(重庆市天然药物研究重点实验室,重庆工商大学环境与资源学院,重庆 400067)
随着人们生活水平的提高和饮食习惯的改变,近几十年来痛风的发病率逐年升高[1]。痛风是因为血尿酸浓度过高,导致尿酸盐(monosodium urate,MSU)晶体沉积在关节及其周围组织中,激发机体产生的无菌性炎症反应。越来越多的资料提示,MSU诱导的核因子κB(nuclear factor κB,NF-κB)活化和炎性介质大量产生在痛风炎症发生、发展中起了重要作用[2]。在非活化状态下,NF-κB p65蛋白与NF-κB抑制蛋白(inhibitor of NF-κB,IκB)α结合而存在于细胞质中。MSU可与关节局部细胞,如巨噬细胞、单核细胞、成纤维样滑膜细胞表面的Toll样受体(Toll-like receptor,TLR)-2和TLR-4结合,通过磷脂酶C和D、Src酪氨酸激酶、G蛋白或者丝裂原激活的蛋白激酶等信号通路,促使IκBα泛素化降解,导致p65蛋白核转移,促进多种炎性介质基因如肿瘤坏死因子α(tumor necrosis factor α,TNF-α)、白细胞介素(interleukin,IL)-1β和IL-6大量转录,最终促进痛风炎症的发生与发展[3]。
在中医药临床实践中,牡丹皮是用于痛风治疗的常用中药之一。丹皮酚是牡丹皮中主要的药理成分,已被证实具有抗炎、镇痛、降血糖、降血脂、抗动脉粥样硬化、抗心律失常、抗菌、抗肿瘤等药理作用[4]。丹皮酚抗炎药理作用已经在多种动物炎性模型上得到证实[5],但是丹皮酚对MSU诱导的痛风炎症发生、发展影响如何,至今未见报道。本研究拟采用MSU诱导的大鼠痛风性关节炎(MSU-induced gouty arthritis,MGA)模型,观察丹皮酚对关节肿胀、关节功能、关节病理损伤、炎性介质表达和NF-κB活化的影响,以明确丹皮酚是否有抗痛风的药理作用及其潜在的药理机制,为利用丹皮酚研发新的抗痛风药物提供科学依据。
1 材料
1.1试剂丹皮酚、尿酸、抗酒石酸酸性磷酸酶(tartrate-resistant acid phosphatase,TRAP)试剂盒,均购自美国Sigma公司;秋水仙碱(colchicine)片购自云南植物药业有限公司(国药准字H5302016,批号20160802);TNF-α抗体、IL-1β抗体、IL-6抗体、免疫组织化学染色试剂盒(二步法),均购自北京中杉金桥生物技术有限公司;IκBα抗体、p65抗体、β-actin抗体,均购自美国Santa Cruz公司;PVDF膜和ECL试剂购自美国Milipore公司;RIPA裂解液和BCA蛋白测定试剂盒均购自碧云天生物技术有限公司;其他试剂均为国产分析纯。
1.2仪器RC24型高速冷冻离心机(Thermo Scientific Sorvall公司);PBC7140足体积检测仪(Ugo Basile公司);Infinite M200型全标仪(BioTek公司);ChemiDoc XRS型成像系统(Bio-Rad公司);80i型正置荧光显微镜(Nikon公司)。
1.3实验动物SD大鼠,♂,体质量(200~240) g,购自重庆医科大学实验动物中心,动物合格证号:SCXK(渝)2016-0012。所有动物适应性喂养1周后开始实验。
2 方法
2.1MSU晶体的制备[6]4 g尿酸溶解于预热至60℃的800 mL蒸馏水中,用0.5 mol·L-1氢氧化钠调整pH至8.9后,4℃静置过夜。溶液经4 000 r·min-1离心10 min,取沉淀为MSU晶体,纯乙醇洗3次,干燥后高压灭菌。
2.2模型制备与分组给药SD大鼠随机分为6组,每组10只,具体如下:对照组(Control)、模型组(MGA)、阳性对照组(0.3 mg·kg-1秋水仙碱)、丹皮酚组(50、100、200 mg·kg-1)。丹皮酚、秋水仙碱组连续灌胃给药7 d,每天1次,对照组与模型组给予同体积生理盐水。d 5给药后1 h 给予大鼠右后足踝关节腔内注射0.1 mL MSU溶液[7](MSU混悬于生理盐水,终浓度为20 g·L-1),对照组大鼠右踝关节腔注射0.1 mL生理盐水。继续给药2 d,于造模后48 h麻醉处死动物,取材进行相关检测。
2.3关节体积检测分别于造模前(0 h),造模后2、6、12、24、48 h检测右踝关节体积。
2.4步态评分检测造模后24 h检测大鼠步态评分,评分标准如下[7],0分:双足正常行走;1分:轻度跛行,左后足可着地;2分:中度跛行,左后足可着地但马上收回;3分:重度跛行,左后足不能着地,只能3足着地行走。
2.5组织学评分检测取大鼠右后足踝关节,于4%多聚甲醛缓冲液中固定24 h,10% EDTA溶液脱钙28 d,常规脱水,透明,包埋,切片,苏木精伊红染色,然后进行组织学评分[8]。评分参数包括组织肿胀、炎性细胞浸润、滑膜组织增生和组织坏死。计分标准如下,0分:正常;1分:轻度病变;2分:中度病变;3分:重度病变。关节体积、步态分析及组织学评分检测均由不知道本研究方案的实验员完成。
2.6TRAP染色检测取上述实验所制备的切片,按照TRAP染色试剂盒说明书进行染色,100倍镜下计数TRAP阳性(酒红色)染色细胞数作为破骨细胞数量。
2.7免疫组织化学染色检测取上述实验制备的切片,按照“二步法”免疫组织化学染色试剂盒说明书操作。所用抗体分别为抗TNF-α、抗IL-1β、抗IL-6抗体。DAB显色,中性树胶封片。200倍镜下分析阳性染色的光密度值,随机取同组10张切片的平均光密度值代表该细胞因子的表达值。
2.8Westernblot检测取大鼠左后足踝关节滑膜组织,加入RIPA裂解液及蛋白酶抑制剂反复匀浆,4℃下12 000 r·min-1离心15 min后取上清。取等量蛋白进行SDS-PAGE电泳,转移蛋白至PVDF膜,5%脱脂奶粉封闭,4℃下与IκBα抗体、p65抗体或者β-actin抗体共同孵育过夜,再与相应的二抗室温共同孵育1 h,加入ECL发光试剂后,成像系统检测分析信号。以目的蛋白与内参蛋白的光密度比值代表该目的蛋白的表达值。

3 结果
3.1丹皮酚对MGA大鼠足肿胀和步态评分的影响如Tab 1所示,与对照组相比,踝关节腔内注射MSU 6 h后大鼠即出现明显的足肿胀(P<0.01),12 h后足肿胀达到最高值(P<0.01),并持续至注射MSU后48 h(P<0.01),而对照组大鼠足体积则无明显变化。与MGA组相比,给予0.3 mg·kg-1秋水仙碱、丹皮酚(100、200 mg·kg-1)治疗后,均使得MSU致炎48 h后的大鼠足肿胀明显减轻(P<0.05或P<0.01);但给予50 mg·kg-1丹皮酚治疗对MSU致炎48 h后的大鼠足肿胀无明显影响。与此同时,如Tab 2所示,踝关节腔内注射MSU 24 h导致大鼠步态评分数值明显增高。与MGA组相比,给予0.3 mg·kg-1秋水仙碱、丹皮酚(100、200 mg·kg-1)治疗后,均使MGA大鼠步态评分明显降低(P<0.05或P<0.01),但给予50 mg·kg-1丹皮酚治疗对MGA大鼠步态评分无明显影响。
3.2丹皮酚对MGA大鼠组织学评分和破骨细胞活化的影响如Tab 2、Fig 1所示,与对照组比较,注射MSU 48 h后,大鼠踝关节出现明显的滑膜增生、肿胀,严重者出现坏死,同时伴随有大量的炎性细胞浸润,因此模型组组织学评分数值明显升高。与此同时,注射MSU 48 h后大鼠踝关节TRAP阳性染色细胞数量也比对照组明显增加(P<0.01)。与MGA组比较,给予0.3 mg·kg-1秋水仙碱、丹皮酚(100、200 mg·kg-1)治疗则明显降低了MGA大鼠组织学评分和TRAP阳性染色细胞数(P<0.05或P<0.01),且呈剂量依赖性;但给予50 mg·kg-1丹皮酚治疗对MGA大鼠组织学评分和TRAP阳性染色细胞数均无明显影响。
3.3丹皮酚对MGA大鼠关节组织TNF-α、IL-1β和IL-6表达的影响如Tab 3、Fig 2所示,与对照组相比,注射MSU 48 h后大鼠关节组织中TNF-α、IL-1β、IL-6表达均明显升高(P<0.01)。与MGA组相比,给予0.3 mg·kg-1秋水仙碱、丹皮酚(100、200 mg·kg-1)治疗明显降低了MGA大鼠关节组织中TNF-α、IL-1β和IL-6表达,且呈现出剂量依赖性(P<0.05或P<0.01);但给予50 mg·kg-1丹皮酚治疗对MGA大鼠关节组织中TNF-α、IL-1β和IL-6表达无明显影响。

Tab 2 Effects of paeonol on gait score, histological score and osteoclast formation in MGA rats n=10)
##P<0.01vscontrol;*P<0.05,**P<0.01vsMGA

Tab 1 Effect of paeonol on paw swelling in MGA rats n=10)
##P<0.01vscontrol;*P<0.05,**P<0.01vsMGA
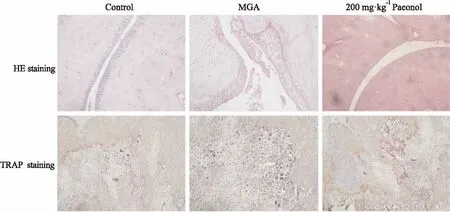
Fig 1 Effect of paeonol on histological damage and osteoclast formation in MGA rats (×100)
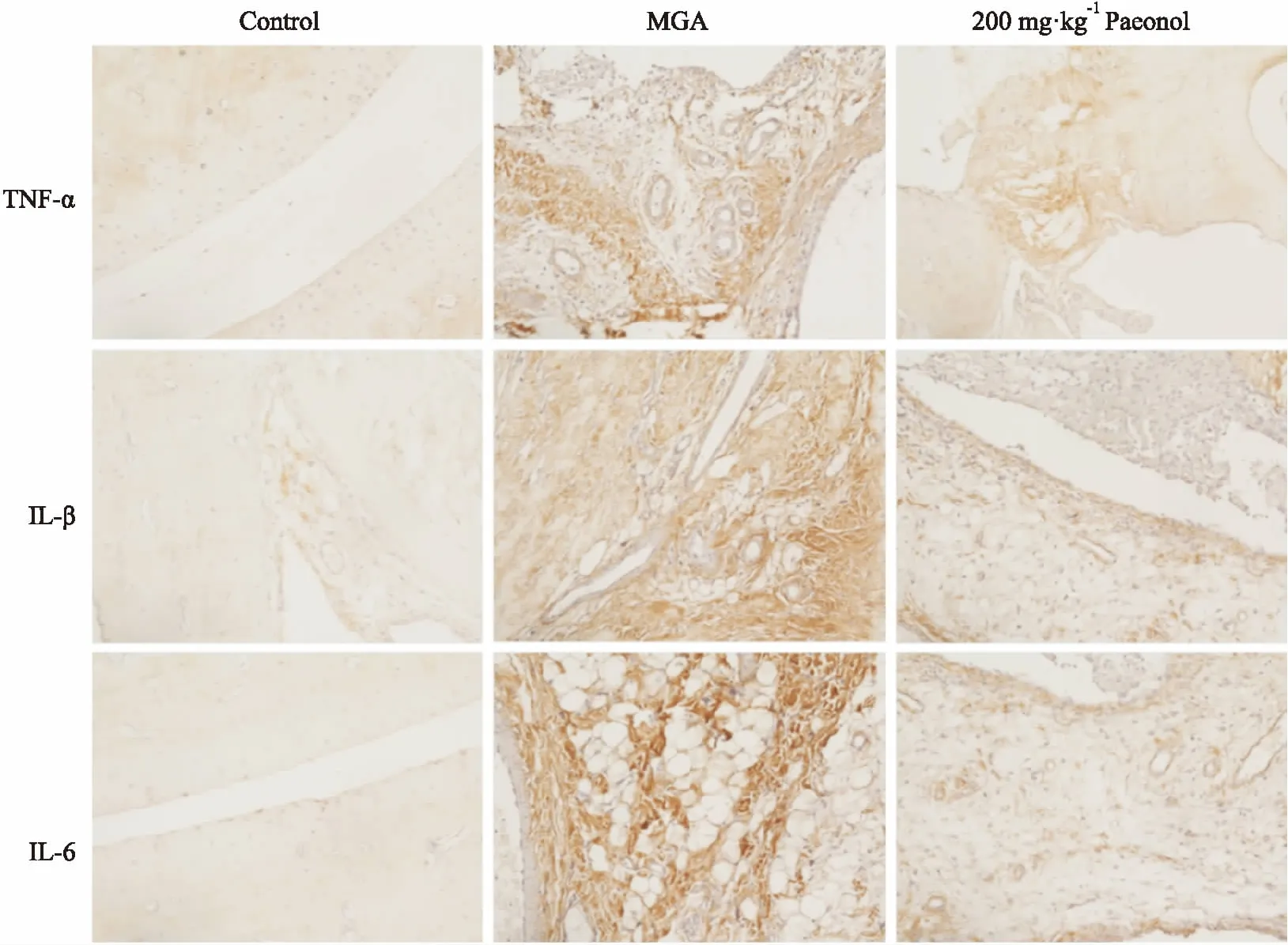
Fig 2 Effects of paeonol on expressions of TNF-α, IL-1β and IL-6 in ankle joints of MGA rats analyzed by immunohistochemistry staining (×200)
Tab 3 Effects of paeonol on levels of TNF-α, IL-1β, IL-6, p65 and IκBα in MGA rats
##P<0.01vscontrol;*P<0.05,**P<0.01vsMGA
3.4丹皮酚对MGA大鼠关节滑膜p65和IκBα蛋白水平的影响如Tab 3、Fig 3所示,与对照组相比,注射MSU 48 h后大鼠关节滑膜中p65蛋白水平明显升高,IκBα蛋白水平则明显降低(P<0.01)。与MGA组相比,给予0.3 mg·kg-1秋水仙碱、丹皮酚(100、200 mg·kg-1)治疗明显提高了MGA大鼠关节滑膜中IκBα蛋白水平(P<0.05);但给予50 mg·kg-1丹皮酚治疗对MGA大鼠关节滑膜IκBα蛋白水平无明显影响。同时,本研究中不同剂量的丹皮酚对MGA大鼠关节滑膜中p65蛋白水平均无明显影响。

Fig 3 Effects of paeonol on levels of p65 and IκBα in synovium of MGA rats n=3)
4 讨论
本研究应用大鼠MGA模型,证实了丹皮酚(100、200 mg·kg-1)可明显减轻大鼠足肿胀,改善步态评分、组织学评分和破骨细胞形成,降低关节组织中TNF-α、IL-1β、IL-6表达,提高IκBα蛋白水平,但对p65蛋白水平无明显影响。
由于近几十年痛风发病率明显上升,MSU诱导痛风炎症发生、发展的分子机制逐渐成为研究热点。MSU被证实是最强有力的促炎信号之一,其可激活巨噬细胞、单核细胞、中性粒细胞、滑膜成纤维细胞等表达促炎细胞因子、趋化因子、黏附分子和组织蛋白酶,启动痛风炎症的发生、发展和关节结构的病理损伤[9]。因此,通过向实验动物关节腔注射MSU诱导关节炎症(MGA模型)已成为国内外广泛认同和使用的痛风动物模型[10]。在本研究中,我们发现关节腔内注射MSU后6 h就快速诱导了大鼠关节肿胀,12 h关节肿胀达到峰值,注射后48 h关节肿胀仍然明显,这一结果与Silva等[20]研究结论相一致。MSU注射后的步态评分和病理评分均明显升高,提示MSU导致了关节功能障碍和组织病理损伤。给予丹皮酚治疗后,关节肿胀明显减轻,步态评分和病理评分均明显降低。破骨细胞是介导炎症状态下关节骨质破坏的主要效应细胞,这一结论在类风湿关节炎、骨关节炎、痛风性关节炎等疾病中均得到证实[11]。本研究中,我们应用TRAP染色法观察到MSU诱导激活了大量破骨细胞,而丹皮酚治疗后激活的破骨细胞数量明显减少。综合上述结果表明,丹皮酚缓解了MSU诱导的关节炎症状,改善了关节功能障碍和关节病理损伤,提示丹皮酚有抗大鼠MGA的药理作用。
由于炎症因子在痛风炎症发生、发展中扮演着关键角色,在初步证实了丹皮酚抗大鼠MGA发展的基础上,我们接着探讨了丹皮酚对MGA大鼠炎症因子表达的影响。众多的炎症因子如TNF-α、IL-1β、IL-6均在痛风炎症发展中起了关键作用,其中尤以IL-1β的作用备受关注[9]。IL-1β既可刺激多种炎性细胞表达趋化因子、黏附分子和其它促炎细胞因子,也可诱导破骨细胞活化而导致关节结构的病理损伤,还可作用于神经元,导致痛风患者对炎症疼痛过度敏感。可溶性IL-1诱饵受体列洛西普、IL-1β单克隆抗体卡那单抗均表现出优异的抗痛风疗效,更加凸显了IL-1β在痛风炎症病理过程中的核心地位[12]。本研究中,我们首先观察到MGA大鼠病变关节组织中TNF-α、IL-1β、IL-6的表达均明显升高,这一结果与文献报道基本一致,也再次证明了炎症因子在MGA发展中的核心作用[3]。以往的研究已经证实了经典抗痛风药物秋水仙碱对MSU诱导的多种炎性介质表达有抑制作用[13]。本研究中,我们也观察到秋水仙碱明显降低了MGA大鼠病变关节组织中TNF-α、IL-1β、IL-6的表达。给予丹皮酚治疗后,MGA大鼠病变关节组织中TNF-α、IL-1β、IL-6的表达都明显降低,提示丹皮酚抗大鼠MGA的药理作用与拮抗炎症因子的表达密切相关。
已有的研究结果提示,激活转录因子NF-κB是MSU诱导炎症因子表达的核心机制之一。MSU可直接结合TLR-2和TLR-4,通过多个信号转导通路促进IκBα的泛素化降解,使得p65蛋白游离并核转移,从而增加炎性细胞因子、黏附分子、趋化因子、组织蛋白酶等基因表达,促进痛风炎症的发生、发展和关节组织的病理损伤[3]。与此同时,研究人员还发现了MSU诱导NF-κB活化的另一个机制。MSU 晶体可被单核细胞、巨噬细胞等吞噬进入细胞质,通过钾离子流出、活性氧或者溶酶体损伤等机制,激活细胞质中的NALP3炎性体复合体,然后活化caspase-1,促进前体IL-1β剪切成为成熟体IL-1β并分泌至细胞外[14]。胞外的IL-1β通过与炎性细胞胞膜上相应受体结合,激活NF-κB,最终促进痛风炎症的发展。因此,我们在证实了丹皮酚抑制MGA大鼠炎症因子表达的基础上,观察了丹皮酚对MSU诱导的NF-κB活化的影响。本实验发现,MGA大鼠病变关节组织中IκBα水平明显降低,提示MSU诱导了IκBα降解,从而促进了NF-κB活化。给予丹皮酚治疗后,MGA大鼠病变关节组织中IκBα水平明显增高,提示丹皮酚阻遏了MSU诱导的IκBα降解,提高了组织中IκBα水平,从而抑制了NF-κB活化。有意思的是,我们发现丹皮酚对MGA大鼠关节组织中p65蛋白表达水平无明显影响,提示丹皮酚抑制NF-κB活化的药理作用主要是通过阻断其活化的信号途径,而非影响其表达量而实现。
综上所述,本研究证实了丹皮酚可明显抑制大鼠痛风性关节炎的发展,其机制与抑制关节组织中NF-κB活化,从而降低炎性介质表达密切相关。本研究为中医临床应用中药牡丹皮治疗痛风的科学性提供了证据,也为利用丹皮酚研发新的抗痛风药物提供了初步的药理实验依据。
(致谢:本实验在重庆工商大学重庆市天然药物研究重点实验室完成,感谢孔淑贞博士、殷钟意高级实验师给予的技术支持。)
