银椴苷抑制人胰腺癌细胞增殖的作用及机制研究
2018-12-18仲维兰鲁美钰范瑶瑶梁晓琳卢法荣徐茂磊
仲维兰,刘 红,鲁美钰,范瑶瑶,梁晓琳,张 涵,卢法荣,徐茂磊,周 玲
(1. 滨州医学院药学院“方剂效应与临床评价”国家中医药管理局重点实验室,山东 烟台 264003;2. 山东博安生物技术有限公司,山东 烟台 264670)
胰腺癌是一种危害人类消化系统的恶性肿瘤,其发病率呈逐年上升的趋势,在我国,其致死率位居恶性肿瘤第6位[1]。胰腺癌位置隐蔽,且早期症状不明显,80%的患者就诊时已属于晚期,仅有少数患者具有手术切除的机会。放疗、化疗及靶向治疗作为胰腺癌非手术治疗手段,在临床上具有重要作用。然而,胰腺癌对放疗有很高的耐受性,故临床上较少使用。吉西他滨作为胰腺癌治疗的金标准,单用或联合其他化疗药物虽延长了胰腺癌患者的生存期,但其疗效仍不尽人意[2]。Rocha等[3]认为,仅局限于吉西他滨联合其他化疗药物的治疗方案并不能有效改善胰腺癌的治疗效果。因此,寻求有效的胰腺癌治疗药物是亟待解决的问题。
胆固醇作为一种具有羟基的固体醇类化合物,是构成细胞膜的重要组成成分。另一方面,胆固醇是脂质双分子中脂筏结构的关键组成部分,通过调节脂筏结构,影响信号转导通路。恶性肿瘤细胞增殖时,胆固醇的摄取增多,合成加速[4-5]。已有研究证实,抑制胆固醇的合成和吸收能有效抑制胰腺癌细胞的增殖[6]。羟甲基戊二酰辅酶A还原酶(HMG-CoA reductase,HMGCR)是胆固醇生物合成的关键酶,参与生物体内各种内源性胆固醇的生物合成。研究表明,HMGCR抑制剂他汀类药物具有良好的抗胰腺癌作用[7]。此外,Guillaumond等[8]研究发现,通过降低参与胆固醇摄取的低密度脂蛋白受体(low density lipoprotein receptor,LDLR)的表达,可明显抑制胰腺癌细胞的增殖。
银椴苷是从仙鹤草中提取的一种黄酮糖苷类化合物。研究表明,银椴苷具有抗炎、镇痛、抗高血压、抗糖尿病等药理学活性[9-12]。然而,银椴苷抗肿瘤活性鲜有报道。我们前期实验结果已证实银椴苷具有抗胰腺癌作用,但是银椴苷是否能够抑制胰腺癌细胞增殖及其相关机制并不明确。本实验旨在研究银椴苷对胰腺癌PANC-1细胞增殖的抑制作用,并围绕胆固醇的合成和吸收在胰腺癌细胞增殖中的作用,初步探讨银椴苷抑制胰腺癌细胞增殖的作用机制,为银椴苷用于胰腺癌的防治提供理论和实验依据。
1 材料与方法
1.1材料
1.1.1细胞株 人胰腺癌PANC-1细胞购买于中国医学科学院肿瘤研究所。
1.1.2药物与试剂 银椴苷购自上海源叶生物科技有限公司;DMEM高糖培养基购自Gibco; MTT购自北京博奥拓达科技有限公司;胎牛血清购自杭州四季青生物工程材料研究所;细胞周期检测试剂盒购于南京凯基生物科技有限公司;抗细胞周期蛋白依赖性激酶1(cylin-dependent protein kinase 1,CDK1)、细胞周期素Bl(Cyclin B1)、HMGCR、LDLR抗体,购自武汉三鹰生物技术有限公司;PCR引物由上海生工生物工程有限公司合成;辣根过氧化物酶标记山羊抗兔IgG抗体,购自北京中杉金桥生物科技有限公司。
1.1.3仪器 Epoch全波长酶标仪(美国BioTek公司);BIoDoc-IT Imaging System凝胶成像系统(德国UVP公司);PCR扩增仪、电泳装置(美国Bio-Rad公司);倒置显微镜(日本Nikon公司);ESCO二级生物安全柜(新加坡ESCO公司);FACS Calibur型流式细胞仪(美国BD公司)。
1.2方法
1.2.1细胞活力检测 运用MTT法检测银椴苷对人胰腺癌PANC-1细胞生长抑制作用。将PANC-1细胞按照5×106·L-1的浓度接种到96孔板中培养过夜。24 h后,于每孔加入不同浓度的银椴苷(0、12.5、25、50、100、200 μmol·L-1)处理。培养相应时间后,每孔加入20 μL MTT溶液(5 g·L-1),于37℃、5%的CO2培养箱避光孵育,4 h后,每孔加入100 μL DMSO以溶解甲臜,待甲臜充分溶解后,利用酶标仪读取490 nm处吸光光度值,并计算细胞的存活率:细胞存活率/%=实验组吸光度值/对照组吸光度值×100%。
1.2.2细胞克隆形成实验 人胰腺癌PANC-1细胞以500个/孔铺于6孔板中,于孵育箱中过夜使其贴壁生长。次日,弃去培养基,PBS洗2次,加入不同浓度银椴苷(0、25、50、100 μmol·L-1)继续培养48 h,更换正常的培养基继续培养15 d,每隔3 d更换培养基。待有肉眼可见的细胞集落后,用PBS洗2次,4%多聚甲醛固定15 min,0.1%结晶紫染色15 min,洗净染色液,自然晾干、拍照、显微镜下计数,大于50个细胞为1个克隆数。
1.2.3细胞周期检测 将PANC-1细胞以3×109·L-1密度种于6孔板中,于37℃、含5% CO2培养箱内培养24 h,细胞贴壁生长后,加入不同浓度银椴苷(0、25、50、100 μmol·L-1)处理48 h,收集细胞于1.5 mL离心管中,利用预冷PBS洗涤细胞3次,每管加入70%冷乙醇500 μL,缓慢吹成细胞悬液,4℃固定过夜,染色前用1 mL预冷PBS洗涤细胞2次以去除固定液,加入500 μL PI/RaseA染料,混匀,室温避光染色30 min,运用流式细胞仪检测PANC-1细胞周期的分布。
1.2.4Western blot 检测CDK1、Cyclin B1、HMGCR、LDLR 蛋白表达变化 PANC-1细胞经不同浓度的银椴苷处理48 h后,弃去培养基,预冷的PBS洗涤细胞2次,每孔加入适量RIPA与蛋白磷酸酶抑制剂混合液(RIPA ∶蛋白磷酸酶抑制剂=100 ∶1),4℃裂解30 min,12 000 r·min-1低温离心20 min,收集上清液于1.5 mL EP管内。BCA法测定蛋白的浓度。取100 μg蛋白进行SDS-PAGE凝胶电泳。电泳结束后,利用湿转法将蛋白转到NC膜上,5%的脱脂牛奶封闭4 h,分别加入CDK1、Cyclin B1、HMGCR、LDLR、β-actin 抗体,4℃孵育过夜,TBST洗膜3次,加入二抗,室温孵育2 h,TBST 洗膜3次,加入ECL试剂,显影,用Image J软件进行灰度值分析。
1.2.5RT-PCR检测mRNA水平的变化 利用TRIzol提取PANC-1细胞总RNA,利用核酸测定仪测定RNA的含量和纯度。根据总RNA的含量,按照试剂盒说明将其逆转为cDNA,以cDNA为模板进行PCR扩增。PCR的反应条件:95℃预变性5 min,95℃变性30 s,60℃退火30 s,72℃延伸1 min,共34个循环,最后72℃延伸5 min。琼脂糖凝胶电泳。引物序列见Tab 1。

Tab 1 Primers sequences used for RT-PCR reactions

2 结果
2.1银椴苷对人胰腺癌PANC-1细胞的生长抑制作用不同浓度银椴苷(0、12.5、25、50、100、200 μmol·L-1)处理PANC-1细胞24、48、72 h后,用MTT法检测细胞活力。如Fig 1所示,与对照组相比,银椴苷处理组的细胞存活率明显减少,且呈时间和浓度依赖性。
2.2银椴苷对PANC-1细胞克隆形成能力的影响细胞克隆形成可反映细胞的增殖能力和致瘤性。如Fig 2所示,经不同浓度银椴苷(25、50、100 μmol·L-1)处理后,PANC-1细胞克隆形成能力明显减弱,表明银椴苷可抑制PANC-1细胞克隆形成能力。
2.3银椴苷对PANC-1细胞周期的影响采用流式PI单染,检测银椴苷对PANC-1细胞周期的影响。如Fig 3所示,PANC-1细胞经银椴苷(25、50、100 μmol·L-1)处理48 h后,细胞阻滞在G2/M期。与对照组相比,银椴苷(25、50、100 μmol·L-1)处理PANC-1细胞48 h后,G2/M期的细胞分别增加至(14.37±1.21)%、(27.9±3.20)%、(38.09±2.76)%。表明随着银椴苷浓度的升高,处于G2/M期细胞明显增加。

Fig 1 Effects of different concentrations of tiliroside onviability of PANC-1 cells measured by n=5)
2.4银椴苷对PANC-1细胞中CDK1和CyclinB1表达的影响Cyclin B1与CDK1结合,参与G2/M期控制点的调控,从而推动细胞周期的进行。为此,本研究运用Western blot检测银椴苷是否影响Cyclin B1与CDK1蛋白的表达。结果如Fig 4所示,银椴苷(25、50、100 μmol·L-1)处理48 h后,PANC-1细胞中Cyclin B1蛋白表达下调,同时CDK1的表达也明显下调。这进一步证实,细胞周期阻滞是银椴苷抑制PANC-1细胞增殖的重要因素。

Fig 2 Effects of tiliroside on colonyA: The images of the colonies; B: Number of colonies.*P<0.05,**P<0.01 vs control group

Fig 3 Effects of tiliroside on cell cycle of PANC-1 n=3)
2.5银椴苷对PANC-1细胞中HMGCR与LDLR表达的影响已有研究表明,胰腺癌细胞增殖与细胞内胆固醇水平密切相关。因此,本研究运用RT-PCR和Western blot检测了银椴苷对PANC-1细胞中胆固醇合成的限速酶HMGCR及胆固醇吸收关键蛋白LDLR表达的影响。结果表明,银椴苷(25、50、100 μmol·L-1)处理PANC-1细胞48 h后,细胞中HMGCR、LDLR mRNA和蛋白表达下调。以上结果提示,银椴苷抑制PANC-1细胞增殖可能与其下调HMGCR与LDLR的表达有关(Fig 5)。
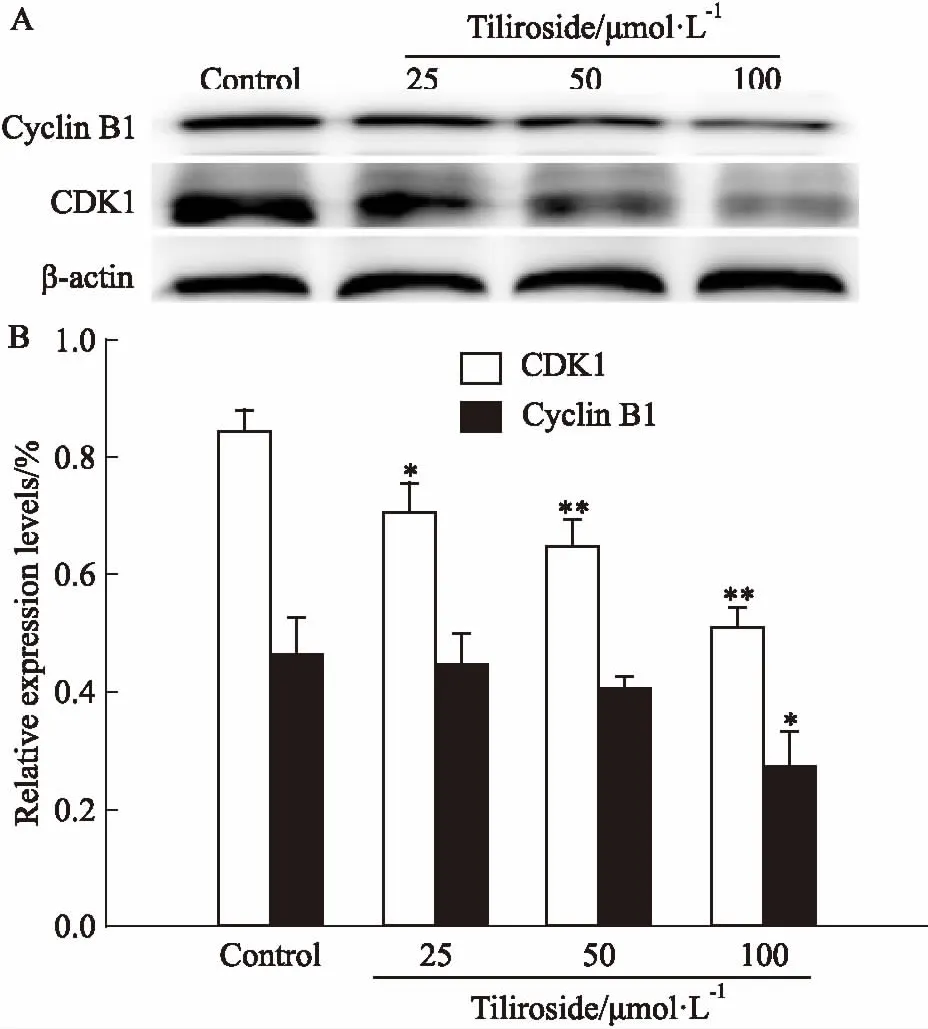
Fig 4 Effects of triliside on expression of CDK1and Cyclin B1 in PANC-1 n=3)
*P<0.05,**P<0.01vscontrol group
3 讨论
在抗肿瘤药物发现过程中,天然产物起着重要的作用。据统计,约有2/3的抗肿瘤药物来源于天然产物。银椴苷是来源于仙鹤草的一种黄酮糖苷类化合物。研究表明,银椴苷具有抗糖尿病、抗高血压、抗氧化等药理学作用[9-12],但银椴苷抗胰腺癌作用尚未见报道。本研究中,MTT实验结果表明,银椴苷可抑制PANC-1细胞增殖,平板克隆实验结果显示,银椴苷能明显抑制PANC-1细胞的克隆形成能力,这进一步说明银椴苷可抑制胰腺癌细胞的增殖。
细胞周期阻滞是药物抑制细胞增殖的重要方式之一[13-14]。本研究中对细胞周期的检测结果表明,银椴苷可以将PANC-1细胞阻滞在G2/M期。CDK1与Cyclin B1是细胞周期由G2期过渡到M期的关键蛋白。Western blot结果表明,银椴苷能抑制CDK1和Cyclin B1蛋白的表达。以上结果提示,诱导G2/M期细胞周期阻滞可能是银椴苷抑制人胰腺癌PANC-1细胞增殖的重要原因。

Fig 5 Expression of LDLR and HMGCR mRNA(A) andprotein(B) in PANC-1 after tiliroside treament for 48
*P<0.05,**P<0.01vscontrol group
通过肿瘤细胞代谢异常的研究发现,增殖迅速的肿瘤细胞的一个明显代谢特点为脂质生成增多[15]。胆固醇是细胞膜的关键组成部分,其摄入或合成过多在肿瘤的发生、发展中发挥着重要作用[4-5]。细胞内胆固醇水平取决于胆固醇的内源性合成和外源性摄取,其中HMGCR是胆固醇内源性合成的限速酶。研究表明,HMGCR抑制剂他汀类药物具有抗胰腺癌作用[7]。此外, Guillaumond等[8]研究发现,敲除LDLR能有效抑制胰腺癌细胞增殖。我们的研究发现,银椴苷能在mRNA和蛋白水平抑制HMGCR及LDLR的表达。这表明抑制HMGCR及LDLR的表达,降低人胰腺癌PANC-1细胞内胆固醇水平可能是银椴苷诱导人胰腺癌PANC-1细胞发生细胞周期阻滞的重要原因。
综上所述,银椴苷可抑制人胰腺癌PANC-1细胞的增殖,并伴随着G2/M期细胞周期阻滞,其机制可能与银椴苷抑制胆固醇内源性合成限速酶HMGCR及胆固醇外源性摄取关键蛋白LDLR表达有关。该研究结果将为银椴苷开发成为抗肿瘤药物提供理论和实验依据。
(致谢:衷心感谢滨州医学院药学院新药技术开发中心的老师和同学的热心帮助。)
