超临界机组给水加氧处理对流动加速腐蚀影响的研究
2018-12-17肖卓楠白冬晓陈伟鹏
肖卓楠, 白冬晓, 徐 鸿, 陈伟鹏, 李 科
(1.华北电力大学 能源动力与机械工程学院,北京 102206;2.内蒙古科技大学 能源与环境学院,内蒙古包头 014010)
据统计数据表明,国际上许多核电站和大型电厂都出现了流动加速腐蚀(FAC)现象,且发生FAC的管道约占电站管道的33%,在所有的管道失效形式中名列第一位[1]。FAC是由于电厂管道基体及表面的疏松氧化膜被单相或两相的流动工质溶解而造成的管道内表面逐渐减薄的一种现象,FAC主要发生在电厂的给水系统管道中,表现为管道结垢速率加快、阀门堵塞、锅炉压差增大和金属基体减薄,严重时会引起管道爆裂事故,高温工质泄露,机组非计划停运,造成巨大的经济损失。因此,抑制汽水管道内表面FAC现象的发生对电力行业的发展至关重要。
目前,采用化学水控制可以有效减缓甚至抑制管道FAC现象的发生[2],电厂给水加氧处理是管道腐蚀与防护的重要环节。然而在加氧处理工况下化学水因素控制不当时,对锅炉受热面、汽轮机通流部分和精处理装置都存在负面影响,目前给水加氧技术并不成熟,为了抑制管道FAC的发生,使机组安全、稳定运行,需要严格控制给水加氧的条件。笔者根据电厂实际运行中的电化学因素对可溶性Fe组分的影响以及电化学因素之间的相互影响,确定了超临界机组给水加氧处理工况下合适的工艺控制条件,优化了给水加氧技术,可为超临界机组实行给水加氧处理提供依据。
1 流动加速腐蚀的电化学腐蚀过程
FAC是由电化学腐蚀过程与腐蚀产物的扩散、传质和沉积等物理冲刷腐蚀过程共同作用产生的金属损耗现象[3]。
电化学反应过程是形成电厂管道FAC的主要过程,该过程中会发生一系列微观的电化学反应与化学反应,包括金属基体Fe的电离、金属基体表面氧化膜的形成与化学溶解。首先金属基体表面的磁性氧化膜疏松、多孔,金属基体与水溶液接触,金属基体Fe与水溶液形成了原电池,Fe发生电离,失去电子生成Fe2+,部分Fe2+与少量金属基体Fe在水溶液氧化剂的作用下发生化学反应形成磁性Fe3O4氧化膜。Fe3O4氧化膜具有渗透性和微溶性,在水中会发生化学溶解,使得氧化膜的厚度不断变薄、间隙度增大,对管道金属基体的保护作用减弱,同时增强了金属基体Fe的电离,使管壁减薄,FAC速率加快[4]。
图1为FAC的电化学反应示意图,主要的电化学反应或化学反应有:

(1)

(2)

(3)

(4)

(5)

(6)

(7)
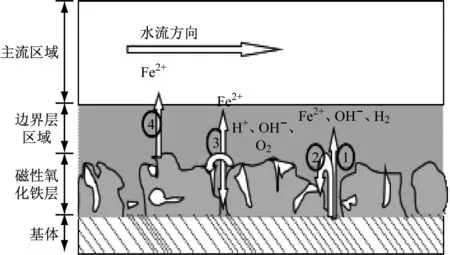
图1 FAC机理示意图
2 预防流动加速腐蚀的化学水处理方式
为了减缓或抑制FAC现象,电厂都采用了比较经济、有效的化学水处理方式,化学水处理的方式有还原性全挥发处理(AVT(R))、弱氧化性全挥发处理(AVT(O))和给水加氧处理(OT)。向给水中加氨和联氨的处理方式称为还原性全挥发处理,只加氨不加联氨的给水处理方式称为弱氧化性全挥发处理,向给水中加入氧的处理方式称为给水加氧处理。而给水加氧加氨的联合处理(CWT)是对FAC抑制作用最全面、有效的一种OT处理方式。目前大型超(超)临界机组都进行了给水加氧加氨的联合处理。
2.1 给水加氧处理的原理
给水加氧技术的原理是在给水水质高度纯净(氢电导率小于0.15 μs/cm,目标值为0.10 μs/cm)的条件下增加给水的溶解氧质量浓度[5](以下简称溶解氧含量),提高汽水的pH值,进而在热力设备的金属表面产生金属钝化作用,使金属表面形成双层氧化膜,内伸层是紧贴金属基体表面的磁性Fe3O4氧化膜,外延层为致密的保护层Fe2O3与水合氧化铁FeOOH氧化膜。氧化膜的分布如图2所示。致密的氧化膜阻碍了电化学反应的进行,减少了Fe2+的扩散,降低了FAC速率。

图2 加氧处理工况下氧化膜结构图
2.2 给水加氧处理的优势
管道发生FAC时的主要腐蚀产物为Fe2+,然而电厂运行时监测的可溶性Fe组分是水中的全铁含量,无法实现对Fe2+的实时监测,因此Fe质量浓度高低反映了电厂管道的腐蚀程度,可溶性Fe组分的变化是评价化学水处理效果最直观的指标。
以内蒙古岱海发电有限责任公司的1号机组和河北国华沧东发电有限责任公司的3号机组为研究对象,根据1号机组汽水品质监督记录表,绘制了图3所示的亚临界机组给水系统Fe质量浓度变化图。根据3号机组汽水系统查定报告,绘制了图4所示的超临界机组给水系统Fe质量浓度变化图。

图3 亚临界机组给水系统Fe质量浓度变化图
1号机组是600 MW亚临界机组,采用汽包炉。该机组近期一直采用的是弱氧化性全挥发处理方式,只通过热力除氧(即保证除氧器运行正常)但不再加除氧剂进行化学辅助除氧,使Fe的电极电位处于Fe2O3与Fe3O4的混合区[6],氧化性较弱。由图3可以看出,电厂实时监测的给水管道中的Fe质量浓度普遍较高,平均值达到4.15 μg/L,说明其给水管道FAC速率较大,容易发生FAC现象。

图4 超临界机组给水系统Fe质量浓度变化图
3号机组是660 MW超临界机组,采用直流锅炉。该机组先采用的是给水加氧加氨的联合处理方式,使管内壁生成致密的、溶解度小的赤铁矿物质氧化膜,并将疏松的Fe3O4锈层表面均匀覆盖起来[7],由图4可以看出,电厂实时监测的整个水处理过程中Fe质量浓度较低,只达到1 μg/L左右,给水管道FAC速率小,几乎不发生FAC现象。
9月24号至10月18号因机组启停进行了加氧投退,机组启动后先进行给水还原性全挥发处理,此时的Fe质量浓度呈上升趋势,最大值达到3.6 μg/L,是加氧处理时给水中Fe质量浓度的3~4倍,腐蚀更严重。为了抑制管道发生FAC,当给水水质达到加氧要求后,进行给水加氧处理,省煤器入口的溶解氧含量维持在30~150 μg/L,此时Fe质量浓度不断下降,FAC速率降低。
结合图3和图4可知,由于600 MW亚临界机组与660 MW超临界机组采用了不同的化学水处理方式,Fe质量浓度也不同,亚临界机组给水系统Fe质量浓度明显大于超临界机组给水系统Fe质量浓度,说明给水加氧处理能够降低给水中的Fe质量浓度和FAC速率,有效地抑制了管道的FAC现象。弱氧化性全挥发处理方式的抑制作用较弱,腐蚀防护效果较差。
综上所述,给水加氧处理方式对FAC的抑制效果明显优于还原性全挥发处理方式和弱氧化性全挥发处理方式,电厂采用给水加氧技术更具有优越性。
3 流动加速腐蚀的电化学影响因素
由FAC的机理分析可知,FAC是一个非常复杂的物理和电化学过程,因此影响碳钢管道腐蚀的主要因素可以分为物理因素和电化学因素,物理因素是指影响Fe2+扩散、传质等物理过程的因素,如流速和流动状态等。电化学因素是指影响FAC电化学反应过程的因素,如H+、O2浓度及阴离子杂质都参与了电化学反应过程。由2台机组的调研数据可知,pH值、溶解氧含量和氢电导率都会影响FAC速率[8]。
3.1 溶解氧含量对给水系统FAC的影响
根据调研与采集到的3号机组的数据,绘制给水管道中溶解氧含量与Fe质量浓度的关系图(见图5)。

图5 超临界机组给水中溶解氧含量与Fe质量浓度关系图
3号机组省煤器入口的溶解氧含量是按照DL/T 805.4—2016 《火电厂汽水化学导则》中的直流锅炉给水加氧处理标准进行的,溶解氧含量控制在30~70 μg/L,由图5可知,在溶解氧含量控制范围内,随着溶解氧含量的增大,给水中Fe质量浓度降低,管道和氧化膜表面溶解了较少的Fe2+,说明FAC速率逐渐降低。当溶解氧含量为60~70 μg/L时,Fe质量浓度降到1 μg/L以下,给水管道的FAC现象受到抑制,因此当溶解氧含量控制在60~70 μg/L时,管道几乎不发生FAC现象。
3.2 pH值对给水系统FAC的影响
3号机组进行给水加氧处理时pH值控制在8.8~9.1,给水管道中检测到的Fe质量浓度会随着pH值的变化而变化。给水pH值与Fe质量浓度的关系见图6。
对于pH值的控制,超临界机组在进行给水加氧处理时也加入氨气NH3进行pH值调节,加入氨气的浓度越大,pH值就越大,同时随着pH值的增大,Fe质量浓度呈下降趋势。表明给水加氧处理工况下pH值控制在8.8~9.1时,pH值越大,对抑制管道发生FAC现象越有利,FAC速率越低。
虽然汽车金融在我国取得了长足的发展,但是与欧美等发达国家相比,还相对落后。由于受我国传统消费观念的限制,大部分人在购买汽车的时候,不会选择贷款。据统计在欧美地区4S店金融渗透率已达到80%以上,远超我国40%的比例,可见汽车金融在我国的发展还有巨大的上升空间。

图6 超临界机组给水pH值与Fe质量浓度的关系
由图6可知,由于3号机组进行了加氧处理,增大pH值对Fe质量浓度的影响较小,当pH值在8.8~9.1时, Fe质量浓度出现微小变化,整体Fe质量浓度较低。说明在有氧的给水中,碳钢的FAC速率受pH值的影响较小,溶解氧含量成为控制FAC的主要因素,给水中Fe质量浓度在pH值为8.9时最低,碳钢的FAC速率缓慢,并且不再随着pH值的增大而有所改变。
3.3 氢电导率对给水系统FAC的影响
氢电导率是表征给水水质情况的物理量,其大小直接反映了水中阴离子杂质的数量,氢电导率测量是指被测水样经过氢型阳离子交换树脂,将阳离子去除,水样中仅留下阴离子(Cl-、SO42-、HCO32-)和相应的氢离子,而水中的氢氧根离子则与氢离子中和被消耗掉,不参与反应。假设某种离子占主导,则可以根据氢电导率估算这种离子的最大浓度[9],以及整个有害阴离子的控制水平。
给水氢电导率越大,说明在管道中有大量的阴离子存在,某些阴离子会在有氧条件下与金属基体电离出来的Fe2+发生如下反应:

(8)
阴离子杂质破坏了正常磁性Fe3O4氧化膜的生成,也消耗了水中的溶解氧,产生其他可溶性含Fe杂质,对管道产生不利影响。
根据3号机组的汽水系统检测数据,得到给水氢电导率对Fe质量浓度的影响(见图7)。
溶液中一些阴离子(如Cl-)能够与各个界面的Fe2+反应,但在降低Fe2+含量的同时也生成了其他可溶性含铁物质,且减小了氧化膜的厚度,反而促进了金属基体表面Fe的电离,因此给水氢电导率也是重要的监测对象,在进行加氧的化学水处理时需要对其进行严格的控制。由图7可知,当氢电导率大于0.08 μs/cm时,给水中Fe质量浓度升高至2~3 μg/L。所以随着氢电导率的增大,给水中的Fe质量浓度越大,在加氧处理时,要得到较低的FAC速率,在控制加氧量的同时,还需要保持给水较小的氢电导率,其值保持在0.06~0.08 μs/cm最佳。
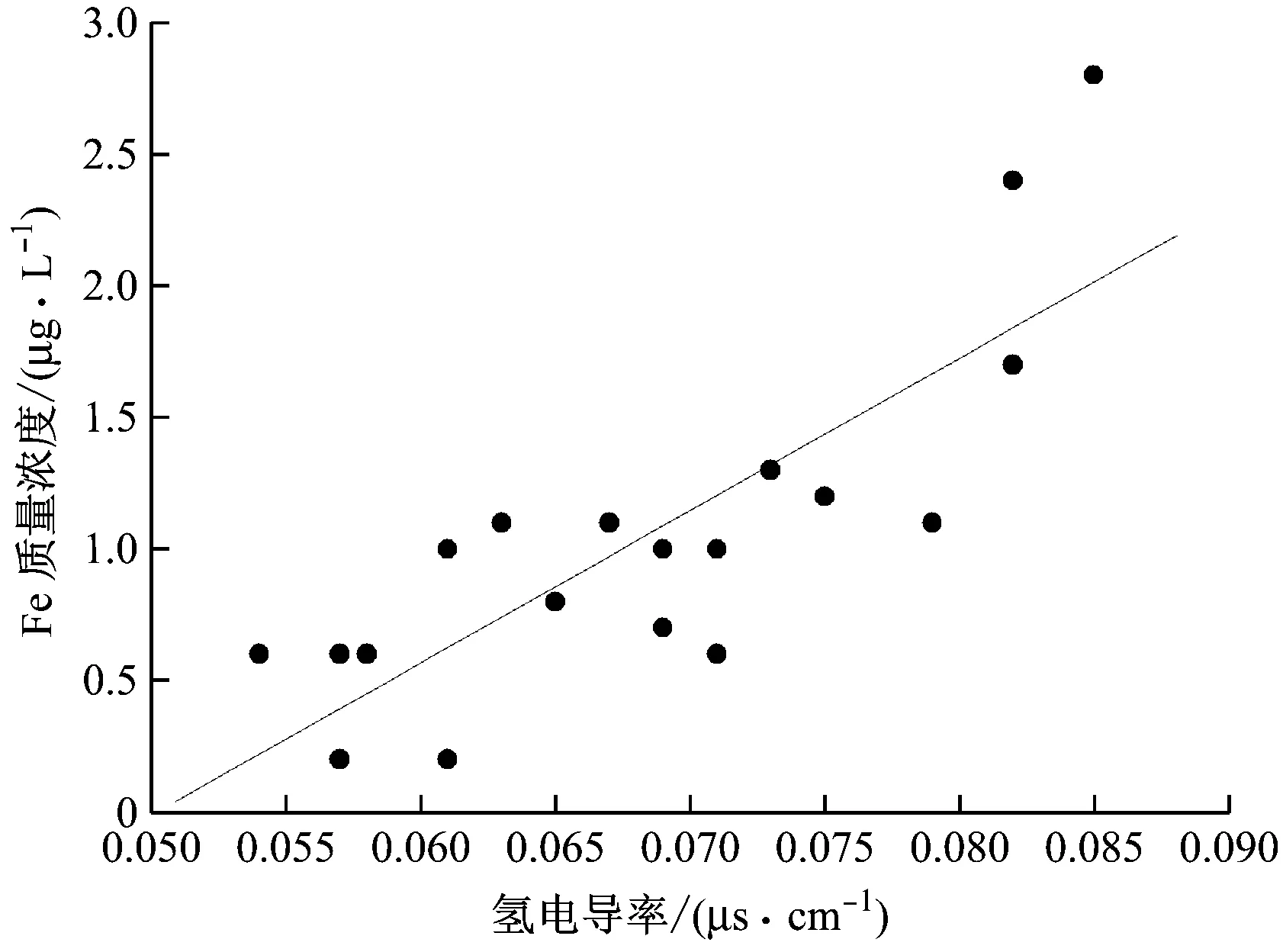
图7 超临界机组给水氢电导率对Fe质量浓度的影响
4 电化学因素之间的相互影响
4.1 pH值对临界溶解氧含量的影响
临界溶解氧含量是指能刚好将磁性氧化膜Fe3O4溶解与金属基体腐蚀产生的Fe2+全部转化为Fe3+的主流区溶解氧含量,是能够有效抑制管道FAC的最小溶解氧含量。加氧量与给水溶解氧含量相对应,加氧量越多,溶解氧含量越高,最佳加氧量是给水溶解氧含量达到临界值时的加氧量。而且只要能有效抑制管道FAC,投入的氧气量越少越好。
根据国内外学者已建立的确定临界溶解氧含量的数学模型,在合理的假设(即水流均匀稳定地沿管道方向流动)下,得出临界溶解氧含量Ccr,O2的计算公式[10]:
(9)
式中:DFe、DO2分别为Fe和溶解氧的扩散系数,由相应工质的热物性表查得;SFe为Fe的热力学溶解度,pH值对溶解度的影响很大。
表1给出了省煤器入口温度为T=530 K时,不同给水pH值下的临界溶解氧含量计算值。

表1 不同pH值下的临界溶解氧含量

4.2 溶解氧含量对氢电导率的影响
给水中进行加氧处理能够使易溶解的部分Fe3O4氧化膜转化为稳定的Fe2O3氧化膜,但原先Fe3O4氧化膜中存在含碳化合物,微孔中有阴离子存在,氧化膜进行转换、发生物相变化时,释放出的含碳化合物也可能被氧气氧化,形成了有机酸和CO2,微孔中也有大量的阴离子挤出,从而导致氢电导率增大。

图8 pH值对临界溶解氧含量的影响
溶解氧含量的提高能够抑制管道FAC现象,但给水氢电导率也会随着溶解氧含量的减小而逐渐增大,过高的溶解氧含量(大于60 μg/L)对应的氢电导率较大,如图9所示。按照3号机组的氢电导率变化趋势,其变化斜率为0.000 45。此时当溶解氧含量达到100 μg/L时,氢电导率为0.10 μs/cm,而采用给水加氧处理时氢电导率的目标值为0.10 μs/cm,为了使氢电导率控制在目标值之内(小于0.10 μs/cm),给水溶解氧含量的上限应为70 μg/L,因此超临界机组采用给水加氧处理时的溶解氧含量应该控制在60~70 μg/L。

图9 溶解氧含量对氢电导率的影响
5 结 论
(1)给水加氧处理方式能够降低FAC速率,有效地抑制管道FAC现象,给水加氧处理工况下的防腐效果优于全挥发处理工况。
(2)给水管道中发生FAC是一个复杂的过程,溶解氧含量、pH值和氢电导率都会影响FAC速率,在工况允许的条件下增大溶解氧含量和pH值、减小氢电导率将降低FAC速率。
(3)电化学因素如溶解氧含量、pH值和氢电导率都存在一个最佳范围,超临界机组给水加氧处理工况下pH值应控制在8.8~9.1,氢电导率应控制在0.06~0.08 μs/cm,溶解氧含量应控制在60~70 μg/L。
(4)临界溶解氧含量与pH值有关,随着pH值的增大,临界溶解氧含量逐渐减小。由公式计算得到的临界溶解氧含量与电厂运行时低给水中Fe质量浓度的溶解氧含量吻合较好,误差只有9.83%。因此可由公式计算不同pH值下的临界溶解氧含量,再根据临界溶解氧含量指导电厂给水泵入口的加氧量。
