肾病型肠内营养制剂用于终末期肾病合并消化道出血的研究
2018-12-17颜梅芳陆银凤仇何芬邓彬
颜梅芳 陆银凤 仇何芬 杨 晨 邓彬
终末期肾病(end-stage renal disease, ESRD)患者存在严重的肾功能不全,机体正常代谢功能丧失,蛋白质和脂质紊乱,多存在营养不良风险[1]。另外,ESRD患者体内大量毒素直接经胃肠道排泄,损害胃肠黏膜的屏障作用[2],最终导致消化道溃疡和破裂,引起出血,加重营养不良。而加强营养管理不仅有助于改善患者生活质量,还可保护胃肠黏膜,增强机体免疫功能[3]。但目前临床尚缺乏对ESRD合并消化道出血患者规范化的营养管理方案。近年来本院将肾病型肠内营养(enteral nutrition, EN)制剂干预方案用于ESRD合并消化道出血患者,获得一定效果,现报道如下。
资料与方法
一、 一般资料
纳入2013年1月至2015年1月本院70例ESRD合并消化道出血患者作为研究对象。采用随机数字表法将70例患者分为观察组和对照组,每组35例。观察组男21例,女14例;年龄(58.94 ± 7.16)岁;原发疾病:慢性肾小球肾炎11例,肝肾综合征10例,糖尿病肾病8例,高血压肾病6例;病程(3.41 ± 0.87)年;消化道出血Forrest分级[4]:Ⅰa级7例,Ⅰb级16例,Ⅱa级8例,Ⅱb级4例。对照组男19例,女16例;年龄(60.03 ± 8.22)岁;原发疾病:慢性肾小球肾炎13例,肝肾综合征10例,糖尿病肾病7例,高血压肾病5例;病程(3.38 ± 1.04)年;消化道出血Forrest分级:Ⅰa级5例,Ⅰb级14例,Ⅱa级9例,Ⅱb级7例。两组的性别、年龄、原发病、病程及消化道出血严重程度比较,差异均无统计学意义(P> 0.05)。
二、入选标准
1. ESRD诊断标准[5]
①患者肾脏损伤病史 > 3个月;②临床可见恶心呕吐、发力水肿、胸闷等尿毒症症状;③肾小球滤过率 < 15 mL/(min·1.73 m2)。
2. 纳入标准:
①符合ESRD诊断标准;②患者均签署知情同意书,并经我院医学伦理委员会批准。
3. 排除标准
①合并有严重肺部感染、腹膜炎、心衰患者;②外伤或其他原因引起的消化道出血;③恶性肿瘤患者。
三、 营养干预方案
两组患者入院后均根据出血严重程度依次给予质子泵抑制剂及内镜止血,对于Hb < 70 g/L患者给予输血。对照组给予常规营养干预,向患者和家属发放健康手册,对患者进行营养宣教,根据医嘱给予营养支持。观察组在此基础上开展肾病型EN制剂干预:①热量管理,收集患者年龄、体重、身高等基本资料;每天计算基础热量(basal metabolic rate, BMR)[6],男[66 + 13.7×体重(kg)+5×身高(cm) - 6.8×年龄(岁)],女[655+9.6×体重(kg)+1.8×身高(cm) - 4.7×年龄(岁)];总热量 = BMR×1.375。根据总热量分3 ~ 5次补充。肾病型EN制剂由糖类(72%)、蛋白质(11%)、脂肪(12%)、膳食纤维(3%)及谷氨酰胺(2%)构成。采用实物交换份法评估患者热量补给量,在患者禁食期间可通过静脉滴注葡萄萄补充热量。②其他管理,严格限制钠盐摄入,每日钠盐摄入2 ~ 4 g,每日饮水量为(前日尿量 + 500 mL) ×2/3。
四、观察指标
①分别在干预前(入院时)和干预后(出院前1 d)清晨空腹采集肘静脉血,采用BK-500型全自动分析仪(济南来宝医疗器械有限公司提供)检测血红蛋白(haematoglobin, Hb)、血清白蛋白(albumin, Alb)、前白蛋白(prealbumin, PAB)及转铁蛋白(transferring, TRF)水平。②分别在干预前后采用肾病相关生活质量评价量表(kidney disease quality of life short form 1.3, KDQOL-SFTM1.3)记录两组患者生活质量[7],该量表包括一般健康相关生存质量(the 36-item shot form health survey, SF-36)和肾病相关生活质量(kidney disease targetd areas, KDTA)两个部分。SF-36包括生理功能、生理职能、躯体疼痛、一般健康状况、精神健康、情感职能、社会功能、精力8个维度,共36个条目,KDTA包括透析症状、肾脏病影响、肾脏病负担、认知功能、工作状态、性功能、社交质量、睡眠、社会支持、透析人员支持及患者满意度共11个维度,43个条目。每个条目按Likert 5级评分法1 ~ 5分计分,然后换算成百分制,得分越高,生活质量越好。③记录两组患者住院期间消化道出血止血时间和再出血次数。
五、统计方法
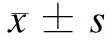
结 果
一、两组营养状态比较
两组均未发生院内死亡病例,观察组干预后Hb、Alb、PAB及TRF水平显著高于对照组和干预前,差异均有统计学意义(P< 0.05),见表1。
二、两组患者生活质量比较
观察组干预后KDTA和SF-36评分显著高于对照组,差异有统计学意义(P< 0.05),见表2。

表1 两组营养状态比较
注:*与干预前比较,P< 0.05。

表2 两组生活质量比较分)
注:*与干预前比较,P< 0.05。
三、两组消化道出血相关指标比较
观察组止血时间为(24.08 ± 5.03)min,显著短于对照组的(32.79 ± 4.15)min,差异有统计学意义(t=7.902,P=0.000)。住院期间,观察组患者均未发生再出血,再出血发生率低于对照组的5.71%(2/35),但两组间比较,差异无统计学意义(连续校正χ2=0.515,P=0.473)。
讨 论
ESRD患者多伴有不同程度的营养不良,ESRD患者肾脏正常代谢和合成功能丧失,氨基酸、脂肪酸、肽类激素合成减少[8],在体内氨基酸供给不足或不能被氨基甲酰化时,导致蛋白质合成障碍。另外,透析液中乳酸盐等成分可能进一步损害肝细胞功能,抑制TRF合成。消化道出血是ESRD常见并发症,出血发生后不仅增加蛋白质的分解代谢[9],还可能进一步加重消化道症状,形成恶性循环,导致营养状况进行性恶化。因而,强化营养管理,对纠正患者营养不良状态,控制消化道出血具有重要意义。
本研究根据慢性肾脏病蛋白质营养专家共识意见,按体重、身高、年龄的不同计算每日热量需求量,采用肾病型EN营养制剂管理方案在改善患者营养状态方面取得显著效果。ESRD患者存在脂质代谢紊乱和高蛋白消耗的特点[10],因而合理补充蛋白质和脂质才能保证能量供给,纠正代谢性酸中毒,避免负氮平衡[11],是ESRD营养管理的关键。目前临床对ESRD蛋白摄入仍存在争议,有学者提出低蛋白饮食有助于延迟ESRD的进展[12],改善预后。笔者认为ESRD患者营养不良发生率高,维持性血液透析治疗期间可能进一步导致蛋白质和氨基酸的丢失,因而ESRD补充蛋白质十分必要,使必需氨基酸相互补充[13],符合机体需求,提高蛋白质的营养价值。肾病型EN制剂氮源来自动物蛋白,与人体氨基酸结构相近,制剂中所含必须脂肪酸可直接被小肠吸收利用,改善患者营养水平,本研究也显示观察组干预后Alb、PAB及TRF显著高于对照组,提示肾病型EN制剂营养管理有助于改善患者营养状态。付艳娜等[14]还认为肾病型EN制剂中的膳食纤维和谷氨酰胺有助于保护胃肠黏膜,抑制消化道炎症,这可能是肾病型EN制剂减少再出血率的原因之一。但研究显示两组间比较,差异无统计学意义,可能与样本量小有关。
另外,要对ESRD合并消化道出血患者微量元素的摄入进行管理,低盐低钾饮食对SERD患者十分重要,减少钠盐摄入有助于减少透析超滤量[15],而高钾血症是肌肉无力和心脏骤停的重要诱因,尤其是在透析治疗期间,高钾血症可导致代谢性酸中毒[16],因而对于香蕉、葡萄等富含钾的水果应避免摄入。ESRD患者营养状态与生活质量密切相关,SF-36和KDTA是肾脏病的专用生活质量评定量表,具有较高的信度和信度[17],本研究显示干预后观察组SF-36和KDTA评分显著高于对照组,说明肾病型EN制剂管理对改善患者生活质量具有重要价值,张平花等[18]还认为肾病型EN制剂有助于改善代谢性酸中毒症状,纠正高钾血症和电解质紊乱,并为胃肠黏膜提供营养,促进胃肠功能恢复,这对改善患者生活质量具有重要意义。
综上所述,肾病型EN制剂用于ESRD合并消化道出血患者有助于改善ESRD患者生活质量和营养状态,控制消化道出血。
