TRPV6对结肠癌SW480细胞生物学行为及小鼠模型中结肠肿瘤发生的影响*
2018-12-17谢臣武刘模荣董辉徐靖宇谢睿文国荣刘莲花
谢臣武 刘模荣 董辉 徐靖宇 谢睿 文国荣 刘莲花
结肠癌是一种常见的消化系统疾病,严重威胁着人类健康及生命,近年来结肠癌的发病率及死亡率也呈逐年增长的趋势,且预后不佳[1-2]。研究发现Ca2+作为信号传导介质,参与肿瘤细胞的分裂、生命周期及分化的调节[3-5],还有研究发现细胞内Ca2+的浓度变化与结肠癌的发生具有重要关系[6]。瞬时受体阳离子通道亚家族V成员6(transient receptor poten⁃tial cation channel,subfamily V member 6,TRPV6)作为一种瞬时受体电位通道,对Ca2+具有高度的选择性及调控性,其功能受1,25(OH)2D3、Ca2+、Cu2+、Cd2+、Zn2+及雌激素等的调节,与结肠癌细胞增殖、凋亡及侵袭密切相关[7-8]。本课题组前期研究发现,1,25(OH)2D3、CuCl2能调节TRPV6蛋白及mRNA的表达,使结肠癌SW480细胞内Ca2+水平发生相应的变化,从而影响结肠癌SW480细胞的增殖、迁移及凋亡[9]。为进一步研究TRPV6在结肠癌发生过程中的相关机制及作用,本研究拟通过观察沉默TRPV6基因后对结肠癌SW480细胞生物学行为的影响和细胞内钙的浓度变化,以及TRPV6对SD大鼠结肠肿瘤模型中结肠腺瘤-腺癌发生的影响,以期为结肠癌的预防及治疗寻找新的机制及治疗靶点。
1 材料与方法
1.1 材料
1.1.1 细胞及动物 人结肠癌细胞株SW480购自中国科学院上海生物化学研究所,常规消化传代保存。雄性SD大鼠购自第三军医大学实验动物中心,动物实验经本院伦理委员会审查批准[批号:黔科合G字(2014)7014号]。
1.1.2 试剂 二甲基肼(dimethyl hydrazine,DMH)及1,25(OH)2D3购自美国SIGMA公司,TRPV6多克隆抗体购自美国Abcam公司,改良型RPMI 1640培养基和Hyclone胎牛血清购自美国Hyclone公司。逆转录试剂盒、RTPCR扩增试剂盒及引物购自日本TakaRa公司,内参抗体购自武汉Boster公司。CuCl2购自上海生工生物科技有限公司,重组腺病毒载体TRPV6-RNAi的构建及鉴定由上海吉凯公司完成,TUNEL细胞凋亡原位检测试剂盒和MTT试剂盒购自南京凯基生物公司。
1.2 方法
1.2.1 构建慢病毒 重组腺病毒载体LV-TRPV6-RNAi的构建根据上海吉凯公司RNAi文库中TRPV6(NM-018646)cDNA序列构建,分别为靶向干扰序列5'-CAACTCCATCTTCAATAAA-3'及非特异性的阴性对照序列5'-TTCTCCGAACGTGTCAC GT-3'。
1.2.2 细胞培养与病毒转染 结肠癌SW480细胞培养于含10%胎牛血清的RPMI 1640培养基中,37℃,5%CO2培养箱中恒温培养,常规消化、传代。将实验分为空白对照组、阴性对照组和TRPV6-RNAi组。根据感染复数(multiplicity of infection,MOI)为10加入病毒,感染后于24、48、72 h分别在荧光显微镜下观察结肠癌SW480细胞的转染情况。在转染72 h后加入含5µg/mL嘌呤霉素的培养基中继续培养。
1.2.3 观察转染TRPV6-RNAi的结肠癌SW480细胞形态和数量的变化 将培养好的各组实验细胞接种于含10%胎牛血清的RPMI 1640培养基中,培养72 h采用PBS漂洗后显微镜下观察转染TRPV6-RNAi的结肠癌SW480细胞的形态变化和数量变化。
1.2.4 免疫组织化学法观察蛋白表达情况 取各组对数生长期的结肠癌SW480细胞,4%多聚甲醛溶液固定、室温封闭、抗体孵育、DAB显色、复染、1%盐酸酒精分化、水洗返蓝、显微镜下观察、拍照。
1.2.5 实时荧光定量PCR 取各组对数生长期的结肠癌SW480细胞,PBS漂洗后采用Trizol提取法抽提细胞总RNA,测OD值。根据OD值为1.8~2.0将mRNA的浓度统一定为0.2µg/µL进行逆转录及扩增。扩增条件:94℃、30 s;94℃、30 s;60℃、30 s,40个循环,结果分析采用相对定量法(2-ΔΔCT法)。
1.2.6 Western blot检测 取各组对数生长期的结肠癌SW480细胞,采用RIPA法提取蛋白,BCA法蛋白定量后用于蛋白印迹实验。根据TRPV6的蛋白分子量选择配制SDS-PAGE凝胶,取各组样品10µL加入等体积的上样缓冲液,电泳后切取目的蛋白及内参胶带电转、封闭。封闭后加入一抗4℃孵育过夜;次日洗膜后再次加入二抗孵育,并于V3系统中曝光显影;用Image-plus 6.0图像分析软件测量灰度值。相对表达量(目的蛋白)=目的蛋白(平均灰度值)/内参(平均灰度值)。
1.2.7 MTT法 取各组对数生长期的结肠癌SW480细胞,采用不含血清的培养基进行同步化处理24 h后胰酶消化,计数后接种于96板孔中继续培养24 h,每孔吸出培养基0.1 mL后加入等体积的MTT,经孵育后酶联免疫检测仪测定OD值进行结果分析。细胞生长抑制率(%)=(对照组OD值-实验组OD值)/对照组OD值×100%;细胞生长增殖率(%)=(实验组OD值-对照组OD值)/对照组OD值×100%。
1.2.8 细胞迁移实验 实验前于12孔板背面进行标记;常规种板后培养24h,待细胞长至约80%划痕;划痕后0、24、48 h,倒置显微镜下观察划痕宽度并照像。采用Image-plus 6.0软件测量计算迁移距离,迁移能力采用迁移指数表示。迁移指数=d1/d2×100%(d1为起始划痕宽度-迁移后划痕宽度,d2为起始划痕宽度)。
1.2.9 TUNEL法检测细胞凋亡 将各组结肠癌SW480细胞进行常规消化、计数、爬片,培养24 h后4%多聚甲醛固定,0.1%Triton X-100通透,按照TU⁃NEL说明书步骤操作并用荧光显微镜拍照、观察,染成红色的细胞为凋亡细胞(阳性细胞),蓝色细胞为活细胞。高倍镜下任意选3个视野,计算每个视野细胞总数及阳性细胞数。细胞凋亡指数(apoptosis in⁃dex,AI)=阳性细胞数/细胞总数×100%。
1.2.10 结肠癌SW480细胞内Ca2+的测定 将各组制作完成的结肠癌SW480细胞爬片使用准备好的工作液漂洗,避光加钙发光剂Fura-2(Fura-2:PSS为1:1 000),避光孵育及漂洗后于荧光显微镜下观察,用CCD拍摄荧光及转换分析。
1.2.11 大鼠结肠肿瘤模型的构建 雄性SD大鼠适应性喂养,以DMH腹腔注射16周,分为实验组(DMH组)、干预组[DMH+1,25(OH)2D3组、DMH+CuCl2组]和对照组。干预组在建立大鼠结肠肿瘤模型的同时分别予以1,25(OH)2D3(37.5 nmol/kg)、CuCl2(375µmol/kg)灌胃,隔日1次;DMH组予等量DMH腹腔注射及等量生理盐水灌胃;对照组等量生理盐水腹腔注射及灌胃。
1.2.12 大鼠结肠肿瘤取材 至实验18周开始,每2周取材1次,于22周处死全部大鼠将结肠组织充分展开、暴露,观察结肠黏膜,如黏膜异常(糜烂、增厚、肿块等)则取异常处数块,如黏膜无异常则肠腔远端、中段及近端各取数块(全程冰上操作);分别置于-80℃冰箱保存和福尔马林固定保存。成瘤率=(长肿瘤大鼠数/存活大鼠数)×100%
1.2.13 蛋白质印迹实验 总蛋白的提取:将所取大鼠结肠组织从-80℃冰箱取出放入1.5 mL的EP管中,加入200µL RIPA与2µL PMSF。用匀浆机充分捣碎组织,12 000 r/min,离心30 min,4℃,蛋白定量、配胶、电泳、转膜、封闭一抗、洗膜、孵育二抗、显色曝光及结果分析同“1.2.6”中细胞蛋白印迹实验部分。
1.3 统计学分析
采用SPSS 19.0软件进行统计学分析,以表示。数据进行方差齐性检验,数据定量资料应用单因素方差分析(one-way ANOVA),定性资料应用Kruskal-Wallis秩和检验,率的比较采用χ2检验。P<0.05为差异具有统计学意义。
2 结果
2.1 TRPV6-RNAi转染结肠癌SW480细胞后形态的变化
在倒置显微镜下观察TRPV6-RNAi转染72 h后结肠癌SW480细胞形态变化,空白对照组和阴性对照组结肠癌SW480细胞融合成单层,细胞为梭形、多边形或三角形,同时可见较多的处于分裂像的细胞,细胞密度大。TRPV6-RNAi组细胞形态出现细胞皱缩、间隙增大、变圆等凋亡的表现,细胞密度比空白组和阴性对照组明显减低,且培养基中的悬浮死亡细胞较多。
2.2 TRPV6免疫细胞化学结果
空白对照组及阴性对照组结肠癌SW480细胞的细胞质及胞膜为黄色、棕黄色或褐色,呈高表达;TRPV6-RNAi组为淡黄色,呈低表达。
2.3 TRPV6-RNAi转染结肠癌SW480细胞后TRPV6 mRNA的表达变化
采用RT-PCR法检测结果显示,空白对照组和阴性对照组TRPV6 mRNA表达量明显高于TRPV6-RNAi组,差异具有统计学意义(P<0.05);而对照组之间比较,差异无统计学意义(P>0.05,图1)。
2.4 TRPV6-RNAi转染结肠癌SW480细胞后TRPV6蛋白的表达变化
Western blot实验结果发现,空白对照组和阴性对照组的TRPV6蛋白表达高于TRPV6-RNAi组,差异具有统计学意义(P<0.05,图2)。
2.5 TRPV6-RNAi转染结肠癌SW480细胞后对细胞增殖的影响
MTT结果提示,TRPV6-RNAi组对结肠癌SW480细胞增殖有抑制作用,与对照组比较差异具有统计学意义(P<0.05,表1)。
2.6 TRPV6-RNAi转染结肠癌SW480细胞后对其迁移能力的影响
迁移实验果显示,TRPV6-RNAi组结肠癌SW480细胞在划痕后24、48 h的迁移距离小于对照组,与对照组比较差异具有统计学意义(P<0.05),表明TRPV6-RNAi转染结肠癌SW480细胞后可抑制其迁移能力(图3)。
2.7 TRPV6-RNAi转染结肠癌SW480细胞后对其凋亡的影响
采用TUNEL法检测凋亡细胞,在荧光显微镜下观察,凋亡细胞被染成红色,蓝色细胞则为活细胞;对照组可见少量凋亡细胞;TRPV6-RNAi组可见大量凋亡细胞,组间比较差异具有统计学意义(P<0.05,图4)。
2.8 TRPV6-RNAi转染结肠癌SW480细胞后对细胞内Ca2+浓度的影响

图3 TRPV6-RNAi转染结肠癌SW480细胞对其迁移能力的影响
高速离子成像系统检测显示,Fura-2标记后,结肠癌SW480细胞内Ca2+显示为绿色荧光;采用F(340)/F(380)表示细胞内钙离子相对浓度;其变化用△FIRatio表示,可反映细胞内钙浓度的变化,且呈正相关;TRPV6-RNAi组△FIRatio较对照组小,差异具有统计学意义(P<0.05);对照组之间比较,差异无统计学意义(P>0.05,图5)。

图2 TRPV6-RNAi转染结肠癌SW480细胞后TRPV6蛋白表达

表1 TRPV6-RNAi转染结肠癌SW480细胞对其生长增殖的影响

图4 TRPV6-RNAi转染结肠癌SW480细胞对其凋亡的影响
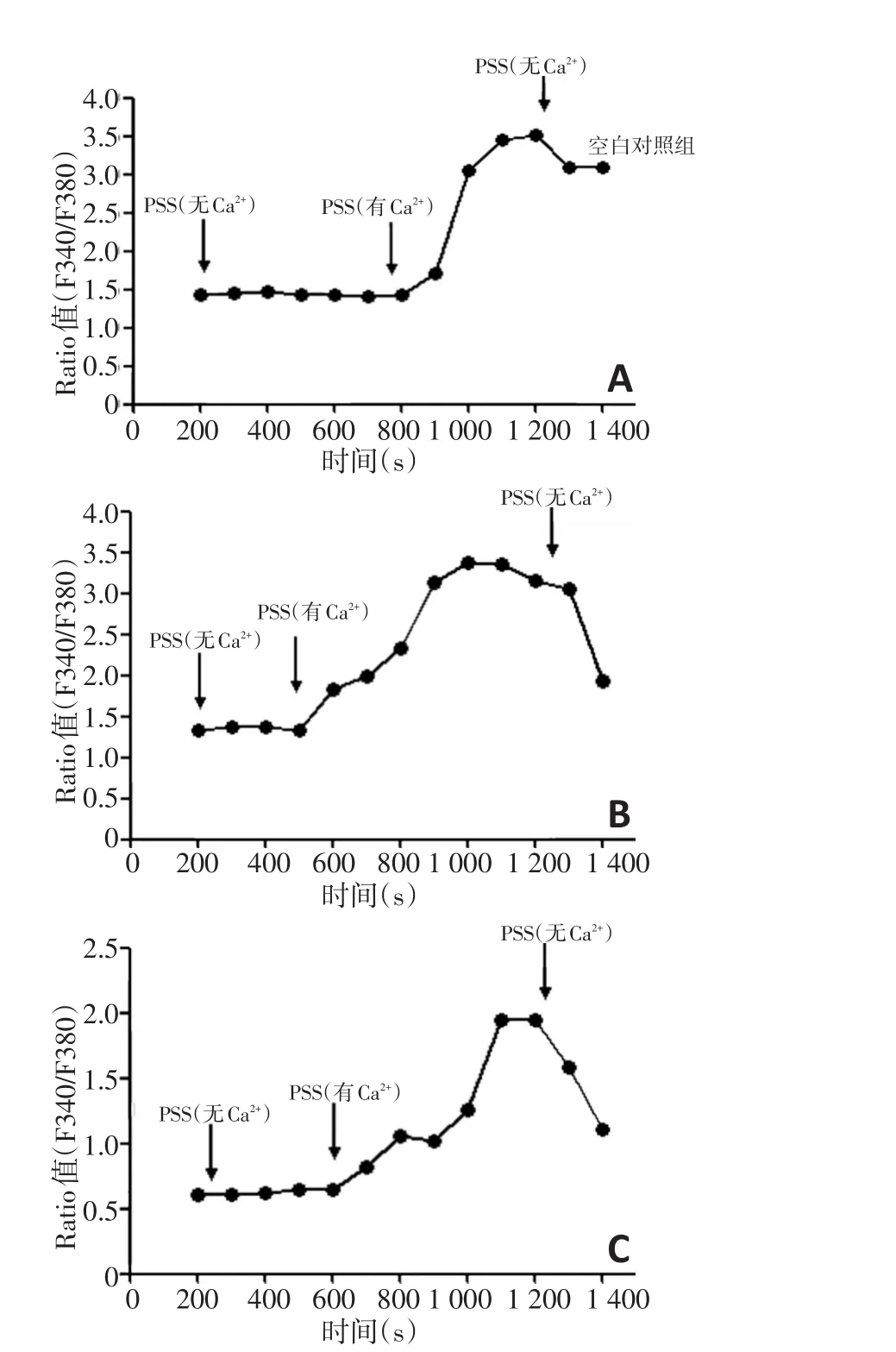
图5 TRPV6-RNAi转染结肠癌SW480细胞对细胞内Ca2+浓度影响(±s)
2.9 1,25(OH)2D3、CuCl2对SD大鼠结肠肿瘤模型建立的影响
2.9.1 大鼠生长一般情况 实验组及干预组大鼠前6周,除对照组外各实验组均有死亡,结肠黏膜均未发现病变,死亡的大鼠不计入为有效的实验动物;第6周后大鼠无死亡。在12周以后DMH+1,25(OH)2D3组、DMH+CuCl2组和DMH组4组大鼠随着时间的推移而逐渐出现食欲减退、体质量增长缓慢、反应变迟钝,且毛发光泽较差,部分出现毛发稀疏,少量大鼠出现腹泻,均未出现便血。对照组10只大鼠精神状态好,食欲可,反应迅速,体质量增长良好,毛发色泽光亮,无死亡。
2.9.2 各组大鼠结肠肿瘤的发生情况 分别于18、20、22周处死老鼠,对照组大鼠结肠黏膜光滑,均未见肿瘤结节形成;DMH组存活的13只大鼠中11只大鼠结肠形成肿瘤结节,共45个;DMH+1,25(OH)2D3组存活的7只大鼠全部有肿瘤结节形成,共形成肿瘤结节36个,其中1只大鼠有少量淡黄色腹水,伴腹腔内见弥漫性结节形成,经病理检查证实为腺癌;DMH+CuCl2组存活的9只大鼠中3只大鼠形成肿瘤结节,共形成肿瘤结节6个。主要表现为息肉隆起型,大多为无蒂,肿瘤表面未见溃疡及出血;未形成肿瘤的12只存活大鼠结肠主要表现为黏膜粗糙、增厚,以慢性炎症为主,部分伴有异型性增生(图6)。
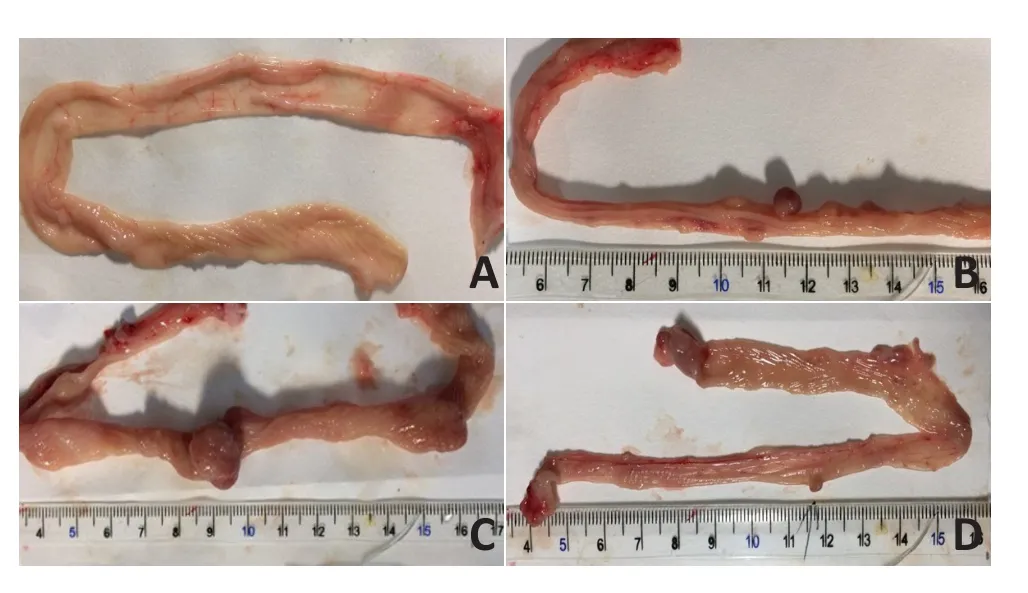
图6 各组SD大鼠结肠肿瘤生长情况
所取组织标本使用福尔马林固定,H&E染色后观察各组成瘤情况显示,对照组均未见肿瘤形成;DMH组、DMH+1,25(OH)2D3组可见较多肿瘤形成,与DMH+CuCl2组及对照组比较,差异具有统计学意义(P<0.05),而DMH组与DMH+1,25(OH)2D3组比较,差异无统计学意义(P>0.05);各组平均腺癌数比较,DMH+1,25(OH)2D3组、DMH组与DMH+CuCl2组及对照组比较,差异具有统计学意义(P<0.05),而DMH+CuCl2组与及对照组比较,差异无统计学意义(P>0.05,表2)。
2.9.3 Western blot检测各组大鼠结肠组织中TRPV6蛋白的表达 Western blot检测结果显示,DMH+1,25(OH)2D3组>DMH组>DMH+CuCl2组>对照组,差异具有统计学意义(P<0.05,图7)。

表2 各组大鼠结肠肿瘤成瘤率的比较

图7 各组SD大鼠结肠组织中TRPV6蛋白的表达情况
3 讨论
近年来中国结肠癌的发病率及死亡率呈逐年上升趋势,多数结肠癌患者发现时已属于中晚期,且大多合并远处转移。目前虽然有手术、放化疗、免疫治疗、分子生物靶向治疗及营养支持等治疗手段,但其病死率仍较高,远期预后差。为进一步提高结肠癌患者的生存率,个体化的基因靶向治疗将成为结肠癌重要的治疗手段。
TRPV6是位于细胞膜上的一种重要的Ca2+选择通道,其表达水平的增加可能有助于恶性肿瘤的生长,在肠道肿瘤、前列腺癌、乳腺癌等多种癌症中的表达明显高于相应的正常组织[10]。研究发现,TRPV6在人结肠腺瘤、腺癌的表达高于正常黏膜组织及非肿瘤性息肉;TRPV6激动剂1,25(OH)2D3和抑制剂CuCl2能调节结肠癌SW480细胞的TRPV6蛋白及mRNA表达,通过升高或降低结肠癌SW480细胞内Ca2+浓度,从而调节结肠癌SW480细胞的增殖、迁移和凋亡[9,11]。本研究进一步采用构建靶向TRPV6 的RNAi表达载体转染结肠癌SW480细胞,通过RTPCR及Western blot检测发现,TRPV6-RNAi能下调结肠癌SW480细胞的TRPV6 mRNA及蛋白表达,降低结肠癌SW480细胞内Ca2+浓度,抑制结肠癌SW480细胞的增殖、迁移,促进结肠癌SW480细胞的凋亡,与对照组比较差异具有统计学意义。此外,在DMH构建SD大鼠结肠肿瘤模型中,本研究发现1,25(OH)2D3能上调结肠组织中的TRPV6表达,促进SD大鼠结肠腺瘤及腺癌的发生及生长;而CuCl2则下调结肠组织中的TRPV6表达,抑制SD大鼠结肠腺瘤及腺癌的发生及生长,与对照组比较差异具有统计学意义。
研究显示[2-3],细胞内Ca2+平衡紊乱与恶性肿瘤密切相关,尤其表现在细胞的增殖、迁移及凋亡方面。细胞内钙调节涉及机制较复杂,目前发现与细胞膜钙 泵(plasma membrane calcium ATPase 1b,PM⁃CA1b)、钠/钙交换器(NCX1)、维生素D受体(vitamin D receptor,VDR)、斯钙素-1(Stanniocalcin-1,STC-1)以及TRPV5/6等有关。TRPV6是TRP超家族中目前唯一已知的Ca2+高选择性通道,主要负责Ca2+由细胞外向细胞内的主动跨膜运输,位于结肠吸收表面的顶膜中,是一种可以调节肠钙吸收速度和程度的蛋白质,其功能受1,25(OH)2D3通过VDR信号通路的调节。有研究发现[12],在肠上皮细胞的钙内流过程中,STC-1能抑制TRPV5/6蛋白表达,减少TRPV5/6通道蛋白调节的钙内流。在结肠癌发展阶段,TRPV6在Ⅰ期结肠癌中的表达为66%,在Ⅱ期结肠癌中的表达为17%,在Ⅲ、Ⅳ期结肠癌中却几乎无表达,TRPV6表达增高主要发生在结肠癌早期,而这种伴随结肠黏膜增生的TRPV6异常高表达可通过高钙饮食来减弱甚至逆转[9]。TRPV6的抑制剂SOR-C13被临床用来治疗胰腺癌并取得一定疗效[13]。上述研究表明TRPV6表达与肿瘤细胞的增殖和凋亡密切相关,但具体机制仍有待进一步研究。
综上所述,本研究通过RNAi技术及DMH构建SD大鼠结肠肿瘤模型,观察发现通过上调或下调TRPV6 mRNA及其蛋白表达,可以通过增加或降低结肠癌SW480细胞内Ca2+浓度,调节结肠癌SW480细胞的增殖、迁移和凋亡,进而影响结肠癌发生及生长。TRPV6是结肠癌发生及发展过程中一个重要的影响因素,希望通过对TRPV6的进一步研究,可以为结肠癌的临床诊治提供一个新的标志物。
致谢:感谢上海吉凯公司对本研究的支持。
