培美曲塞联合顺铂治疗非小细胞肺癌的临床疗效及对患者生活质量的影响
2018-12-17章永莫强何星光时洁
章永,莫强,何星光,时洁
1咸宁市中心医院·湖北科技学院附属第一医院肿瘤科,湖北 咸宁437000
2恩施州中心医院药剂科,湖北 恩施445000
肺癌是临床上常见的呼吸系统恶性肿瘤之一,其中非小细胞肺癌(non-small cell lung cancer,NSCLC)占肺癌的80%左右[1],是导致肺癌患者死亡的首要因素。流行病学数据显示,肺癌是肿瘤患者死亡的主要原因,多数患者就诊时已为晚期,5年生存率仅为10%~15%[2-3]。临床多采用化疗、放疗等方式治疗NSCLC,其中以铂类为基础联合第3代化疗药物为NSCLC的一线治疗标准方案。培美曲塞为近年来发现的新型多靶点抗叶酸细胞毒药物,因其疗效较强且不良反应轻而在临床上广泛应用,甚至部分学者将其归为第4代化疗药物。本研究回顾性分析120例NSCLC患者的临床资料,旨在探讨培美曲塞联合顺铂一线治疗NSCLC的临床疗效及对患者生活质量的影响,现报道如下。
1 资料与方法
1.1 一般资料
回顾性分析2012年6月至2015年6月咸宁市中心医院收治的NSCLC患者的临床资料。纳入标准:①经组织学或细胞学检查确诊;②年龄>18岁;③生存期>3个月;④有可评价的肿瘤病灶;⑤骨髓及肝肾功能正常。排除标准:①合并不可控制的感染;②肝、肾、心脏等功能严重异常;③妊娠期及哺乳期女性;④无自知力的脑转移者;⑤合并神经、精神障碍史,如癫痫、痴呆等。根据纳入和排除标准,本研究共纳入120例NSCLC患者。根据治疗方法的不同将患者分为观察组和对照组,每组60例,观察组患者接受培美曲塞联合顺铂治疗,对照组患者接受吉西他滨联合顺铂治疗。观察组中,男35例,女25例;年龄48~80岁,平均(64.18±8.52)岁;病理分期:ⅢB期36例,Ⅳ期24例;入院时美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)评分为(2.58±0.65)分。对照组中,男36例,女24例;年龄45~80岁,平均(63.82±8.16)岁;病理分期:ⅢB期35例,Ⅳ期25例;入院时ECOG评分为(2.52±0.63)分。两组患者的性别、年龄、病理分期、入院时ECOG评分比较,差异均无统计学意义(P>0.05),具有可比性。
1.2 治疗方法
对照组患者接受吉西他滨联合顺铂治疗。静脉滴注吉西他滨,1250 mg/m2,第1天、第8天;静脉滴注顺铂,25 mg/m2,第1~3天。21天为一个疗程,两个疗程结束后观察治疗效果。若治疗有效,则继续使用原方案治疗2~4个疗程。
观察组患者接受培美曲塞联合顺铂治疗。培美曲塞给药前1周内补充维生素B12,每次1 mg,每9周重复1次。首次培美曲塞给药前1周口服叶酸400 μg/d,持续至培美曲塞末次给药后21天。培美曲塞给药前1天、给药当天及给药后1天,给予地塞米松8 mg/d口服,分两次服用。静脉滴注培美曲塞,500 mg/m2,第1天;静脉滴注顺铂,25 mg/m2,第1~3天。21天为一个疗程,两个疗程结束后观察治疗效果。若治疗有效,则继续使用原方案治疗2~4个疗程。
1.3 观察指标及评价标准
依据实体瘤疗效评价标准(response evaluation criteria in solid tumors,RECIST)[4]进行疗效评价:完全缓解(complete response,CR),所有靶病灶消失,无新病灶出现,至少维持4周;部分缓解(partial response,PR),病灶最大直径之和减少≥30%,至少维持4周;疾病稳定(stable disease,SD),病灶最大直径之和减少未达PR,或增大未达疾病进展(progressive disease,PD);PD,病灶最大直径之和增大≥20%,或出现新病灶。客观有效率(objective response rate,ORR)=(CR+PR)例数/总例数×100%,疾病控制率(disease control rate,DCR)=(CR+PR+SD)例数/总例数×100%。
采用肿瘤患者生活质量评分量表[5]评价治疗前及治疗后患者的生活质量,包括食欲、疼痛、疲乏、家庭和社会关系、精神、睡眠、日常生活、自身情绪8项。总分为60分,评分越高表明生活质量越好。记录并比较两组患者的不良反应发生情况。
1.4 随访
所有患者均以门诊或电话随访的方式随访2年。患者完成治疗后均进入随访期,对于结束治疗且尚未进展的患者,嘱其每6周返院复查肿瘤情况,至PD或患者死亡;对于PD患者,每3个月进行一次随访直至患者死亡。总生存时间(overall survival,OS)是指从化疗开始至患者死亡的时间。
1.5 统计学方法
采用SPSS 22.0软件对数据进行统计分析。计量资料以均数±标准差(±s)表示,组间比较采用配对t检验或两独立样本t检验;计数资料以例数和率(%)表示,组间比较采用χ2检验;采用Kaplan-Meier法绘制生存曲线,组间比较采用Log-rank检验。以P<0.05为差异有统计学意义。
2 结果
2.1 近期疗效的比较
治疗后,观察组患者的ORR和DCR分别为40.00%(24/60)和81.67%(49/60),分别高于对照组的33.33%(20/60)和76.67%(46/60),但差异均无统计学意义(P>0.05)。(表1)
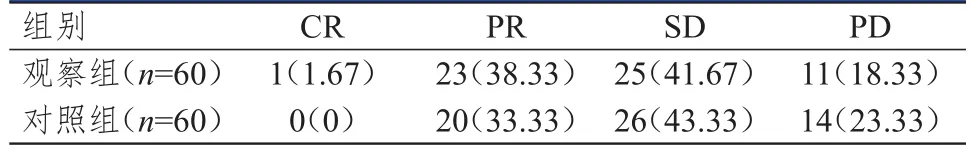
表1 两组患者的近期疗效[ n(%)]
2.2 生活质量的比较
治疗前,观察组和对照组患者的生活质量评分分别为(29.58±5.24)分和(30.31±4.05)分,差异无统计学意义(P>0.05)。治疗后,观察组和对照组患者的生活质量评分分别为(40.14±6.51)分和(33.40±4.05)分,均高于本组治疗前,差异均有统计学意义(t=16.443、14.245,P<0.05);且观察组患者的生活质量评分高于对照组,差异有统计学意义(t=5.788,P<0.05)。
2.3 不良反应发生率的比较
观察组和对照组患者的不良反应总发生率分别为13.33%(8/60)和10.00%(6/60),差异无统计学意义(P>0.05)。(表2)
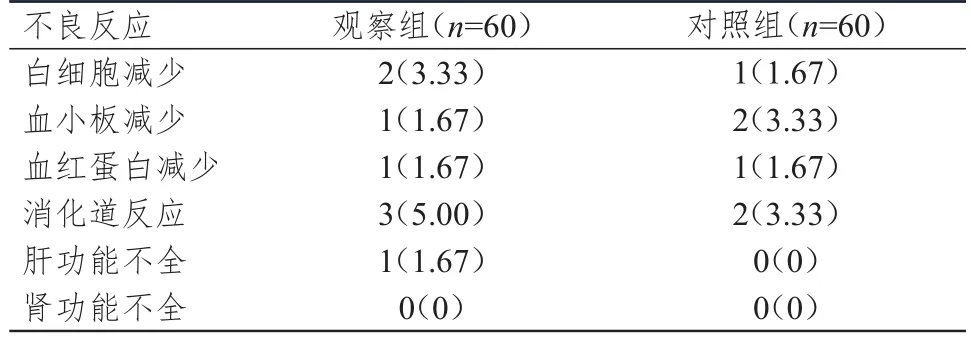
表2 两组患者的不良反应发生情况[ n(%)]
2.4 生存情况的比较
观察组患者的2年生存率为32.6%,明显高于对照组的9.6%,差异有统计学意义(χ2=9.624,P=0.002)。(图1)
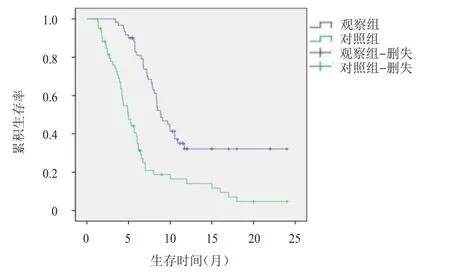
图1 观察组( n=60)和对照组( n=60)患者的生存曲线
3 讨论
研究表明,多数肺癌患者就诊时已为晚期或出现远处转移,5年生存率仅为15.9%[6]。在全球范围内,每年有100万以上的患者死于肺癌,临床治疗主要以延长患者的生存时间、提高患者的生活质量为主要目的[7]。其中全身治疗为晚期NSCLC的主要治疗手段,通过化疗、靶向治疗等综合治疗可延长晚期NSCLC患者的生存时间,提高其生存质量。卞方等[8]研究显示,培美曲塞与吉西他滨分别联合顺铂治疗初治晚期NSCLC的临床疗效相当,但前者的用药安全性较高。化疗药物对NSCLC的疗效已进入平台期,如何进一步提高晚期NSCLC患者的临床效果成为亟待解决的难题之一。
吉西他滨为阿糖胞苷类似物,与铂类药物联合应用为治疗晚期NSCLC的一线治疗方案,主要是通过作用于DNA合成期及晚G1期,抑制DNA合成及恶性肿瘤细胞的增殖。培美曲塞为人工合成的抗叶酸药物,属于细胞周期特异性抗代谢药物,可通过抑制胸苷酸合成酶(thymidylate synthase,TS)、二氢叶酸还原酶、甘氨酰胺核苷甲酰基转移酶(dihydroflate reductase,GARFT)的活性,减少嘌呤和胸腺嘧啶核苷的合成,影响肿瘤细胞DNA和RNA的合成,抑制细胞增殖,进而发挥抗肿瘤作用。郑积华等[9]进行的随机对照临床研究显示,单药培美曲塞与多西他赛二线治疗NSCLC比较,培美曲塞组患者的有效率、中位生存期、1年生存率均优于多西他赛组患者,且培美曲塞组患者中性粒细胞下降、粒细胞缺少性发热、脱发等药物不良反应发生率均低于多西他赛组患者。
本研究比较了培美曲塞联合顺铂(观察组)与吉西他滨联合顺铂(对照组)治疗NSCLC的临床效果,结果显示,观察组患者的ORR和DCR分别为40.00%和81.67%,与对照组的33.33%和76.67%比较,差异均无统计学意义(P>0.05)。提示两种治疗方案对NSCLC的近期疗效相当,与Zhang等[10]报道的结论一致。本研究结果显示,观察组患者的2年生存率为32.6%,明显高于对照组的9.6%,差异有统计学意义(P<0.01);观察组患者的2年生存率与既往文献报道的结果相似[11]。在生活质量方面,治疗后观察组患者的生活质量评分高于对照组(P<0.05),提示观察组患者具有良好的耐受性,治疗后生活质量显著提高。在不良反应方面,两组患者的不良反应总发生率比较,差异无统计学意义(P>0.05)。本研究中未出现骨髓抑制等较严重的不良反应,提示两种化疗方案均安全可靠。
综上所述,培美曲塞联合顺铂治疗NSCLC的临床效果显著,可延缓肿瘤进展,提高患者的生活质量,且不良反应少,值得临床推广应用。
