两种冷却方式对宰后成熟过程中牛肉保水性的影响
2018-12-15惠小洋余群力曹晖韩广星吴磊韩玲
惠小洋,余群力*,曹晖,韩广星,吴磊,韩玲
1(甘肃农业大学 食品科学与工程学院,甘肃 兰州,730070) 2(陕西秦宝牧业股份有限公司,陕西 宝鸡,721000)3(山东绿润食品有限公司,山东 临沂,276000) 4(河北福成五丰食品股份有限公司,河北 三河,065200)
保水性(water-holding capacity,WHC)是指肉在受到外力作用下保持水分的能力,它可以赋予肉品多汁性和更好的口感。研究表明成熟过程中WHC的变化与细胞骨架蛋白有关[1],肌原纤维蛋白降解导致肌肉蛋白网状结构变化,影响其保留水分的能力,此外蛋白氧化可通过改变蛋白质的静电效应和空间效应来影响肌肉中水分的分布和流动。宰后肌肉因缺氧从有氧呼吸转为无氧酵解,无氧条件下葡萄糖(glycose,Glc)分解成丙酮酸供能,丙酮酸进一步被还原为乳酸(lactic acid,HL),直至酸度过大、参与的酶类失活,此过程是宰后肌肉pH下降的主要原因,而宰后pH值的变化速度与幅度会影响WHC[2]。研究表明冷却可减缓pH值的下降速率,减少肌球蛋白的变性和汁液流失,对肌肉的保水性有积极作用[3],且迅速降低肉深层的温度可在肉的表面形成一层干燥膜,阻止微生物生长繁殖,减缓内部水分蒸发,并抑制酶的活性减缓代谢过程[4]。
宰后胴体发生无氧酵解产生热量,为腐败微生物生长提供条件,同时高温会加速水分散失,易引发热收缩导致肉品质下降。为在宰后尽快散失胴体热量,有学者对冷却方式进行了研究。常规冷却是指将肉置于4 ℃完成排酸的过程,但存在微生物污染风险且伴随较大汁液损失,此外考虑到中国肉牛的体重及背膘厚度,企业应用常规冷却可能会导致冷收缩的发生[5];延迟冷却使肉在僵直前期温度较高,易引起热收缩降低其保水性[6],同时胴体干耗和水分蒸发增加,微生物污染的风险也更大;三段式冷却虽表现出更小的汁液损失,但操作较复杂[7]。快速冷却对保水性有益的研究已经从其他动物试验中获得,猪肉经快速冷却处理后总蛋白和肌浆蛋白溶解性提高,持水性显著提高[8];山羊经快速冷却处理后肌浆蛋白加速降解,蒸煮损失降低[9]。
因考虑到快速冷却可能对牛胴体存在增韧现象,现有研究多集中于如何改善牛肉嫩度,但针对其保水性影响的研究较少。因此,试验通过分析糖酵解上下游反应产物及骨架蛋白变化情况,研究宰后成熟过程中,快速冷却对牛背最长肌保水性的影响。
1 材料与方法
1.1 实验材料
选取商业饲养场(张掖元博农业有限公司)饲喂批次相同、36~48月龄、体重相近的杂交牛6头(当地黄牛×西门塔尔牛,宰前体重(420±20) kg),宰前24 h禁食禁水,按伊斯兰屠宰方式屠宰。宰后迅速取下其左右侧的背最长肌(TheM.longissimusdorsi,LD;第12胸椎到第5腰椎),每头牛取30 g LD在液氮中冷冻作为0 h样本,所有左侧LD样本施以快速冷却处理(rapid chilling,RC;将样品置于-18 ℃、风速2.5 m/s、相对空气湿度90%~95%环境中,当其中心温度降至4 ℃,转移到预先灭菌的4 ℃冷库中冷藏),右侧LD样本施以常规冷却处理(common chilling,CC;将样品置于4 ℃冷库中冷藏),测定成熟至6、12、24、48、72、120、168 h时的各项指标。
1.2 试剂与仪器设备
Tris、SDS、哌嗪-N,N′-双(2-乙磺酸),美国Sigma公司;肌糖原测定试剂盒、乳酸测定试剂盒、葡萄糖测定试剂盒、6-磷酸葡萄糖测定试剂盒,南京建成公司;其他试剂均为分析纯。
YYW-2型应变式控制式无侧限压力仪,南京土壤仪器厂有限公司;PHS-3C 型电子pH计,上海日岛科学仪器公司;TGL-24M 台式高速冷冻离心机,长沙平凡仪器仪表有限公司;XHF-D高速分散器,宁波新芝生物科技股份有限公司。
1.3 试验方法
1.3.1 pH
将pH计直接插入背最长肌肉样进行测定,每块肉样重复3次,记录数据。
1.3.2 糖酵解潜力(glycolysis potential,GP)
肌糖原、乳酸、葡萄糖、6-磷酸葡萄糖(6-phosphate glucose,G-6-P)含量测定的实验操作和结果计算参照试剂盒说明进行,糖酵解潜力GP计算参照MONIN等[10]如公式(1):
GP/(μmol·g-1)=2×(肌糖原含量+Glc含量+G-6-P含量)+乳酸含量
(1)
1.3.3 持水力
1.3.3.1 加压损失
采用FAROUK[11]改进的加压滤纸法,截取面积5 cm2、厚度1 cm的肉样,称重记为m1,将肉样置于2层医用纱布之间,上下各垫18层滤纸,置于压缩仪平台上,匀速加压至35 kg,保持5 min,撤除压力后立即称重记为m2,每个处理重复测定3次,加压损失计算如公式(2):
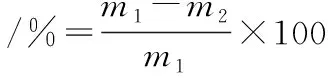
(2)
1.3.3.2 蒸煮损失
修整去除肉块表面脂肪和结缔组织,称重记为m1后装袋,80 ℃恒温水浴加热,用数显温度计记录加热过程中肉块的中心温度,至70 ℃后保持30 min,取出冷却至室温,用吸水纸吸干肉块表面汁液,称重记为m2,蒸煮损失[12]计算如公式(3):
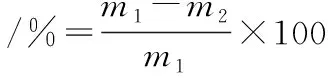
(3)
1.3.3.3 滴水损失
取每头牛LD样本适量,称重记为m1后用S型钩钩住其一端,放入包装后充气密封,将肉块悬挂在其中,确保肉块四周不与包装袋接触,4 ℃下吊挂24 h后,打开包装用滤纸擦干肉样表面水分,再次称重记为m2。滴水损失[12]计算如公式(4):
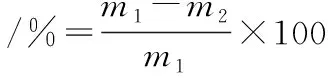
(4)
1.3.4 肌原纤维蛋白性质
1.3.4.1 肌原纤维蛋白提取
参考XIONG等[13]的方法得到肌原纤维蛋白(myofibrillar protein,MP),采用双缩脲法测定蛋白质浓度。
1.3.4.2 表面疏水性
参照CHELH等[14]的方法并稍作修改。将80 μL 1 mg/mL的溴酚蓝溶液悬入2 mL 1 mg/mL MP蛋白溶液,涡旋振荡10 min,离心(4 ℃,4 000×g,15 min),取上清液稀释10倍后测定595 nm处吸光值,以2 mL提取缓冲液加入80 μL 1 mg/mL的溴酚蓝溶液为空白对照。表面疏水性(surface hydrophobicity,S0,μg)计算按公式(5):
(5)
1.3.4.3 热聚合效应分析
参考XIA等[15]的方法,用15 mmol/L哌嗪-N,N′-双(2-乙磺酸)磷酸钾缓冲液(pH 6.0,离子强度0.6 mol/L)将MP蛋白液浓度调为1 mg/mL,并于热水浴中加热,600 nm波长下测定加热过程中(30、40、50、60、70、80 ℃)蛋白吸光度。
综上所述,乳腺肿块超声诊断时综合二维声像与彩色多普勒检查,可进一步明确诊断患者疾病,用于指导临床治疗。
1.3.4.4 乳化性
参照AGYARE等[16]的方法并作适当修改,将20 mL 1 mg/mL的MP蛋白溶液悬在5 mL大豆油中,高速匀浆(10 000 r/min,1 min,0~4 ℃),立即从管底0.5 cm地方采取乳浊液50 μL,加入到5 mL 0.1% SDS溶液中振荡混匀,静置10 min,测定500 nm处吸光值(A0),重复以上操作,再次测定吸光值(A10),0.1% SDS溶液作为空白对照,计算乳化活性指数(emulsifying activity index,EAI)和乳化稳定性(emulsifying stability index,ES)如公式(6)、(7):
(6)
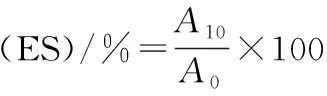
(7)
式中:A500,500 nm波长处吸光值;φ,油相体积分数(油的体积/乳浊液的体积);ρ,蛋白质质量浓度,g/mL;A0,A10,乳浊液在0,10 min的吸光值。
1.3.5 数据处理和统计分析
试验结果采用SPSS 19.0(SPSS Inc.,Chicago,IL)软件进行ANOVA单因素方差分析、Duncan显著性检验及Pearson相关性分析。
2 结果与分析
2.1 冷却方式对成熟过程中牛肉pH的影响
屠宰后动物体内积累的肌糖原开始分解产生乳酸,引起肌肉酸度值升高表现为pH下降。pH下降,肌肉环境中负电荷增加中和了蛋白质中的部分正电荷,从而减弱了蛋白质之间的静电斥力使蛋白纤丝间空隙减小,保水性下降[17]。实验表明经CC处理牛肉在宰后72 h达到pHu,之后开始解僵。在宰后12 h内,RC组pH下降速率较慢,由于低温可抑制牛肉内源酶的活性从而减缓代谢速率,对宰后初期肌肉pH的下降速率有一定的影响。RC组比CC组较早到达pHu,可能是因为宰后早期低温处理引起较高pH,钙蛋白酶体系在高pH环境下活性更高,有利于其降解肌肉蛋白以获得更好的嫩度,同时抑制僵直对肉质产生的不利影响,从而缩短僵直期。

图1 冷却方式对成熟过程中牛肉pH的影响Fig.1 The effect of chilling methods on the aging process on pH of beef注:图中所标不同字母者时间点之间差异极显著(p<0.01);标*者冷却方式之间差异显著(p<0.05);**者差异极显著(p<0.01)。下同。
2.2 冷却方式对成熟过程中牛肉糖酵解潜力的影响
糖酵解潜力(glycolytic potential,GP)是宰后可转化成乳酸等各类化合物的糖类化合物数量总和的较理想近似值[10]。由图2-a可知RC组肌糖原含量在宰后48 h降至2.55 mg/g,2种冷却方式下的肌糖原含量在宰后6、24、48、72 h差异极显著。由图2-b可知RC组Glc含量在宰后48 h达到峰值9.79 mmol/L。由图2-c可知宰后72 h CC组HL含量达峰值214.67 μmol/g,48 h RC组峰值214.33 μmol/g,2种冷却方式下HL含量在宰后24、48、72 h差异显著。

图2 冷却方式对成熟过程中牛肉糖酵解潜力的影响Fig.2 The effect of chilling methods on the aging process on glycolysis potential of beef
由图2-d可知成熟过程中GP先升后降,RC组宰后48 h出现了峰值297.45 μmol/g。RC组GP各指标在宰后6 h内变化趋势均较平缓,且出现极值的时间早于CC组。
CC组宰后6 h内快速糖酵解产生大量热能,除了使胴体温度处于较高水平外,还使肌肉pH迅速降低,高温和低pH在宰后初期易引发蛋白变性,降低肌肉保水性。RC组宰后12 h内肌糖元消耗缓慢,低温抑制肌糖原向下游物质转化。RC组通过低温处理控制了糖酵解速率,从而降低了劣质肉发生概率,这与RYU等的研究相似[18]。宰后机体不再产生新的能量源,肌糖原不断被消耗,因此成熟后期肌糖元含量在较低水平趋于稳定[19]。肌肉中Glc含量在宰后僵直最大期附近出现峰值,该阶段糖原通过酵解代谢转化为充足的Glc,同时未及时向下游HL进行转化,无氧酵解所需的酶因HL在胞内聚集pH降低导致LDH失活,此时肌糖原不会再分解,糖酵解下游反应被抑制。RC组通过低温控制糖酵解反应速率,避免过快产生大量Glc,使Glc处于较低水平。HL含量屠宰后期下降,这是由于其他微生物的活动消耗HL,表观上pH出现一定幅度的上升,这与HOVENIER等的研究结果相一致[20]。
宰后12 h内RC组糖酵解潜力变化速率受到抑制。随着无氧酵解的进行,胴体内积累的糖原消耗速率放缓,糖酵解潜力逐渐下降。随着僵直的进行,RC组无氧快速酵解的特性表现得更加明显,趋于更早到达僵直最大阶段,且主要影响肉质的肌糖原和HL含量随着成熟的进行变化逐渐平稳。因为酶活性强烈依赖于温度,降低冷却温度具有降低糖酵解速率的效果[10]。
2.3 冷却方式对成熟过程中牛肉持水力的影响
图3-a中RC组宰后48 h达到加压损失最大值35.09%。2种冷却方式对加压损失的影响在168 h内均显著。图3-b反映出RC组的滴水损失在宰后24 h至168 h间上升平缓。图3-c可见宰后初期蒸煮损失上升,CC组宰后72 h蒸煮损失为45.94%,RC组48 h为43.09%,此后水分损失上升的趋势被抑制。2种冷却方式对比下,除120 h差异不显著外,其余组均呈现出显著差异。实验表明经冷却处理的牛肉在宰后24、72 h时间点前后有明显的质量变化。

图3 冷却方式对成熟过程中牛肉持水力的影响Fig.3 The effect of chilling methods on the aging process on WHC of beef
宰后初期肌肉保水性的下降主要与肌纤维在僵直期间的收缩有关,成熟过程中肌纤维蛋白降解使肌纤维膨胀并减弱了细胞向外的延伸能力,从而保持住了水分。宰后pH下降引起肌动球蛋白形成,导致蛋白质网状结构的空隙减小,迫使内部的水分渗出。有研究表明,宰后初期pH下降速率是影响加压损失的决定因素[21];本实验RC组加压损失较低,这与低温抑制糖酵解酶活使宰后初期pH下降速率缓慢有关。滴水损失的增加在屠宰后期变缓,原因可能是成熟过程中肌肉骨架蛋白结构被破坏,蛋白质变性,结合水能力降低。RC组屠宰24h后滴水损失变化平稳且低于CC组,由于宰后低温处理样本1 h会使其表面硬化甚至形成冰膜,从而降低胴体表面水分蒸发速率。蒸煮损失的变化主要取决于胴体pHu的差异[22]。RC组宰后初期对温度的控制直接影响pHu,使其高于CC组,从而降低了成熟后期的蒸煮损失。宰后48 h内RC组蒸煮损失始终较高且冷却方式间差异极显著,这可能是因为宰后1 h样本中心温度更低使肉中生成小的结晶体[23],热处理会使温度对样本的影响加剧,从而影响蒸煮损失。
2.4 冷却方式对成熟过程中MP的S0的影响
S0是评价蛋白质水合情况的重要特性。由图4可以看出成熟过程中结合BPB含量呈先升后降趋势,宰后24 h内RC组S0增长缓慢且低于CC组,2种冷却方式在宰后12 h有显著性差异。结合BPB含量CC组在宰后72 h达到峰值24.45 μg,RC组48 h升至峰值21.81 μg并始终低于CC组。宰后120 h后2种冷却方式结合BPB含量均趋于稳定。
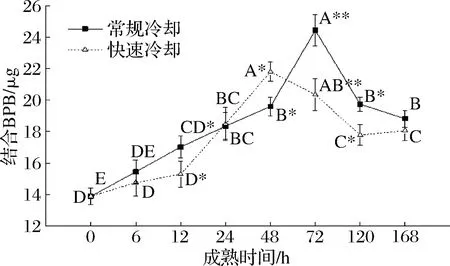
图4 冷却方式对成熟过程中牛肉蛋白质S0的影响Fig.4 The effect of chilling methods on the aging process on protein surface hydrophobicity of beef
S0越高结合水的能力越弱。屠宰初期S0一定程度上升,时间作用下蛋白质轻微氧化,疏水基团逐渐暴露于蛋白质的表面,引起蛋白质保水性下降[24]。屠宰后期S0下降可能是因为成熟导致肌纤维蛋白降解成更小片段,因此蛋白片段所带电荷数增多,亲水能力加强。实验结果表明RC组与CC组相比结合BPB含量更低,这可能是因为低温可以有效抑制因环境温度较高引起的肉中蛋白质变性[17]。
2.5 冷却方式对成熟过程中牛肉MP热聚合的影响
如图5所示牛肉MP溶液浊度随加热温度升高而升高,随成熟的进行有先升后降的变化。

图5 冷却方式对成熟过程中牛肉MP热聚合效应的影响Fig. 5 The effect of chilling methods on the aging process on MP thermal polymerization effect of beef
加热过程中CC组蛋白溶液浊度均高于RC组。蛋白交联程度CC组宰后72 h最大,RC组宰后48 h最大。加热至80 ℃,RC组MP溶液浊度宰后48 h到达峰值0.7。
热聚合效应反映肉品加工过程中蛋白质变化情况。本实验中MP溶液在加热过程中浊度逐渐增加,加热使蛋白质发生相互交联导致溶液光学密度增加,浊度越大蛋白交联程度越大。因此CC组MP溶液分子间的交联作用强于RC组,本实验结果与XIA等结果相似[25]。蛋白质分子之间的相互交联作用加强将会导致一些其他的活性基团与蛋白质的结合作用减弱,从而导致蛋白质一些功能特性如保水性的下降[26],本实验结果表明,RC处理削弱了这种不利影响。
2.6 冷却方式对成熟过程中牛肉MP乳化性的影响
如图6所示,成熟过程中不同冷却方式下样本MP溶液的乳化性呈现先下降后上升的趋势,宰后初期RC组乳化水平变化幅度较小。RC组EAI宰后48 h显著降至最小值36.29 m2/g,宰后72 h至168 h RC组EAI均高于CC组。ES表现出与EAI类似的变化趋势,2种冷却方式对比,除12 h外ES均差异显著。CC组ESI宰后48 h降至最小值13.74%,RC组ES宰后24 h降至最低值16.82%。

图6 冷却方式对成熟过程中牛肉MP乳化性的影响Fig.6 The effect of chilling methods on the aging process on MP emulsifying properties of beef
实验表明,成熟过程中样本MP的EAI和ES先下降后上升。当pH达到极限值时接近肌原纤维蛋白等电点,此时蛋白质分子以两性离子形式存在,所带的净电荷最少,分子间作用力减弱,此时吸附在油水界面蛋白质分子也最少,导致EAI较低。之后随pH的上升,电荷的静电斥力增加,蛋白质分子分散开,表面张力降低,疏水性基团暴露在外,保水性下降。在吸附脂肪粒的过程中,蛋白质骨架上的疏水残基定向移动到油滴表面,发生构象重排[27],有利于体系乳化的进行,乳化性升高。RC组表现出更好的亲水性可能是因为温度影响蛋白质降解,形成的乳化液液滴的尺寸较小,粒子不易聚集,乳液的稳定性较高[28]。
2.7 相关性分析
如表1所示,CC组与RC组相关性系数比较后发现,三大表观持水力与GP、乳化性、S0均呈现显著或极显著相关性,选取用于分析保水性的指标科学合理。值得关注的是RC组pH与其余指标的相关程度极高,再次证明温度作用下宰后肉的内环境中正负电荷平衡程度变化剧烈,并以此影响肉质及保水性。糖酵解过程对pH的作用与能量代谢密不可分。无论CC组、RC组均可见保水性与S0、GP和乳化性的关联性与成熟过程中蛋白质的性质、结构变化紧密相关,通过引发肌动球蛋白的形成使其网状结构孔隙减小、或暴露疏水基团降低保水性,以及蛋白降解使肌细胞膨胀从而提高保水性。
3 结论
(1)快速冷却处理显著提升了成熟后期牛背最长肌的表观持水力。
(2)快速冷却处理影响了宰后初期蛋白质性质的变化及糖酵解上下游产物的生成。
(3)快速冷却处理有利于加速完成肉品成熟,消减僵直引发的不良影响。
(4)快速冷却条件下完成成熟的牛肉,在热作用下具有更好的保水性,对肉品加工有积极作用。
