魟肠炎致病菌的分离鉴定及药敏实验分析
2018-12-15刘方罗霞巩华常彦红宋晶时彦民
刘方,罗霞,巩华,常彦红,宋晶,时彦民*
(1.济宁市渔业监测站,山东 济宁272000; 2.中国水产科学研究院珠江水产研究所,广州510000;3.济宁学院生命科学与工程系,山东 济宁 272000;4.济宁市任城区水产局,山东 济宁272000)
魟(Potamotrygonleopoldi)是中生代的侏罗纪(约1.8亿年~1.4亿年前)出现的鲨的同类,黑白魟学名为豹江魟(PotamotrygonLeopoldi),为燕魟目,魟科,豹江魟属一种淡水鱼类。黑白魟分布于南美洲巴西申古河流域,外形奇特,色彩美丽,软骨无鳞,胸鳍发达,如蝶展翅,尾呈鞭状,有毒刺。黑白魟的特征为黑色的盘,体上点缀着白色圆点(通常成3、2、1排列),该品种主要分布在巴西申古河流域,是观赏鱼中国进口的主要品种之一,因品种不同价格在1 000~20 000元/尾不等。其外形美观、独特,具有较高的观赏价值,在中国观赏鱼养殖中很受欢迎。魟适合在淡水中养殖,适宜水温为26~32 ℃;养殖水体pH为6.0~7.5,硝酸盐含量为100~300 mg/L;养殖水体要求透明,且氧含量高(充气量40 L/min,充气泵24 h开通)。其饵料主要为贝类、甲壳类、小鱼等。目前关于魟的研究主要侧重于魟的软骨多糖的生物活性研究[1-3],而关于魟病害诊断和防治的研究罕见报道。
肠炎是鱼类养殖过程中的常见病害,如草鱼[4]、青鱼[5]等,诱发鱼类肠炎主要包括寄生虫、细菌、病毒等生物因素,其中以细菌性病因居多。细菌性肠炎基本以嗜水气单胞菌(Aeromonashydrophila)为主要诱因,有时单独或混合感染豚鼠气单胞菌(Aeromonascaviae)及温和气单胞菌(Aeromonassobria)。另有霍乱弧菌(Vibriocholerae)诱发南美白对虾(Penaeusvannamei)肠炎[6]以及恶臭假单胞菌(Pseudomonasputida)致使黑鲷(Sparusmacrocephlus)发生肠炎症状[7]的报道,可见水产动物诱发肠炎的致病细菌具有多样性。魟肠炎是养殖过程中易出现的主要病害之一,严重时可引起全缸魟发病甚至死亡,应引起足够重视。但该病具体是由何种病因引起以及致病机理研究较少,需进一步探究。
2016年7月,山东省济宁市某观赏鱼养殖场魟爆发大面积肠炎病,造成巨大经济损失。为明确该病致病原因并提出对应的治疗方案,本实验室针对魟肠炎致病菌进行了分离鉴定及药敏实验,以期为魟养殖过程中有效防治肠炎疾病提供参考。
1 材料与方法
1.1 仪器与试剂
显微镜及显微成像系统(Cx31)购于奥林帕斯株式会社;恒温培养箱(DNP-9082)购于上海三发科学仪器有限公司;高压灭菌锅(YXQ-LS-50SII)购于上海博讯实业有限公司。
PCA培养基购于北京陆桥技术有限责任公司,营养肉汤培养基购于青岛海博生物科技有限公司,MHB液体培养基购于北京陆桥技术有限责任公司,革兰氏染色试剂盒购于北京陆桥技术有限责任公司,API 20NE试剂条购于法国生物梅里埃股份有限公司。0.65%无菌生理盐水、哥伦比亚血平板与氧化酶试剂均购于青岛海博生物科技有限公司,DNA提取试剂盒购于康宁生命科学有限公司,Plasmid Mini Kit试剂盒购于天根生化科技有限公司,EcoRⅠ和Hind Ⅲ及PCR反应试剂购于大连宝生物工程有限公司,药敏试纸购于杭州天和微生物试剂有限公司。
1.2 致病菌的分离和鉴定
1.2.1 样品采集
济宁市某观赏鱼养殖户养殖的魟发病,其规格横径(15.0 ± 1.0)cm,体重(130.0 ± 10.0)g,表现为体色发黑,甩头,打喷嚏,部分魟有拖便现象,粪便为淡黄色,腹部肿胀。3尾表现为发病症状并死亡,迅速冷藏并带回实验室解剖观察。
1.2.2 细菌的分离纯化
体表消毒用75%酒精棉擦拭,无菌操作剪开其腹部,用接种环蘸取肝脏组织液,于PCA培养基划线接种,28 ℃温度下培养24~48 h,挑取形态特征一致的菌落再纯化,获得纯化的菌株JY-04,保存于4 ℃冰箱备用。
1.2.3 人工回归感染实验
挑取培养24~36 h的JY-04接种于MHB液体培养基,28 ℃扩增培养24~36 h。发酵液5 000 r/min离心30 min去上清,然后用0.65%无菌生理盐水稀释沉淀,10倍梯度稀释法制成不同浓度菌悬液,血球计数板计数,选取约1×108CFU/mL的菌悬液进行感染实验。
以草鱼作为替代品种进行人工回归感染实验。健康的草鱼(体长10~15 cm)在水族箱暂养10 d,实验水族箱规格为85 cm×62 cm×72 cm,水族箱盛水90 L左右,调试水温(28 ± 2) ℃,暂养1周,暂养期间每天或每2天投喂1次,实验开始前,停食24~48 h。共80尾实验鱼,分4个实验组,每组20尾。1号水族箱作为阴性对照,注射等量的无菌生理盐水;2号、3号、4号水族箱进行感染实验,用连续注射器腹腔注射1×108CFU/mL的菌悬液,感染剂量0.2 mL/尾。观察发病鱼体症状3~5 d,对发病的实验鱼进行病原菌的分离及鉴定。
1.2.4 镜检观察及溶血实验
将分离纯化的菌株JY-04革兰氏染色,油镜下显微镜观察细菌形态[8-10]。因有报道溶血价显著受培养温度的影响[11],纯化的细菌划线血平板,分别在不同温度下进行培养。综合考虑魟适宜的温度范围,选择28 ℃和33 ℃下分别培养48~72 h,观察是否出现溶血现象。
1.2.5 生理生化鉴定
氧化酶试剂按说明书要求配置并进行操作,无菌吸管吸取1滴氧化酶试剂滴于吸水滤纸上,用玻璃棒蘸取纯化的菌落,点在吸水滤纸的氧化酶试剂上,7 s内观察是否有显紫色,如果有显紫色则判定为阳性,则选择API 20E试剂条进行下一步实验。挑取3~4个JY-04菌落放入5 mL生理盐水中,制成0.5麦氏浊度菌悬液(约1×107CFU/mL),接种于API 20E试剂条中,在28 ℃下培养24~48 h,记录实验结果并通过APIWEBTM软件(法国生物梅里埃股份有限公司)进行分析。
1.2.6 分子鉴定
菌株JY-04经营养肉汤培养24 h后,在转速5 000 r/min下离心20 min后收集菌体,按细菌DNA提取试剂盒说明及步骤提取菌株JY-04基因组DNA。
菌株JY-04的16S rRNA基因选择的通用引物为:F1:5′-AGAGTTTGATCCTGGTCAGAACGAACG-CT-3′,R1:5′-TACGGCTACCTTGTTACGACTTCA-CCCC-3′,由生工生物工程(上海)股份有限公司合成。按照以下程序进行PCR扩增:先在94 ℃预变性3 min;随后94 ℃ 变性30 s,50 ℃维持30 s,72 ℃维持90 s,共30个循环;72 ℃延伸10 min,在4 ℃保存。反应体系见表1。

表1 PCR反应体系Tab.1 The system of PCR reaction
扩增产物经琼脂糖胶回收纯化,与 T4 载体连接, 转化感受态细胞大肠杆菌 DH5α,转化子用试剂盒 Plasmid Mini Kit T4 提取质粒,EcoRⅠ和HindⅢ酶切鉴定插入片段大小, 挑取阳性转化子送生物测序公司完成序列测定。将所测序列与GenBank中序列BLAST相似性比较。根据比对结果检索出同源性较高的序列,采用 ClustalX和Mega 5.0生物软件分析其同源性,并构建系统进化树。
1.2.7 致病菌药敏实验
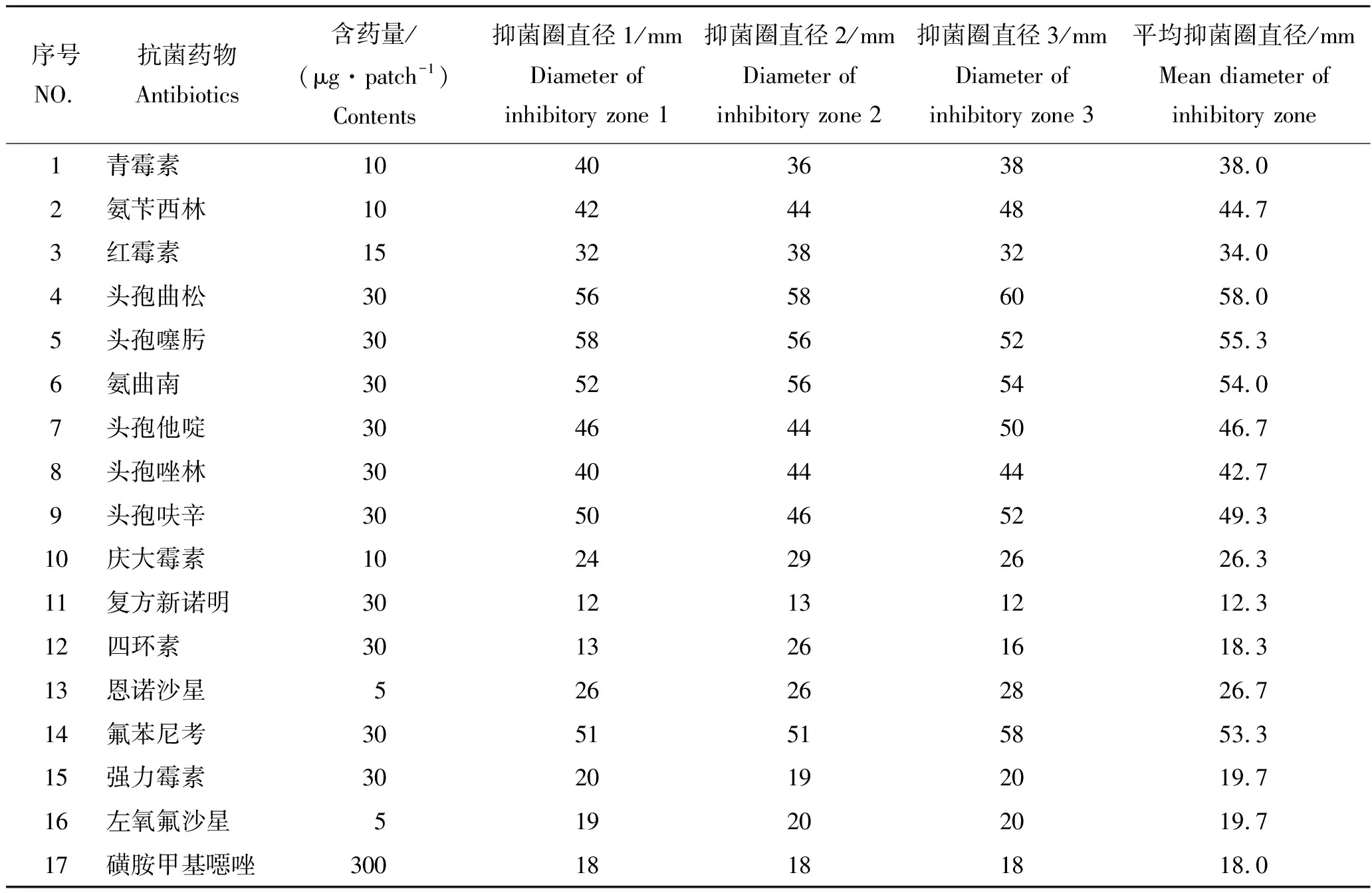
挑取菌株JY-04单菌落于1 mL 0.65%的生理盐水中,振荡器混匀,制成菌悬液(约1.0×107CFU/mL),无菌枪头定量吸取0.2 mL菌悬液于一次性培养皿,倒入PCA培养基(温度约48 ℃),平板冷却凝固后加入药敏试纸片,恒温28 ℃培养 24 h 后测量抑菌圈直径 (mm)。每个培养皿可以放2~4片不同抗生素种类药敏试纸,根据抑菌圈的大小来评估其对该抗生素的敏感程度,抑菌圈直径Φ> 20.0 mm判为高度敏感;10.0 mm <Φ≤ 20.0 mm为中度敏感;0 mm <Φ≤ 10.0 mm判为低度敏感;Φ=0 mm判为不敏感[12]。
本次实验共针对青霉素、氨苄西林、红霉素、头孢曲松、头孢噻肟、氨曲南、头孢他啶、头孢唑林、头孢呋辛、庆大霉素、复方新诺明、四环素、恩诺沙星、氟苯尼考、强力霉素、左氧氟沙星、磺胺甲基噁唑等抗生素开展了研究,根据实验结果结合水产用药名录综合筛选敏感抗生素。
2 结果与分析
2.1 病鱼外观特征
发病的魟皮肤发暗,黑色体表与白色点对比不明显,病鱼眼睑凹陷,眼球外凸(图1A a);腹部颜色变暗,腹部肿大,肠腔高度扩张,其内充满透明积液(图1B e),肠道色泽光亮,未见糜烂现象,肛门处伴有拖便现象(图1B c)、解剖后肝脏颜色呈黄色(图1B d),易碎呈糜样,其他未见异常。

图1 发病魟鱼的观察与解剖a:眼睑凹陷;b:黑色体表与白色点对比不明显;c:肛门拖便;d:肝脏呈黄色;e:肠腔扩张并充满积液。Fig.1The observation and anatomy of stingray enteritisa: The eyelid sag; b: The black surface and the white dot are not obvious; c: Anal defecation; d: The liver is yellow;e: The intestine dilates and is filled with fluid.
2.2 致病菌分离纯化
从发病的魟肝组织中分离得到形态一致的菌株(命名为JY-04),28 ℃培养24 h后观察PCA培养基菌落形态:该菌落呈现湿润、光滑、圆形、较隆起、直径约1 mm,半透明灰白色的小菌落(图2),挑取单菌落进行纯化培养,并保存菌株。
2.3 人工回归感染实验
在回染攻毒实验中,因魟价格昂贵,本实验选择替代品种进行实验。目前国内已有草鱼感染霍乱弧菌的相关研究报道[13],且草鱼作为替代品种具有自身优势:其苗种市场化程度较高,不同规格草鱼苗种及配套养殖饲料均可以快速购置,有利于快速开展感染实验研究,因此本研究选择草鱼进行攻毒实验。
图2 致病菌分离纯化Fig.2The isolation and purification of pathogenic bacteria
人工注射感染1 d后,2号、3号、4号水族箱的草鱼,活动迟缓,腹部肿胀,肛门红肿,实验鱼陆续死亡;而1号水族箱内的草鱼没有出现异常症状,吃食量正常。解剖2号、3号、4号水族箱的发病草鱼,发现腹腔内有腹水,肝脏颜色发白,从其肝胰脏重新分离到该菌。如表2所示,该致病菌注射感染3 d,实验鱼发病率高达100%,旁证JY-04菌株具有较强的致病性;且由于感染致病菌菌悬液浓度相同(约1×108CFU/mL),3个水族箱的实验鱼的发病率和死亡率均接近。本次感染实验选择替代品种进行,推测JY-04为魟鱼肠炎的致病菌,但后续工作在条件充足时仍有必要进行。
2.4 细菌的显微观察及溶血实验
革兰氏染色实验表明,JY-04为革兰氏阴性菌,在油镜下观察其形态为弯曲呈弧形杆菌,两端钝圆(图3A)。将纯化的菌落接种于血琼脂平板,放置在33和28 ℃下分别培养。33 ℃培养48~72 h后,血平板出现溶血现象,在血平板上生长的菌落周围出现明显的透明溶血带(图3B),这说明JY-04能够释放溶血素,降解血细胞,使血平板溶血呈现透明,也从侧面表明其对鱼体的致病性;在28 ℃培养72 h未见溶血现象。溶血现象的发生与培养温度可能存在一定关系。蒙爱云等[11]研究了14株无乳链球菌的溶血价,发现溶血价显著受培养温度的影响。11株无乳链球菌的溶血价在37 ℃时最高,2株在25 ℃时最高、1株在30 ℃时最高。董新波等[14]通过研究发现温度能够调节副溶血弧菌的运动能力。本实验中在33 ℃出现溶血,说明JY-04在较高温度下分泌溶血素,此外,本研究结果也进一步印证了溶血现象受温度的影响明显。

表2 人工感染实验结果Tab.2 The results of artificial infection
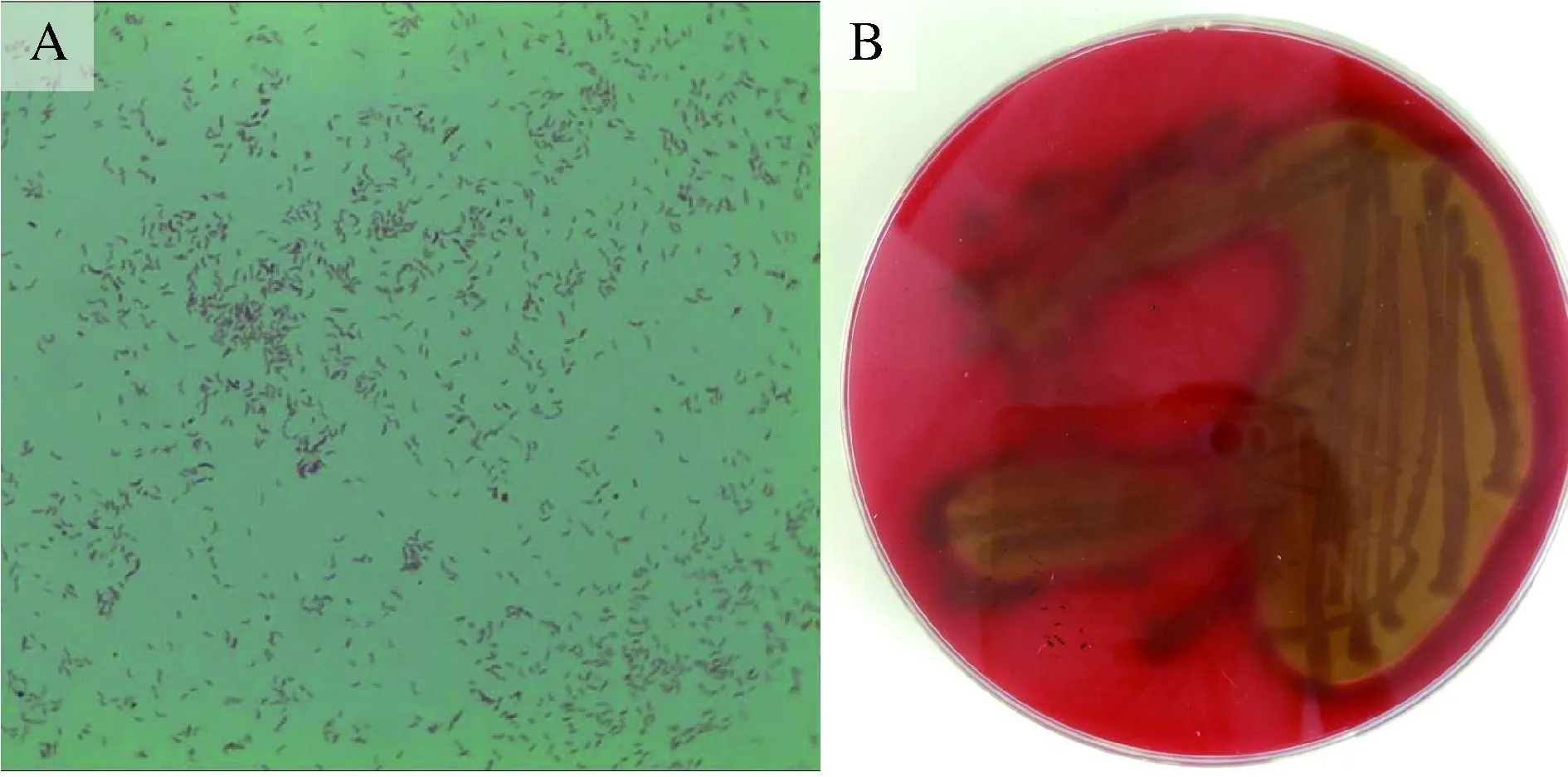
图3 菌株JY-04革兰氏染色显微观察及血平板溶血实验A: 革兰染色后显微镜下菌体; B: 血平板溶血实验(33 ℃培养72 h)。Fig.3Microscopic observation under gramstaining and blood plate hemolysis test for strain JY-04A: The gram-staining bacteria in microscope;B: The blood plate hemolysis test.
2.5 生理生化鉴定
JY-04菌株氧化酶实验结果为阳性(图4)。经API 20NE细菌分析鉴定试剂条鉴定(表3),菌株JY-04为霍乱弧菌或者嗜水气单胞菌/豚鼠气单胞菌,鉴定准确率(ID)分别为46.3%和46.8%。因鉴定ID偏低,无法确定种类,需进一步通过分子鉴定实验确定。
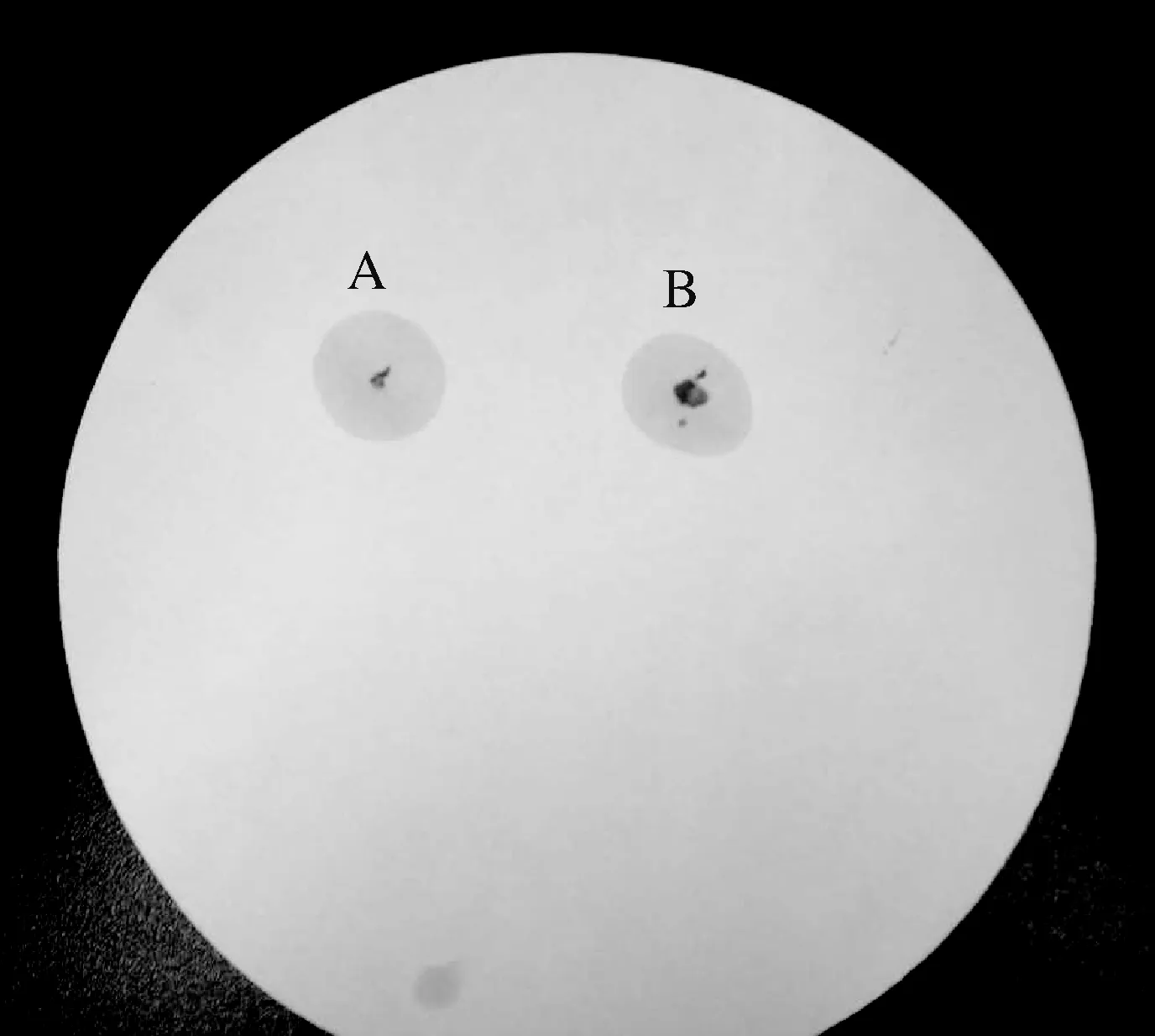
图4 氧化酶实验结果A、B:同一菌株的两次重复试验。Fig.4Experimental results of oxidaseA, B: Two repeated tests of the same strain.
2.6 分子鉴定实验
以细菌通用引物F1、R1为引物和提取的DNA为模板, PCR扩增得到约1 500 bp的条带,胶回收并测序后获得1 037 bp的序列(图5)。通过与GenBank中序列进行BLAST分析比对,菌株JY-04与霍乱弧菌霍乱生物型(Vibriocholeraebiotypecholerae)及霍乱弧菌易北河生物型(Vibriocholeraebiotypealbensis)的同源性均达99%。利用ClustalX和Mega 5.0生物软件构建系统进化树(图6),结果显示菌株JY-04与霍乱弧菌易北河生物型(Vibriocholeraebiotypealbensis)聚为一支。

表3 菌株JY-04生理生化鉴定结果Tab.3 The physiological and biochemical identification results of strain JY-04
注:+表示阳性,-表示阴性。
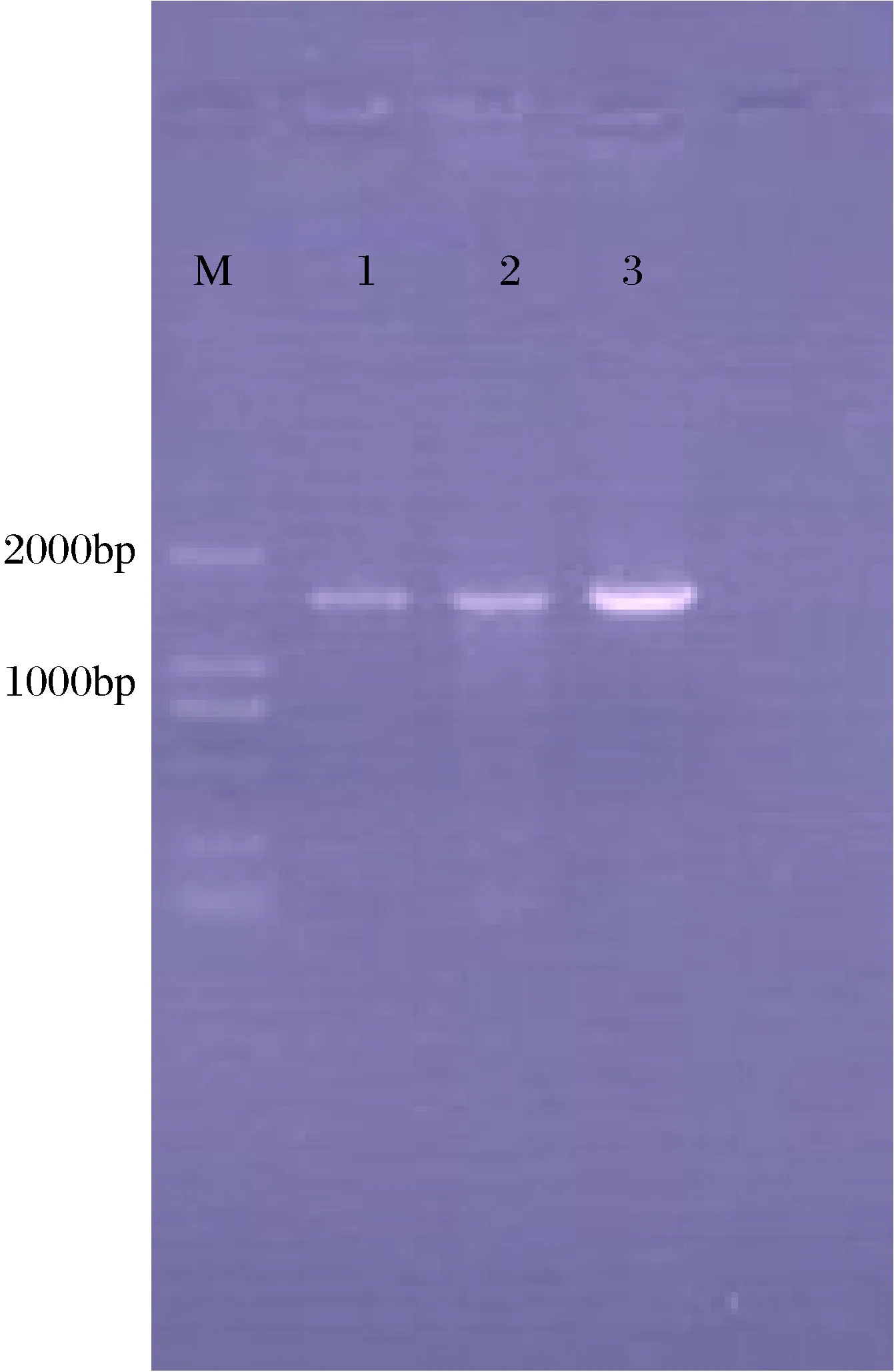
图5 JY-04 16S rRNA基因的PCR扩增产物M:分子量2000 marker;1,2,3:菌株JY-04的16S rRNA扩增产物。Fig.5 The PCR amplification product of 16S rRNA geneM: DL2000 marker; 1, 2, 3: 16S rRNA gene amplification product of strain JY-04.
2.7 药敏实验分析
实验结果如表4所示,菌株JY-04对复方新诺明、四环素、强力霉素、左氧氟沙星、磺胺甲基噁唑等5种抗生素中度敏感;对青霉素、氨苄西林、红霉素、头孢曲松、头孢噻肟、氨曲南、头孢他啶、头孢唑林、头孢呋辛、庆大霉素、恩诺沙星、氟苯尼考等12种抗生素为高度敏感。在农业部水产用药名录内筛选,其中氟苯尼考的抑菌效果最好,建议养殖户以每千克鱼体重添加10 mg 氟苯尼考的剂量,拌饵投喂治疗3~5 d,养殖户按照建议施用5 d后,魟肠炎得到有效控制,未再现发病及死亡现象。
3 讨论
3.1 发病原因分析
发病魟的养殖场调研发现,其养殖方式为鱼缸养殖,循环水反复过滤,水体为地下水,经过简单晾晒,而未进行阳光暴晒或消毒,留下细菌增殖的隐患;且养殖户为室内养殖,养殖环境阴暗潮湿,相对湿度大于70%,进入后能闻到较浓的的霉味,霉菌易滋生,养殖空气环境不良,易给水体质量造成不良影响。

图6 基于16S rDNA序列构建的系统进化树Fig.6 The phylogenetic tree based on the 16S rDNA sequence of the strain JY-04
序号NO.抗菌药物Antibiotics含药量/(μg·patch-1)Contents抑菌圈直径1/mmDiameter of inhibitory zone 1抑菌圈直径2/mmDiameter of inhibitory zone 2抑菌圈直径3/mmDiameter of inhibitory zone 3平均抑菌圈直径/mmMean diameter of inhibitory zone1青霉素1040363838.0 2氨苄西林1042444844.73红霉素1532383234.04头孢曲松3056586058.05头孢噻肟3058565255.36氨曲南3052565454.07头孢他啶3046445046.78头孢唑林3040444442.79头孢呋辛3050465249.310庆大霉素1024292626.311复方新诺明3012131212.312四环素3013261618.313恩诺沙星526262826.714氟苯尼考3051515853.315强力霉素3020192019.716左氧氟沙星519202019.717磺胺甲基噁唑30018181818.0
魟的亲鱼生殖方式为卵胎生,在该养殖场中,生产的幼苗(横径8~10 cm)每8尾放置于1个处于暗环境的鱼缸(约100 cm×40 cm×30 cm)内,外加黑布,防止小魟鱼苗受刺激而发生应激反应。鱼缸较小,水体无循环有增氧设备,但是缸体水位较浅,充氧设备通入的气体未充分与水体接触便出水体,实际有效溶氧较低,是否能同时满足8尾魟的溶氧需求有待进行下一步研究。水体为地下水无消毒,也未添加任何药物,水温加热到30~32 ℃后加入鱼缸内,小鱼缸内养殖8尾魟,单位个体所占有的水体空间相对较小,魟的幼体相互碰撞易诱发应激反应,另外本实验中使用到的发病鱼为刚生产14 d的魟幼体,其免疫力相对较低,易受到致病菌的侵染。
本研究从发病的魟中分离出的致病菌,均为单一相似的菌落形态,结合使用显微观察、API细菌鉴定、16S rRNA鉴定结果及系统发育树构建,可以确认本次魟肠炎致病菌JY-04为霍乱弧菌。霍乱弧菌在自然水域、水产动物体表及体内广泛存在,由于该菌为条件致病菌,是否产生霍乱肠毒素是决定其毒力的主要因素[15],大多数霍乱弧菌环境菌株不产生霍乱毒素[16-17],在类似养殖环境的条件下可以获得霍乱毒素基因[18-19],从而使非致病性霍乱弧菌菌株转变成致病性流行菌株[20]。徐怀恕等[21]和许兵等[22]证实了霍乱弧菌活的不可培养状态的存在,处于活的不可培养状态的霍乱弧菌,细胞缩小呈球形,添加一定化学物质刺激菌体可长大(即活的),但在常规培养基上不能繁殖,故无法用常规法检测。养殖环境中的存在某些物理、化学、生物因子,可以使致病菌从活的不可培养状态向活的可培养状态转化[18]。适宜的环境中致病菌大量繁殖,增加了养殖环境中的菌体数量,间接提高了染病机率。本研究中养殖环境或魟体内存在的致病菌株可能受外界某种因素刺激使其产生了致病性,具体何种因素有待进一步研究证实。
3.2 霍乱弧菌对水产养殖业的危害及耐药性分析
霍乱弧菌是水体微生物区系的成员,在河水、湖水、河口水以及沿岸海水中广泛存在[23-24],有研究证实该菌也存在于牡蜗、蓝蟹等水产动物的体表及体内[22],霍乱弧菌对水产动物具有一定的致病性,能引起虾[25]、鱼[26]、贝类[27]及其他水生动物[26]发病死亡,造成严重的养殖损害。霍乱弧菌共4个生物型[27]:霍乱弧菌霍乱生物型(Vibriocholeraebiotypecholerae)、霍乱弧菌埃托尔生物型(Vibriocholeraebiotypeeltor)、霍乱弧菌变形生物型(Vibriocholeraebiotypeproteus)、霍乱弧菌易北河生物型(Vibriocholeraebiotypealbensis)。聚类分析结果显示JY-04菌株与霍乱弧菌易北河生物型亲缘关系最近,但聚类分析结果也可能是由于分子水平检测的少量基因误差造成的,因此无法根据此结果断定其为霍乱弧菌易北河生物型。生理生化实验证实JY-04能够发酵甘露糖,与伯杰细菌鉴定手册表述霍乱弧菌易北河生物型不发酵甘露糖相抵触,分析认为个别糖发酵的不同可能是由菌株变异所致,因此不能排除霍乱弧菌易北河生物型的可能性。综合细菌形态观察、API生化鉴定及分子实验只能确定JY-04为霍乱弧菌,具体为何种生物型仍需进一步研究。
目前国内文献关于霍乱弧菌易北河生物型的研究报道较少。仅见1985年陈掌纶等[28]报道了从发光猪尸分离鉴定了一株易北河弧菌,并利用小白鼠进行攻毒实验,证实6.3×107CFU/mL肉汤菌悬液腹腔注射0.1 mL就可以使小白鼠其在48 h内死亡,并再次分离到该菌株,证实易北河弧菌具有一定致病性,但霍乱弧菌易北河生物型是否对水产动物具有致病性尚未见报道。
国内学者相继报道了暗纹东方鲀(Takifuguobscurus)[29]、草鱼[13]、鳄(Crocodilus)[30]、异育银鲫(Carassiusauratusgibelio)[31]等感染霍乱弧菌而发病的研究成果,可见霍乱弧菌能够对多种水产动物产生危害,而魟感染霍乱弧菌发生肠炎尚未见报道。2009年邴旭文等[32]报道了从江苏连云港某养殖场养殖死亡的泥鳅的肝脏、血液及腹水中分离出大量优势生长的细菌,鉴定其与霍乱弧菌具有较高的相似性,49种抗菌药物的耐药实验证实该菌株对氨苄西林、四环素等6种抗生素不敏感,而本研究证实JY-04对氨苄西林、四环素抗生素均高度敏感;2016年曹海鹏等[6]报道了南美白对虾白斑综合征的致病菌经分离鉴定为霍乱弧菌,药敏实验证实分离的菌株对氨苄西林、磺胺甲氧嘧啶、头孢他啶、头孢呋新、头孢噻肟、呋喃唑酮、复方新诺明等8种抗生素产生耐药性,而本次药敏实验证实JY-04对氨苄西林、磺胺甲氧嘧啶、头孢他啶、复方新诺明等抗生素均呈现敏感性。
有研究认为泥鳅[32]、南美白对虾[6]源霍乱弧菌耐药性的产生原因可能与菌株的生存环境、药物使用频次、基因变异和自然选择有关。本实验中魟源霍乱弧菌JY-04未呈现抗生素的耐药性,这可能与养殖户从未使用抗生素进行预防和治疗有关,说明在水产动物养殖过程中有效减少抗生素的使用及科学用药是降低霍乱弧菌耐药性的有效手段。虽未见魟中霍乱弧菌JY-04产生耐药性,但是在其他水产养殖动物[23,26,28]中呈现的耐药性应该引起足够重视并加强监控和防范。霍乱弧菌为人、鱼共患致病菌,实验及养殖过程应加强预防措施,防止人体感染,加强养殖环境室内通风,增加除湿设备,定期清理鱼缸并灭菌,避免大规模疫病的流行及暴发。
4 结论
本研究对山东省济宁市某观赏鱼养殖场患肠炎的魟进行取样调查,经菌株分离纯化、回归感染、显微观察、溶血试验、生理生化及分子鉴定及药敏试验确定,魟肠炎的致病菌为霍乱弧菌。根据本次药敏实验结果并结合农业部水产养殖用药名录,可以选择氟苯尼考等敏感抗生素对魟进行积极治疗,按照10 mg/kg剂量每24 h拌饵一次,治疗3~5 d。该研究将为魟肠炎的病原菌分析及科学治疗提供参考依据。
