荷载溶瘤病毒细胞载体的研究进展
2018-12-14方敬敬
方敬敬,唐 慧
(1.昆明理工大学 医学院,云南 昆明 650504;2.云南省第一人民医院 昆明理工大学附属医院 临床基础医学研究所云南省临床病毒学重点实验室 昆明市肿瘤分子与免疫防治重点实验室,云南 昆明 650032)
近年来,肿瘤免疫治疗取得飞速发展,引领了肿瘤治疗领域的重大突破。2015—2018年,肿瘤的免疫治疗已连续4年蝉联美国临床肿瘤学会(American Society of Clinical Oncology, ASCO)年度报告的“临床肿瘤年度进展”[1-4]。
溶瘤病毒(oncolytic virus)是指将某些嗜人病毒通过基因工程改造后,成为能有效感染肿瘤细胞并在其中大量复制、导致肿瘤细胞溶解的基因工程病毒。自2015 年 10 月美国FDA批准了首个溶瘤病毒疗法ImlygicTM(talimogenelaherparepvec, T-VEC)用于治疗黑色素瘤以来,溶瘤病毒的研究和应用迈入了全新的发展阶段,愈来愈受到人们的重视和关注。溶瘤病毒可经瘤内注射和静脉注射,瘤内注射可治疗实体瘤或部位局限的肿瘤,而静脉注射可治疗转移性肿瘤,但静脉给药易被循环系统稀释,疗效降低[5]。因此,研究开发以细胞为运载工具的新型给药方式,利用某些细胞具有靶向肿瘤部位这一特性,通过系统给药将其所携带的溶瘤病毒运输到肿瘤部位是现今溶瘤病毒研究的一大热点。
1 细胞载体的优势
用细胞作为溶瘤病毒运输载体的优势在于:溶瘤病毒装载于细胞载体中,可以减少溶瘤病毒与体液环境直接接触,避免抗体中和作用。并且,用于溶瘤病毒运输的细胞载体,可同时作为病毒增殖的宿主,通过溶瘤病毒在载体细胞中的增殖作用,最终在肿瘤病灶释放的溶瘤病毒滴度可获得大幅提高。用细胞作为载体装载溶瘤病毒,将其高效输送至肿瘤病灶,高效发挥免疫/溶瘤双重抗肿瘤作用[5]。目前已报道用于荷载溶瘤病毒的细胞载体主要有3类:具有淋巴细胞特性的细胞载体;具有干细胞特性的细胞载体;具有肿瘤细胞特性的细胞载体等(表1)。
2 具有淋巴细胞特性的细胞载体
具有淋巴细胞特性的细胞载体主要是一些自身免疫细胞或过继免疫细胞,最常用的如细胞因子诱导的杀伤细胞(cytokine induced killer, CIK)、外周血淋巴细胞(peripheral blood lymphocytes, PBLs)和树突状细胞(dendritic cells,DCs)等。这类细胞在荷载了溶瘤病毒后,可通过趋化作用进入肿瘤组织,避免了病毒通过脉管运输被非特异性结合或清除,而且引发急性炎性反应,进一步增强抗肿瘤效应,最终实现协同抗肿瘤效果。
2.1 CIK细胞
利用CIK细胞作为病毒载体的运载工具,通过CIK细胞的肿瘤归巢特性,将病毒携带至肿瘤位点,解决患者肿瘤生长转移的给药难题。早期,用CIK细胞作为载体,成功的将痘病毒运输到肿瘤部位,证明了其作为载体的可行性[6]。近来,一些研究以CIK细胞为载体成功的将麻疹病毒运载到小鼠皮下骨髓瘤部位或是将溶瘤腺病毒成功的靶向到了小鼠肝癌部位[7]。这些研究结果均提示CIK是一种具有广阔临床应用前景的体内病毒运输载体细胞。
2.2 PBLs和DCs
PBLs和DCs作为荷载溶瘤病毒的细胞载体,可以利用肿瘤的转移将溶瘤病毒输送至淋巴结,并清除肿瘤转移病灶,两者通过初级T细胞应答清除转移瘤的机制基本相同。由于PBLs和DCs细胞载体能够高效靶向至肿瘤浸润部位,并且它的分离技术相对简单,被广泛应用于临床。用未成熟的DCs、淋巴因子激活的杀伤细胞、淋巴因子激活的DCs荷载呼肠孤病毒(reoviridae)在腹水存在的条件下来治疗卵巢癌, 发现淋巴因子激活的DCs作为细胞载体荷载呼肠孤病毒对肿瘤的杀伤力最强,并且能够最大限度地发挥免疫/溶瘤双重抗肿瘤作用,该研究结果提示DCs作为病毒疗法的细胞载体具有良好的临床应用前景,为在临床上治疗卵巢癌提供了一种新的方法[8]。

表1 荷载溶瘤病毒的细胞载体Table 1 Cell carries for oncolytic virus
3 具有干细胞特性的细胞载体
具有干细胞特性的细胞载体的靶向性与肿瘤微环境有关,主要包括间充质干细胞(mesenchymal stem cells, MSCs)和内皮祖细胞(endothelial progenitor cells, EPCs)等。具有干细胞特性的细胞载体可以在肿瘤病灶局部表达那些无法进行全身给药的药物,同时其自身具备的趋化归巢能力使其可自行迁移至无法进行手术切除、甚至影像学无法发现的微小肿瘤转移灶发挥作用。
3.1 MSCs
MSCs对肿瘤细胞有天然的靶向性同时可荷载溶瘤腺病毒(adenovirus)提高抗肿瘤效果。目前通过干细胞荷载病毒的肿瘤靶向疗法正在成为一个广泛使用的癌试验性治疗手段。在转移性乳腺癌、卵巢癌的研究表明,新城疫病毒(newcastle disease virus)感染的骨髓间充质干细胞具有协同抗肿瘤作用,并在恶性胶质瘤的小鼠模型中证实了间充质干细胞荷载溶瘤腺病毒的可行性。应用干细胞荷载溶瘤性单纯疱疹病毒(oncolytic herpes simplex virus)治疗黑色素瘤脑转移患者的研究结果证实了干细胞及其所荷载的溶瘤病毒在肿瘤治疗中发挥了协同效应[9]。骨髓间充质干细胞荷载的新城疫病毒所引起的胶质瘤细胞的凋亡率远高于直接用新城疫病毒感染胶质瘤细胞时的凋亡率,并且应用骨髓间充质干细胞荷载的新城疫病毒可以增强胶质瘤细胞对γ辐射的敏感性,因此间充质干细胞荷载的新城疫病毒联合放疗有望成为治疗胶质母细胞瘤的新方法[10]。
3.2 EPCs
EPCs是从人体外周血中分离出来的,在正常情况下,EPCs在外周血中数量极少,而在骨髓中仅有的少量EPCs,且通常处于休眠状态,但是在机体处于病理状态时,EPCs会大量的进入机体血液循环,特异性地定植于肿瘤部位,参与肿瘤血管的再生,大多数肿瘤患者外周血中EPCs的增多与肿瘤的分期及大小呈正相关,并且与患者的生存率呈负相关,而且肿瘤的生长、浸润和转移都依赖于肿瘤血管的新生[11]。溶瘤病毒与EPCs都可阻滞血管新生,由于其无自身免疫原性,无排斥反应,并且有很高的传导效率,可以抑制卵巢癌、前列腺癌和乳腺癌等肿瘤的生长。因此应用内皮祖细胞作为载体荷载溶瘤病毒应用于肿瘤治疗将成为今后肿瘤免疫治疗的一个崭新策略。
4 具有肿瘤细胞特性的细胞载体
具有肿瘤细胞特性的细胞载体包括肿瘤相关巨噬细胞(tumor-associated macrophages, TAMs)和肿瘤细胞囊泡(tumor cell-derived MPs, T-MP)等。M1型TAMs可促进Th1和Th2反应,具有抗原呈递功能,且可促进组织再生和炎性反应的消退,因此具有强大的抗菌和抗肿瘤活性。由于目前尚缺乏用于研究人免疫反应的临床前实验动物[12],因此TAMs与溶瘤病毒的相关研究报道很少,研究仅局限于单纯疱疹病毒(herpes simplex virus)、腺病毒(adenovirus)、水泡性口炎病毒(vesicular stomatitis virus)。T-MP作为一种全新载体,其本身的亲源性和其从肿瘤细胞分泌等特性,不仅可以逃避机体对病毒的免疫消除,而且还可以跨越细胞膜,将病毒传递到细胞核进行病毒复制和组装,从而导致肿瘤细胞特别是致瘤性癌细胞的自身瓦解,从而展现出很强的体内治疗效果[13]。T-MP携带腺病毒在体内和体外试验中均能有效地靶向和杀伤癌细胞,作为一种新型的腺病毒载体系统,其具有很好的临床应用前景。
5 细胞荷载溶瘤病毒的临床应用
截至目前,在美国国立卫生研究院(NIH)的临床试验注册中心(https://clinicaltrials.gov/ct2/home)可检索到的,基于细胞荷载的溶瘤病毒治疗肿瘤的Ⅰ/Ⅱ期临床试验共有10项 (表2)。其中,GL-ONC1在对实体瘤患者Ⅰ期临床试验正在研究中,分别对实体瘤患者给予单剂量和多剂量静脉注射,剂量范围为1×109pfu/kg~5×109pfu/kg,评估GL-ONC1在体内的药代动力学和药效学特征,预计2019年得出临床实验结果。目前,在NIH临床试验注册中心可检索到用伊匹单抗结合Pexa-Vec治疗转移性/晚期实体瘤正在进行中,以确定腹腔内注射伊匹单抗联合溶瘤病毒Pexa-Vec的可行性、 安全性和抗肿瘤作用。Ⅰ型单纯疱疹病毒的溶瘤突变体HF10[14]是一种安全有效的抗原发肿瘤和转移肿瘤的生物制剂,其与伊匹单抗(商品名Yervoy,药品名ipilimumab)[15]联合治疗转移性黑素瘤的Ⅱ期临床试验,其主要目的是确定HF10联合ipilimumab是否对ⅢB,ⅢC或Ⅳ期不可切除或转移性黑素瘤患者有效,但目前该临床试验还在进行中,尚无结果公布。
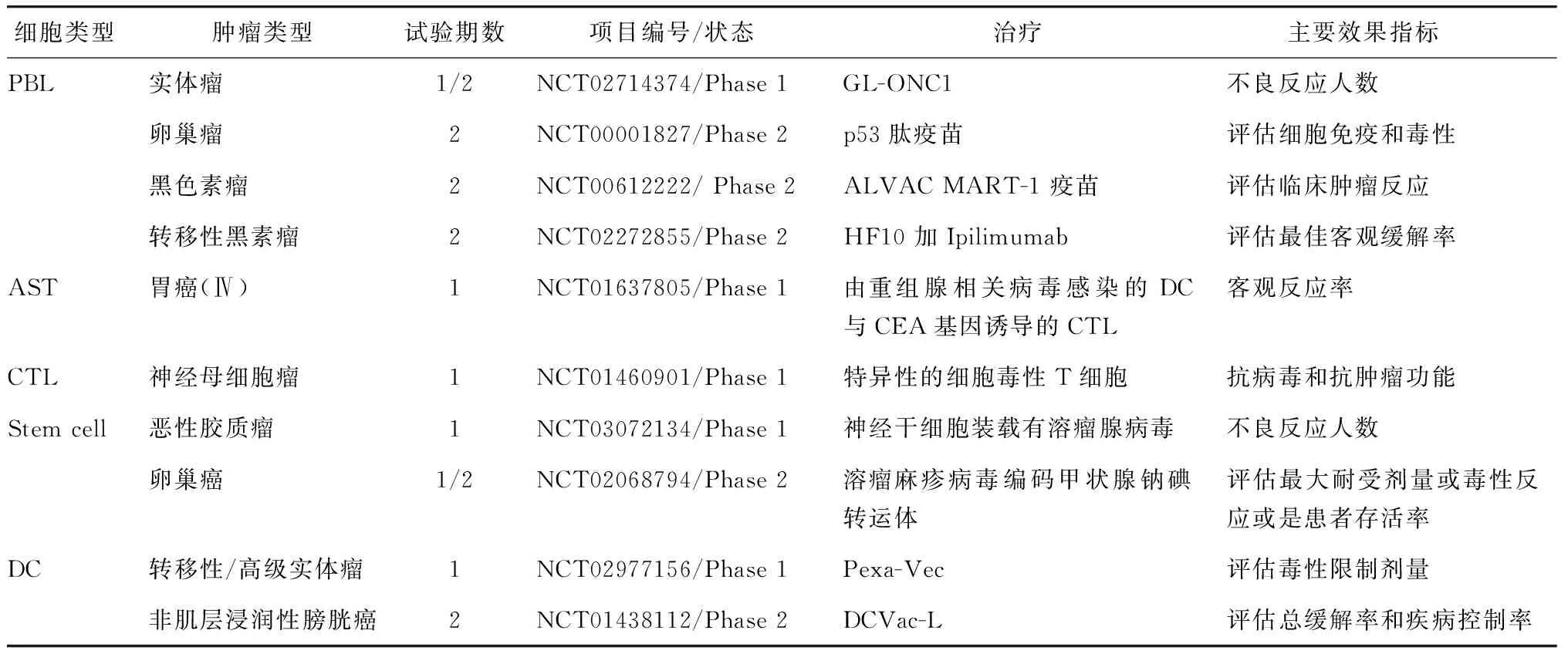
表2 应用各类细胞荷载溶瘤病毒的临床试验Table 2 Summary of oncolytic viruses loading by cell carries virotherapy clinical trials
数据来源于美国国立卫生研究中心(NIH)的临床试验注册中心().
6 细胞荷载的溶瘤病毒存在的问题和解决方法
目前,体外/体内实验和部分临床研究结果均已证实细胞荷载溶瘤病毒在抗肿瘤治疗中发挥良好效果,该疗法具有潜在的临床应用价值[16-17]。但是,细胞荷载的溶瘤病毒仍存在许多亟待解决的问题:细胞载体的肿瘤靶向性有待提高;细胞荷载的溶瘤病毒对肿瘤的治疗效果有限,可以与免疫治疗相结合,来增强其抗肿瘤效应。当其与目前肿瘤免疫治疗领域的热门方法——免疫检查点抑制剂(如PD-1/L1抗体、CTLA-4抗体等)联合时,其效力得到极大提高[18]。其中溶瘤病毒M1[19]与缬酪肽的蛋白(valosincontaining protein,VCP)抑制剂[20]联合应用使其抗癌活性增强3 600倍,预计2018年进行临床试验[21-22]。但应引起关注的是,在这些临床前研究中,细胞荷载的溶瘤病毒仍较多采用瘤内注射的方式,其临床使用方法和疗效的提高还需要时间与经验的积累,尤其是与其他现有药物的最佳联合使用方法还需要长期的摸索,但它的应用前景仍值得期待。
7 展望
细胞荷载溶瘤病毒治疗肿瘤具有广阔的应用前景,它不仅克服了静脉注射溶瘤病毒易被机体免疫系统清除的问题,又能实现将溶瘤病毒高效运输至肿瘤部位发挥抗肿瘤作用。目前,细胞荷载的溶瘤病毒除了作为单药,溶瘤病毒联合化疗、放疗和其他免疫疗法的组合用药策略正在进一步探索和研究中。相信随着肿瘤免疫学和基因编辑技术快速发展的推动下,细胞荷载溶瘤病毒用于治疗肿瘤溶瘤病毒能够成为未来肿瘤治疗中不可或缺的新兴发展方向。
