时间分辨免疫荧光法检测结核感染T细胞释放γ-干扰素的方法建立及初步临床应用*
2018-12-13谭玉华朱应竹陶佳俊吴能伟
谭玉华,朱应竹,江 燚,陶佳俊,吴能伟
(广州市丰华生物工程有限公司体外诊断试剂研发中心,广州 510730)
全球结核病2016年度报告发布,近年全球结核病患者数量仍呈上升趋势,我国结核发病人数再居全球第三位,全球结核病疫情仍然处于较高状态,控制形势依然严峻[1]。结核病依然是十大致死原因之一,肺结核发病率和死亡率均居第二位[2]。世界卫生组织也再次强调了“终止结核病策略”,但近年全球结核病的发病率仅以每年2%的缓慢速度下降。结核分枝杆菌(mycobacterium tuberclebacilosis,TB)感染的诊断一直是临床上的一个难点,因此急需新的、革命性的技术应用于结核病防控。γ-干扰素释放试验(interferon gamma release assays,IGRAs)作为结核感染筛查最新方法,已在欧美国家得到全面推广,并写入了诊疗指南,推荐替代结核菌素皮肤试验作为结核感染检测的实验室检测方法[3]。时间分辨免疫荧光法(time-resolved fluoroimmunoassay,TRFIA)是用三价稀土离子及其鳌合物为示踪剂的超灵敏度检测技术,已成为现代生物医学研究和临床超微量检验中最有发展前景的分析手段之一。笔者基于IGRAs和TRFIA原理,建立了一种TRFIA检测结核感染T细胞释放γ-干扰素(interferon gamma,IFN-γ)的方法,现报道如下。
1 材料与方法
1.1 实验样本 用肝素钠抗凝管采集了297例患者的全血样本,其中175例为已按中华医学会结核病学分会制定的《肺结核诊断和治疗指南》[4]确诊的结核病患者,包括73例结核分枝杆菌阳性肺结核患者,77例结核分枝杆菌阴性肺结核患者和25例肺外结核患者;另52例为呼吸道疾病以外的非结核患者组,70例为非结核呼吸道疾病(含肺癌)患者。
1.2 试剂和仪器 链霉亲和素购于菲鹏股份有限公司;捕获IFN-γ单克隆抗体和生物素标记IFN-γ单克隆抗体购于荷兰MabTech公司;早期分泌抗原靶蛋白6(early secreting antigen target 6,ESAT6)和培养滤液蛋白10(culture filtrate protein-10,CFP-10)购于厦门万泰凯瑞生物技术有限公司;牛血清清蛋白购于天津康源生物技术有限公司,植物血凝素L和重组IFN-γ抗原购于美国Sigma公司;N1-(P-异硫氰基苄基)-二乙三胺四乙酸铕钠购于美国PerkinElmer公司;截留分子量为10 000的超滤离心管购于美国Millipore公司;2.0 ml无内毒素离心管购于美国Thermo Fisher公司;肝素钠抗凝管购于广州阳普医疗科技股份有限公司;96孔微孔板购于深圳市金灿华实业有限公司;编号87/586的IFN-γ生物参考标准品购于英国国家生物制品检定所;丙烯葡聚糖凝胶SephacryTMS-200购于通用电气医疗系统贸易发展(上海)有限公司;增强液、浓缩洗液和实验缓冲液由广州市丰华生物工程有限公司提供;其他试剂为国产分析纯;结核感染T细胞检测试剂盒(体外释放酶联免疫法)购于北京万泰生物药业股份有限公司。DHP-9052型恒温培养箱(上海一恒科学仪器有限公司),TDL-500C低速离心机(山东百欧医疗科技有限公司),DEM-Ⅲ型全自动酶标洗板和AutoTRFIA自动荧光免疫分析仪(广州市丰华生物工程有限公司),RT-2100C型酶标分析仪(深圳雷杜生命科学股份有限公司)。
1.3 方法
1.3.1 校准品的制备:以IFN-γ国际生物参考标准品为对照,将重组IFN-γ抗原用50 mmol/L,pH 7.80 Tris-HCl溶液(含50.0 g/L 牛血清清蛋白和0.5 g/L叠氮钠)配制成A~F的6个校准品溶液,其浓度分别为0,10,40,200,1 000,5 000 pg/ml。单位换算为1 IU/ml≈50 pg/ml。
1.3.2 固相抗体包被板的制备:将捕获IFN-γ单克隆抗体用10 mmol/L,pH 4.5磷酸盐缓冲液稀释至最适工作浓度作为包被液。将浓缩洗液用纯化水稀释25倍后作为洗涤工作液。含有10.0 g/L牛血清清蛋白的50 mmol/L,pH 7.8磷酸盐缓冲液作为封闭液。在96孔微孔板各孔中加入150 μl包被液,2~8 ℃过夜孵育22±2 h,弃去包被液。用洗涤工作液洗涤1次,然后每孔加入250 μl封闭液,37±1 ℃恒温培养箱中孵育3 h,弃去封闭液,真空抽干过塑冷藏。
1.3.3 铕标记物的制备:将1 mg的链霉亲和素加入截留分子量为10 000的超滤离心管中,10 000 r/min离心9~10 min。再用50 mmol/L,pH 9.6的碳酸盐缓冲液重复离心洗涤3~5次。将处理好的1 mg链霉亲和素加入含有1 mg N-(P-异硫氰基苄基)-二乙三胺四乙酸铕钠冻干粉小瓶中,2~8 ℃避光缓慢振荡孵育72±2 h,标记反应液用50 mmol/L,pH 7.8 Tris-HCl缓冲液平衡的SephacryTMS-200柱(0.5 cm×30 cm)层析,A280nm监测收集第一洗脱峰。
1.3.4 生物素标记抗体的制备:将生物素标记IFN-γ单克隆抗体用50 mmol/L,pH 7.80 Tris-HCl溶液(含50.0 g/L 牛血清清蛋白和0.5 g/L叠氮钠)稀释成工作浓度。
1.3.5 培养管的制备:配制含有50 g/L 牛血清清蛋白的50 mmol/L,pH 7.4磷酸盐缓冲液作为刺激物稀释液。在无内毒素离心管中直接加入10 μl刺激物稀释液,作为空白对照管N。将ESAT6和CFP-10在同一容器中分别用刺激物稀释液稀释成3 mg/L,然后取10 μl加入无内毒素离心管中,作为测试管T。将植物血凝素L用刺激物稀释液稀释成5 mg/L,然后取10 μl加入无内毒素离心管中,作为阳性对照管P。
1.3.6 IFN-γ体外释放:按空白对照管N,测试管T和阳性对照管P的顺序,在3种培养管中分别加入1 ml全血样本(肝素钠抗凝),立刻颠倒混匀6次以上,使内容物与血液充分混匀。将以上加有全血的3种培养管放入恒温培养箱(37±1 ℃)中培养16~24 h。培养结束后,将培养管以3 000~5 000 r/min的转速离心10 min,取各培养管中的血浆以待检测IFN-γ浓度。
1.3.7 IFN-γ定量检测:将浓缩洗液用纯化水在干净的容器中按体积比1∶25倍稀释,作为洗涤工作液加入洗板机中备用。吸取100 μl的校准品或待测样本依次加入固相抗体包被板的微孔中,在室温下缓慢振荡孵育45 min。用洗板机洗涤5次,拍干。再向每孔中加入100 μl生物素标记抗体工作液,在室温下缓慢振荡孵育45 min。用洗板机洗涤5次,拍干。向每孔中加入100 μl标记物工作液,在室温下缓慢振荡孵育15 min。用洗板机洗涤6次,拍干。向每孔中加入增强液100 μl,于室温下缓慢振荡5 min后在TRFIA仪上检测荧光计数值(counts per second,CPs),30 min内完成检测,并用配套的软件进行结果分析。
1.3.8 参比方法操作:结核感染T细胞检测试剂盒 (体外释放酶联免疫法)作为参比试剂。严格按试剂和仪器说明书操作检测。
1.3.9 判断标准:检测样本时,自建TRFIA和体外释放酶联免疫法(enzyme-linked immunosorbent assay ,ELISA)均按SN/T 3312-2012行业标准[5]中的结果判定与报告方法,对结果进行判读。
1.3.10 方法评价:按参考文献[6,7]方法对自建TRFIA的剂量-反应曲线、精密度、检测低限、生物检测限、功能灵敏度、线性、准确度、特异度等进行评价,并与ELISA进行方法学比对。

2 结果
2.1 抗体和标记物使用浓度或稀释度 经方阵(棋盘)滴定法,当捕获抗体浓度为5.0 μg/ml,生物素标记抗体工作稀释度为1∶1 800和铕标记物工作稀释度为1∶500时,本底良好(<1 300 CPs),校准品B~F的CPs分别与校准品A的CPs比值均趋于最大,因此捕获抗体使用浓度为5.0 μg/ml,生物素标记抗体使用工作稀释度为1∶1 800和铕标记物使用工作稀释度为1∶500。
2.2 剂量-反应曲线 见图1。自建TRFIA采用双对数(Log_LogB)数学模型及三次样条插值(spline)拟合分析,剂量-反应曲线的线性相关系数(correlation coefficient,r)可达0.990 0以上。

图1 TRFIA检测IFN-γ的剂量-反应曲线
2.3 精密度 自建TRFIA实验内测定16,112,325 pg/ml的IFN-γ国际生物参考标准品各20次,其结果分别为16.64±0.74,118.12±2.97和337.14±12.19 pg/ml,实验内变异系数(coefficient of variation,CV)分别为4.45%,2.51%和3.62%。实验间测定20次,其结果分别为16.60±0.95,110.28±4.86和307.50±26.49 pg/ml,其实验间CV分别为5.72%,4.41%和8.61%。

2.5 生物检测限 检测限样品0.45,0.90,1.80,3.60和7.20 pg/ml,采用自建TRFIA天间检测20次,在0.90 pg/ml IFN-γ组99.7%的可能性出现的最低荧光值为(1 365-3×296)CPs,即477 CPs,已大于空白荧光值平均值可能有的最高值(132×3)CPs,即396 Cps,说明0.90 pg/ml的样品CPs值有99.7%的可能性,一定大于空白的CPs值,能定量地报告结果。0.90 pg/ml为自建TRFIA检测IFN-γ的生物检测限。
2.6 功能灵敏度 检测限样品0.45,0.90,1.80,3.60和7.20 pg/ml,采用自建TRFIA天间检测20次,在1.80 pg/ml IFN-γ组的荧光值为1 744±318 CPs,天间CV为18.23%,小于并接近20%。因此,自建TRFIA检测IFN-γ的功能灵敏度为1.80 pg/ml。
2.7 线性 自建TRFIA检测2,10,40,200,1 000和5 000 pg/ml的IFN-γ线性评价样品,实测浓度与理论浓度的线性回归方程为Y=0.9 938X+1.3 166,r=1。
2.8 准确度 自建TRFIA检测浓度为2,10,40,200,1 000和5 000 pg/ml的IFN-γ国际生物参考标准品,实测值与标示值的相对偏倚在-1.79%~4.60%内。
2.9 干扰试验 自建TRFIA检测添加以下干扰物的血浆样本与添加等体积生理盐水的对照样本,结果间偏倚在±10%范围内。干扰物质:肿瘤坏死因子-α,白细胞介素(interleukin,IL)-2,IL-4,IL-5,IL-6,IL-8,IL-10,IL-12,IL-13,IL-18,IL-21,IL-32,IFN-ω,IFN-α,胆红素,血红蛋白和三酰甘油,干扰限浓度分别达116 pg/ml,790 pg/ml,62 pg/ml,44 pg/ml,1 034 pg/ml,2 192 pg/ml,13 pg/ml,476 pg/ml,442 pg/ml,2 050 pg/ml,280 pg/ml,56.6 pg/ml,500 pg/ml,3 600 pg/ml,818 μmol/L,180 g/L和21.54 mmol/L。
2.10 方法学比对试验 检测297例临床样本,以临床诊断为金标准,自建TRFIA在结核病组的灵敏度可达85.71%,在非结核病组人群中的特异度可达84.43%,一致率可达85.19%。自建TRFIA与ELISA检测临床样本阳性符合率达100%,阴性符合率达99.22%,总符合率为99.66%,κ为0.9 931,具有高度一致(κ>0.75)。自建TRFIA与ELISA的阳性检出率结果差异无统计学意义(χ2=0,P>0.05)。1例自建TRFIA检测阳性而ELISA检测阴性的标本为住院结核分枝杆菌阴性肺结核组患者样本。见表1。
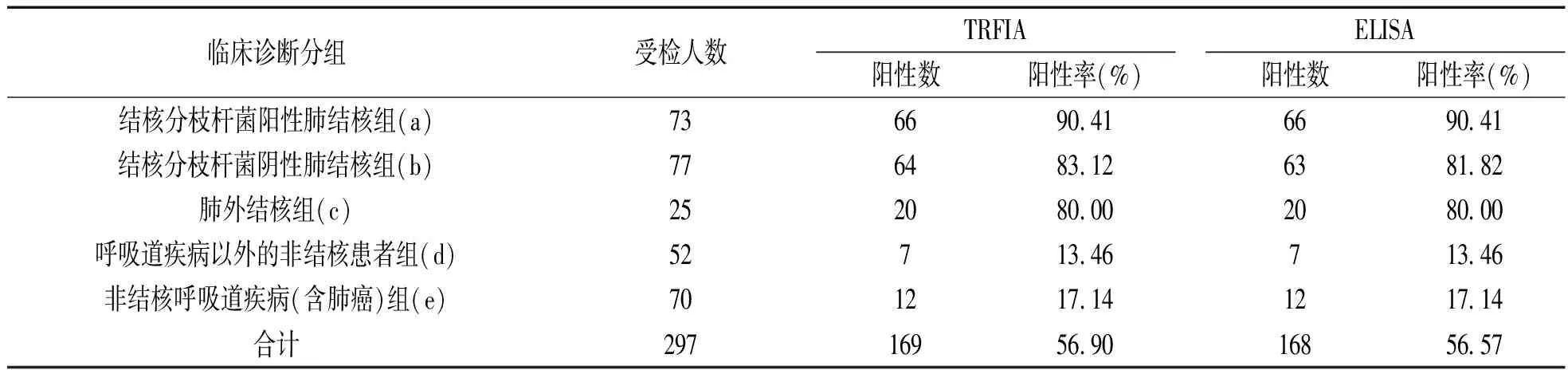
表1 TRFIA与ELISA的检测结果比较
注:临床诊断分组中,TRFIA与ELISA的阳性检出率差异均无统计学意义(P>0.05)。临床诊断分组间,TRFIA的阳性检出率:a与b,a与c,b与c,d与e间差异均无统计学意义(χ2=1.725,1.034,0.003,0.308,均P>0.05);a与d,a与e,b与d,b与e,c与d,c与e之间差异均有统计学意义(χ2=74.015,77.371,60.856,63.912,32.828和32.582,P<0.05);ELISA的阳性检出率:a与b,a与c,b与c,d与e之间差异均无统计学意义(χ2=2.298,1.034,0.009和0.308,均P>0.05);a与d,a与e,b与d,b与e,c与d,c与e间差异均有统计学意义(χ2=74.015,77.371,58.438,61.375,32.828和32.582,均P<0.05)。
3 讨论
目前诊断结核病的常见方法有镜检法、菌培养法、结核菌素试验、血清学检测方法和影像学检查等。镜检法的阳性率低,培养法试验周期长,不能满足临床的要求[8,9]。结核菌素试验是目前广泛应用且可以辅助诊断潜伏性结核菌感染的方法,然而,有些感染者对结核菌素是无反应的。此外,接种卡介苗,感染非致病性分枝杆菌,以及其他因素,会导致非结核分枝杆菌感染者结核菌素试验阳性。血清学检测方法中的抗体免疫反应的延迟性导致早期结核病诊断结果易产生假阴性,同时共同抗原导致的交叉反应以及不能区分非结核分枝杆菌都会导致假阳性患者接受不必要的治疗,耽误了真正治疗时机[9],世界卫生组织也发出正式声明,要求禁止将血清学检测方法用于肺结核和肺外结核的诊断[10]。影像学检查仅对活动性肺结核诊断具有参考价值,对肺外结核诊断存在困难。因此,寻找一种敏感度高、特异度高、快速、简便的结核诊断方法成为人们研究的焦点[8]。
TB-IGRAs是通过结核分枝杆菌特异抗原所引发的免疫应答反应来实现的,使用ESAT6和CFP-10作为特异性刺激抗原,所有的卡介苗菌株及绝大部分的非结核分枝杆菌(堪萨斯分枝杆菌,苏尔加分枝杆菌,海氏分枝杆菌除外)不含有这2种蛋白质。感染结核分枝杆菌复合群患者的血液中通常含有能够识别这2种蛋白质和其它分枝杆菌抗原的淋巴细胞,这一识别过程伴随着IFN-γ的合成和分泌。定量检测和分析免疫应答反应产生的IFN-γ的浓度,可以判断受试者是否具有针对结核分枝杆菌特异的T细胞免疫反应。2018年实施的《中华人民共和国卫生行业标准—肺结核诊断》中在免疫学检查中增加了IGRAs[11],肯定了IGRAs的临床价值。
目前市面上的TB-IGRAs试剂盒有两大类,一种为酶联免疫斑点法,另一种为体外释放ELISA。酶联免疫斑点法作为集细胞生物学和免疫学检测技术为一体的新型检测技术,对实验条件、操作技术和质量控制要求很高,其实验体系中的外周血单个核细胞分离、加入活体细胞数量、细胞孵育条件、结果判定等全程质量控制,是决定实验成败的关键所在[12]。体外释放ELISA操作相对简便,但采用酶作为检测示踪物,灵敏度较低,线性范围较窄。本研究基于TRFIA建立的TB-IGRAs,采用全血培养,无需分离外周血单个核细胞,操作相对简便,自动化程度高,检测精密度良好,灵敏度高,优于ELISA参比试剂(分析灵敏度为2 pg/ml);线性范围宽,上限明显高于ELISA参比试剂(检测上限为400 pg/ml),有利于高值样本的准确检测,准确度高,特异度强,自建TRFIA检测临床样本与ELISA参比试剂在临床试验中具有等效性,自建TRFIA可以满足临床需要。
