培美曲塞联合铂类与其它铂二联方案治疗晚期肺腺癌临床疗效比较
2018-12-11王又君薛晶雯吕喜英
郭 静,王又君,薛晶雯,吕喜英
(承德医学院附属医院肿瘤科,河北承德 067000)
2018年2月国家癌症中心统计数据显示,肺癌位居全国癌症发病首位[1]。根据病理组织学,肺癌可分为小细胞肺癌(SCLC)和非小细胞肺癌(NSCLC),其中80%为NSCLC,包括鳞癌、腺癌和大细胞癌。肺腺癌作为NSCLC的一种,约占原发性肺癌的25%左右,且发病率有不断增长趋势。靶向治疗为肺腺癌驱动基因阳性的精准治疗奠定了基础,但临床上非驱动基因阳性(包括基因突变阴性或基因状态未明)的患者仍以化疗为主,如何选择化疗方案为目前临床医师急需解决的问题。本研究对初治非驱动基因阳性的晚期肺腺癌患者分别应用以PC(培美曲塞+顺铂)为主和以TP(紫杉醇+顺铂)/DP(多西他赛+顺铂)/GP(吉西他滨+顺铂)为主的化疗方案进行治疗,比较两组患者的临床疗效和安全性,以期为非驱动基因阳性的晚期肺腺癌患者提供更安全有效的治疗策略。
1 资料与方法
1.1 一般资料 2013年10月-2017年7月承德医学院附属医院肿瘤科收治的120例确诊为晚期肺腺癌的初治患者,根据化疗方案将患者分为实验组和对照组。两组患者基本资料比较差异无统计学意义(P>0.05),具有可比性。见表1:
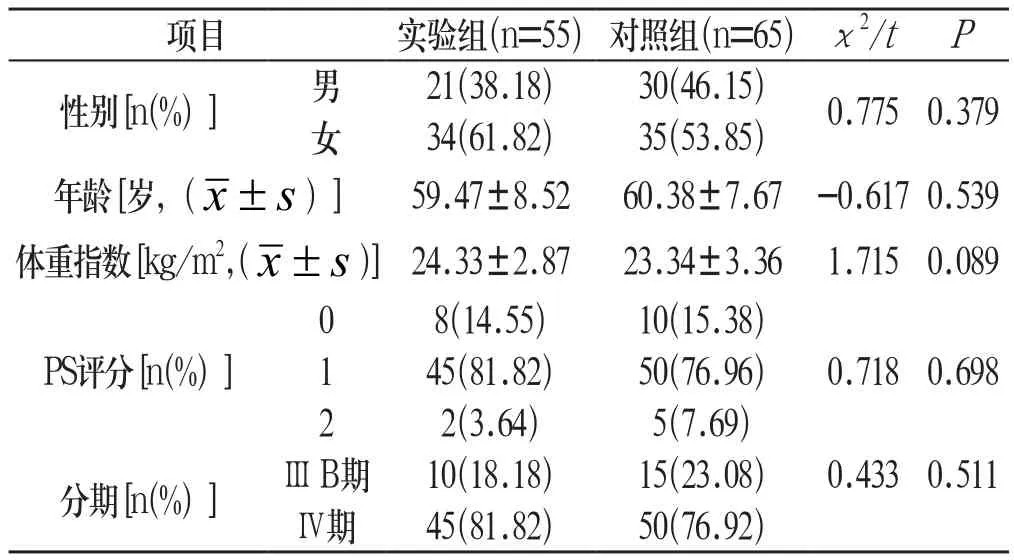
表1 两组患者基线资料比较
1.2 纳入和排除标准 ⑴纳入标准:经组织病理学确诊为肺腺癌,且根据AJCC(美国癌症联合委员会)分期为ⅢB期及Ⅳ期的初治患者;所有患者中97例EGFR(表皮生长因子受体)/ALK(间变性淋巴瘤激酶)基因检测为阴性,23例基因状态未明;影像学上具有可测量的肿瘤病灶;患者体力状况评分(ECOG评分)≤2分,且卡氏评分(KPS评分)>70分;患者预计生存期>3个月。⑵排除标准:其它部位有恶性肿瘤;存在化疗禁忌症及脏器功能不全。
1.3 治疗方法
1.3.1 实验组:采用PC(培美曲塞+顺铂)方案。患者于化疗第1天静脉滴注培美曲塞(江苏豪森药业,H20051288),剂量为500mg/m2;顺铂(江苏豪森药业,H20040812),总剂量为75mg/m2,分别在化疗的第1~3天平均分配静脉滴注。21天为1个治疗周期,共治疗4个周期。
1.3.2 对照组:采用TP(紫杉醇+顺铂)/DP(多西他赛+顺铂)/GP(吉西他滨+顺铂)方案。患者分别于化疗第1天静脉滴注紫杉醇(南京绿叶思科药业,H20030357)175mg/m2,或第1天静脉滴注多西他赛(恒瑞医药,H20020534)75mg/m2,或于化疗的第1、8天静脉滴注吉西他滨(江苏豪森药业,H20030105)1000mg/m2;以上三种药物均联合顺铂(江苏豪森药业,H20040812),总剂量为75mg/m2,平均在化疗的第1~3天静脉滴注。21天为1个治疗周期,共治疗4个周期。
1.4 观察指标 ⑴化疗4个周期后比较两组患者的总缓解率(ORR)、疾病控制率(DCR)、无进展生存期(PFS)、总生存期(OS)、1年生存率及2年生存率。根据RECIST 1.1评价标准[2],将疗效分为完全缓解(CR)、部分缓解(PR)、稳定(SD)和疾病进展(PD)。ORR=(CR+PR)/总例数×100%;DCR=(CR+PR+SD)/总例数×100%;1年生存率=1年后存活人数/总人数×100%;2年生存率=2年后存活人数/总人数×100%。⑵根据世界卫生组织(WHO)药物毒性分级标准评价不良反应。⑶总生存期定义为从随机分组开始至任何原因致患者死亡时间;无进展生存期定义为从随机分组开始至患者疾病进展时间。
1.5 统计分析 临床所得数据用SPSS 20.0软件进行统计分析,计量资料用均数±标准差(±s)表示,进行t检验;计数资料用频数和百分位数(%)表示,进行卡方检验。以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者疗效分析 实验组CR、RP、SD、PD分别为0例、24例、19例、12例,对照组分别为0例、17例、22例、26例。实验组ORR和DCR均显著高于对照组,差异有统计学意义(P<0.05);两组患者PFS、2年生存率比较,差异无统计学意义(P>0.05);实验组OS显著长于对照组、1年生存率显著高于对照组,差异有统计学意义(P<0.05)。见表2:

表2 两组患者治疗4个周期后临床疗效分析
2.2 化疗后两组患者不良反应发生情况 实验组患者血小板减少、白细胞减少、贫血等血液学毒性的发生率均明显低于对照组,差异具有统计学意义(P<0.05);非血液学毒性方面,两组患者恶心呕吐、肝肾功能异常的发生率比较差异无统计学意义(P>0.05)。见表3:
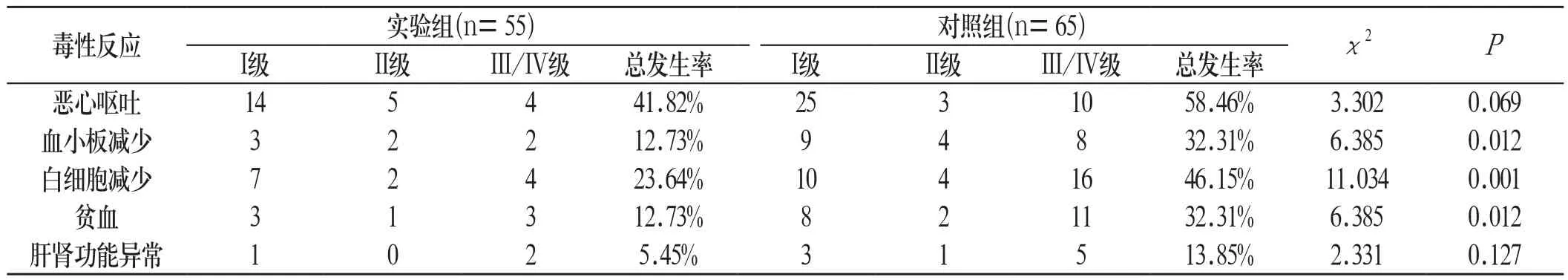
表3 用药4个周期后两组患者不良反应情况比较
3 讨论
肺癌在我国发病率和死亡率均居于首位,肺癌早期患者临床症状并不典型,因此将近75%的肺癌患者就诊时已处于晚期,无法进行根治性手术治疗。
虽然ECOG 1594试验[3]为ⅢB期及Ⅳ期NSCLC的治疗提供了较好的理论依据,但中位生存时间(MST)为7.9个月、1年生存率为33%、2年生存率为11%,结果不太理想。靶向药物的出现为肺腺癌的精准治疗带来了希望。相关临床研究证实[4-5],驱动基因阳性的晚期肺腺癌患者在治疗方法上首选靶向药物目前已达成共识,但对于非驱动基因阳性的晚期肺腺癌患者,仍以铂二联为主的化疗方案为首选治疗方法。JMDB的研究[6]结果显示,对于晚期肺腺癌患者,培美曲塞组疗效明显优于吉西他滨组(OS 12.6个月 vs 10.9个月),且不良反应发生率更低,因此培美曲塞被FAD批准用于晚期NSCLC的一线治疗。本研究对120例ⅢB期或Ⅳ期非驱动基因阳性晚期肺腺癌患者,分别应用培美曲塞联合顺铂与紫杉醇/多西他赛/吉西他滨联合顺铂化疗进行比较,发现实验组ORR、DCR、OS、1年生存率均显著优于对照组,虽然两组患者PFS、2年生存率比较差异无统计学意义,但本研究结果仍能提示采用PC方案治疗的实验组临床疗效显著优于对照组,与上述临床研究结果相似。因此,对于驱动基因不明或阴性的晚期肺腺癌患者的一线化疗方案,可首选培美曲塞联合顺铂方案。
Hanna等[7]进行的JMEI研究显示,培美曲塞组患者的严重不良反应发生率明显低于多西他赛组,基于此,培美曲塞被FAD批准用于NSCLC的二线治疗。Ciuleanu等[8]进行的JMEN亚组分析研究结果显示,对于非鳞癌患者,培美曲塞组患者PFS及OS明显长于安慰剂组,且安全性和耐受性良好;为此,培美曲塞被FAD批准用于局部晚期或转移的NSCLC患者一线4周期化疗后的维持治疗。本研究观察两种治疗方案不良反应时发现,两组患者主要不良反应包括血液学毒性和非血液学毒性反应。虽然两组非血液学毒性反应差异无统计学意义,但实验组血液学毒性反应,血小板减少、白细胞减少及贫血的发生率明显低于对照组。因此,本研究亦证实了对于驱动基因不明或阴性的晚期肺腺癌患者的一线化疗方案,首选培美曲塞联合顺铂方案的安全性。
综上所述,对于初治的非驱动基因阳性的晚期肺腺癌患者应用PC方案化疗较应用TP/DP/GP方案化疗临床疗效显著,且毒性反应发生率低,值得临床上推广与应用。
