鬼臼苦素对人结直肠癌HCT-15细胞增殖的影响
2018-12-11周丽丽刘赛璇刘莎莎王瑞婷申兴斌
周丽丽,刘赛璇,赵 杨,刘莎莎,王瑞婷,申兴斌△
(1.承德医学院附属医院病理科,河北承德 067000;2.承德医学院)
结直肠癌是常见的消化系统恶性肿瘤,发病率和病死率均位居全部恶性肿瘤的第5位,严重威胁人类的健康。目前,结直肠癌的治疗仍以手术和放化疗为主,但传统放化疗药物缺乏特异性,在杀伤恶性肿瘤细胞的同时也可以杀伤正常组织细胞,后期可因毒副作用大严重影响患者的生活质量。因此,对于结直肠癌的治疗仍需要寻找新的行之有效的方法,寻求治疗结直肠癌的相关靶向位点及药物一直是国内外研究的热点问题。胰岛素样生长因子-Ⅰ受体(insulin-like growth factor-Ⅰ receptor,IGF-ⅠR)可通过调节肿瘤细胞的生长、增殖和代谢,参与肿瘤的进程,已成为目前肿瘤治疗的新靶点[1],进而探寻安全、低毒、高效的IGF-ⅠR抑制剂引起了众多研究者的关注。近年来研究发现,鬼臼苦素是一种特异性的IGF-ⅠR酪氨酸激酶抑制剂,能有效阻断IGF-ⅠR介导的细胞内信号传导,从而抑制肿瘤细胞生长并促进肿瘤细胞凋亡,而正常细胞的生长不受影响[2]。有研究已证实[3-5],鬼臼苦素在多发性骨髓瘤、葡萄膜黑色素瘤和胶质母细胞瘤中显示出具有抗肿瘤活性,但国内尚未见有关鬼臼苦素对结直肠癌作用的研究报道。为此,本研究观察了鬼臼苦素对人结直肠癌HCT-15细胞增殖的影响,以期为结直肠癌的临床治疗提供基础依据。
1 材料与方法
1.1 材料
1.1.1 主要试剂和细胞:人结直肠癌HCT-15细胞株,购自南京科佰生物科技有限公司。RPMI 1640及胰酶,购自美国Gibco公司;无支原体胎牛血清,购自杭州四季青生物工程材料有限公司;PBS,购自北京索莱宝科技有限公司;鬼臼苦素(picropodophyllin,PPP),购自上海皓元生物医药科技有限公司;CCK-8,购自日本同仁化学研究所。
1.1.2 主要仪器:二氧化碳培养箱(美国Thermo公司),超净工作台(上海新苗医疗器械制造有限公司),倒置相差显微镜(德国Leica公司),全自动酶标仪ELX808(美国伯腾仪器有限公司)。
1.2 方法
1.2.1 细胞培养:将HCT-15细胞接种于含有10%胎牛血清的RPMI 1640培养基中,放置于37℃、5% CO2培养箱中培养,每2~3天传代一次,取对数生长期细胞用于实验。
1.2.2 CCK-8法检测鬼臼苦素对HCT-15细胞的抑制率:收集对数生长期HCT-15细胞,调整细胞密度为4×104/ml,均匀接种于96孔板,每孔100μl。培养箱中培养24h,弃掉原培养基,更换为含有鬼臼苦素浓度分别为0.125μmol/L、0.25μmol/L、0.5μmol/L、1μmol/L、2μmol/L、4μmol/L的RPMI 1640培养基,每孔200μl,同时设对照组(不加药物)和空白组(只加RPMI 1640培养基),每组各设6个复孔。各组细胞分别培养24h、48h、72h后每孔加入10μ l CCK-8,置于培养箱中继续培养4h,在450nm波长处用酶标仪检测各孔的吸光度值(OD值),实验重复3次,计算不同药物浓度对肿瘤细胞的生长抑制率。抑制率(%)=(对照组OD值-实验组OD值)/(对照组OD值-空白组OD值)×100%,并计算IC50。
1.2.3 HCT-15细胞形态结构的观察:收集对数生长期HCT-15细胞,按每孔2×105个细胞接种于6孔板,放置于培养箱中培养。待细胞生长汇合约60%时,按1.2.2分别更换含不同浓度鬼臼苦素的RPMI 1640培养基,对照组不含药物。鬼臼苦素作用48h后,在倒置显微镜下观察各组HCT-15细胞形态结构的变化。
1.3 统计分析 应用SPSS 19.0软件进行统计学分析。所有数据均用均数±标准差(±s)表示,统计分析采用析因方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 HCT-15细胞的抑制率 与对照组相比,不同浓度鬼臼苦素作用于HCT-15细胞24h、48h、72h,HCT-15细胞的抑制率均明显升高(P<0.01,表1)。鬼臼苦素浓度在0.125μmol/L~2μmol/L范围内,随着鬼臼苦素浓度的增加和作用时间的延长,HCT-15细胞的抑制率逐渐增加,且呈剂量-时间依赖性;鬼臼苦素的浓度和作用时间之间有显著的交互作用(见表2,图1)。
鬼臼苦素作用HCT-15细胞24h、48h、72h的IC50值分别为13.087μmol/L、0.377μmol/L、0.183μmol/L。
表1 不同浓度鬼臼苦素作用不同时间HCT-15细胞的抑制率(±s,%)

表1 不同浓度鬼臼苦素作用不同时间HCT-15细胞的抑制率(±s,%)
与对照组比较:aP<0.01
培养时间24h 48h 72h对照组 0 0.00±0.00 0.00±0.00 0.00±0.00组别 鬼臼苦素浓度(μmol/L)实验组0.125 3.65±0.39a 31.85±1.46a 41.53±0.44a 0.25 4.91±0.46a 43.07±2.42a 56.49±0.65a 0.5 6.35±1.07a 50.79±1.93a 74.34±0.42a 1 9.51±1.48a 64.38±0.83a 88.73±0.83a 2 17.92±0.85a 82.63±1.19a 93.92±1.92a 4 22.52±1.72a 86.04±1.24a 96.22±0.48a
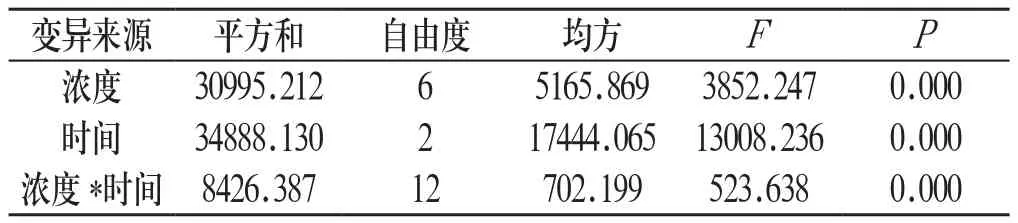
表2 鬼臼苦素对HCT-15细胞浓度和时间主体间效应的检验

图1 不同浓度鬼臼苦素作用不同时间对HCT-15细胞的抑制率
2.2 HCT-15细胞形态结构的变化 倒置显微镜下观察,对照组HCT-15细胞贴壁良好呈岛屿状生长,细胞之间连接紧密,透明度大、折光性好。鬼臼苦素作用于H C T-15细胞后,细胞失去原有状态,大小不一、皱缩甚或碎裂,细胞脱离培养皿底部呈悬浮状,折光性差,细胞间距变大,岛屿状贴壁生长的细胞数目减少;并且鬼臼苦素浓度越大、作用时间越长,上述表现越明显(图2)。
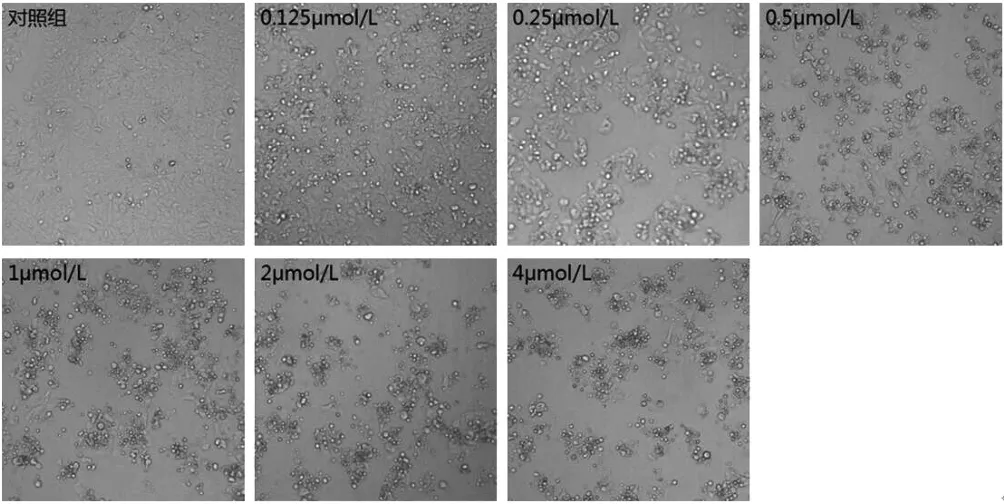
图2 不同浓度鬼臼苦素作用48h后对HCT-15细胞形态的影响(×100)
3 讨论
IGF-ⅠR是由两个α亚基和两个β亚基组成的酪氨酸激酶受体,两个亚基由二硫键连接,α亚基位于细胞外,β亚基在受体被激活后将信号转导到胞内。当配体,主要是IGF-Ⅰ和IGF-Ⅱ与IGF-ⅠR的α亚基结合时,膜结合的β亚基胞内部分酪氨酸残基自动磷酸化[6];随后,激活磷脂酰肌醇3-激酶(PI3K/AKT)和丝裂原活化蛋白激酶(MAPK)通路,从而介导细胞的增殖、存活和分化[7]。本课题组前期研究发现[8],结直肠癌组织IGF-ⅠR蛋白的表达明显高于腺瘤及正常结直肠黏膜,提示IGF-ⅠR可能与结直肠癌的发生发展过程有关。因此,干扰IGF-ⅠR介导的信号通路可能是治疗结直肠癌的另外一种选择。
鬼臼毒素是鬼臼类植物中木脂素类化合物的代表,最早发现于美洲鬼臼(足叶草)。20世纪40年代证实鬼臼毒素具有抗癌活性,但由于毒副作用大,限制了鬼臼毒素在临床的直接应用[9]。多年以来,为得到更加高效、低毒的鬼臼毒素类抗癌药物,研究者们一直致力于对鬼臼毒素的结构进行改造和修饰。鬼臼苦素是鬼臼毒素的同分异构体,具有顺式内酯环,对微管蛋白没有抑制作用,故不具有细胞毒性。在一项国外进行的临床一期研究试验中,非小细胞肺癌患者采用鬼臼苦素治疗7个月,能延缓癌症患者的疾病进展,并且非小细胞肺癌患者也对鬼臼苦素显示出较好的耐受性[10]。此外,Vasilcanu等[11]也发现,恶性肿瘤细胞对鬼臼苦素几乎不产生耐药性,而且鬼臼苦素还能增强肿瘤细胞对传统化疗药物的敏感性。但鬼臼苦素对结直肠癌是否同样有效有待证实。
本研究发现,鬼臼苦素可明显抑制人结直肠癌HCT-15细胞的增殖生长,在0.125μmol/L~2μmol/L浓度范围呈剂量-时间依赖性。鬼臼苦素浓度为2μmol/L作用48h、72h时,HCT-15细胞的抑制率可高达82.63%、93.92%,具有显著的抑制效果。倒置显微镜下也观察到鬼臼苦素作用48h后细胞形态发生明显变化,浓度越大细胞形态变化越明显。但鬼臼苦素对人结直肠癌HCT-15细胞发挥这一抑制作用的具体机制尚不清楚,仍需进行后续实验以深入研究。
