褐藻多糖硫酸酯对慢性肾脏病患者动脉粥样硬化的影响
2018-12-11李海涛周长菊赵彩霞危志强
印 荻,李海涛,章 旭,周长菊,丁 浩,赵彩霞,危志强,曹 娟
(江苏省泰兴市人民医院,江苏 泰兴 225400)
动脉粥样硬化(AS)既是慢性肾脏病(CKD)患者最常见的并发症,又是CKD患者的主要致死原因[1]。动脉粥样硬化是多因素共同作用引起的,发病机制复杂,至今未完全阐明,其中氧化应激、微炎症状态等在CKD相关动脉粥样硬化的发病和防治中的作用越来越受到重视[2-3]。目前针对CKD患者抑制氧化应激及微炎症状态还处于探索阶段,尚无理想的方法及药物,中医药可能在此领域有较好应用前景。本研究观察了褐藻多糖硫酸酯(FPS)对中晚期非透析CKD患者晚期氧化蛋白产物(AOPP)表达及动脉粥样硬化情况的影响,旨在探讨更有效的治疗方案。
1 临床资料
1.1一般资料 选择2013年12月—2015年11月在我院肾内科就诊的CKD 3~5期非透析患者80例作为CKD 组,排除1个月内发生急性心血管事件者,合并感染、新发生心律失常、心力衰竭、脑血管意外、外周血栓栓塞性疾病、恶性肿瘤、自身免疫系统疾病者,妊娠者,预计1年内会进入透析者。其中男43例,女37例;年龄24~73岁,中位年龄53.6岁;原发病:慢性肾小球肾炎38例,高血压肾病16例,糖尿病肾病15例,多囊肾7例,痛风性肾病2例,梗阻性肾病1例,原因不明1例;CKD3期35例,CKD4期29例,CKD5期16例。将80例CKD 患者按随机编号法分为2组:FPS组40例,男21例,女19例;年龄30~73岁,中位年龄55.4岁;伴糖尿病6例。常规组40例,男22例,女18例;年龄24~70岁,中位年龄52.9岁;伴糖尿病9例。另选择同期参加本院体检的健康志愿者40例作为健康组,男24例,女16例;年龄30~70岁,中位年龄50.3岁;尿常规及肝肾功能正常,排除其他伴随疾病。
1.2治疗方法 FPS组和常规组均予以低盐低磷低脂优质低蛋白饮食,并常规予以降压、控制血糖、纠正水电解质及酸碱失衡、纠正贫血等治疗;FPS组在此基础上口服海昆肾喜胶囊(主要成分为FPS,吉林辉南长龙生化药业股份有限公司生产,国药准字Z20030052),每次2粒,每天3次,共治疗12个月。
1.3观察项目 3组入组后及FPS组、常规组治疗12个月后取血测定血红蛋白(Hb)、尿素氮(BUN)、血肌酐(SCr)、血浆白蛋白(ALB)、AOPP(采用分光光度计法检测,试剂盒购于美国CELL BIOABS公司,型号OxiSelect)、超敏C反应蛋白(hs-CRP)水平,使用彩色多普勒超声诊断仪(百胜TechnosMPX DU6,探头频率为10 MHz,由专人操作)在离颈动脉分叉2 cm处测量颈动脉内膜厚度(IMT),采用日本COLIN公司VP1000全自动动脉硬化检测仪测定肱动脉-踝动脉脉搏波传导速度(PWV),比较CKD组与健康组、不同CKD分期患者及是否伴糖尿病患者AOPP、IMT、PWV的差异,观察FPS组和常规组治疗前后上述检测指标的变化和治疗过程中不良反应发生情况。
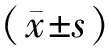
2 结 果
2.1CKD组与健康组AOPP、IMT、PWV水平比较CKD组AOPP水平及IMT、PWV均显著高于健康组(P均<0.05)。见表1。
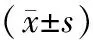
表1 CKD组与健康组AOPP、IMT、PWV水平比较
注:①与健康组比较,P<0.05。
2.2不同CKD分期患者AOPP、IMT、PWV水平比较 随着CKD分期增加,AOPP水平及IMT、PWV呈上升趋势(P均<0.05)。见表2。
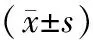
表2 不同CKD分期患者AOPP、IMT、PWV水平比较
注:①与CKD 3期比较,P<0.05;②与CKD 4期比较,P<0.05。
2.3糖尿病及非糖尿病CKD患者AOPP、IMT、PWV水平比较 糖尿病CKD患者AOPP水平及IMT、PWV均显著高于非糖尿病CKD患者(P均<0.05)。见表3。
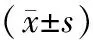
表3 糖尿病及非糖尿病CKD患者AOPP、IMT、PWV水平比较
注:①与非糖尿病CKD患者比较,P<0.05。
2.4FPS组和常规组治疗前后实验室各检测指标比较 治疗前FPS组和常规组各项指标比较差异均无统计学意义(P均>0.05)。治疗12个月后,2组患者AOPP、hs-CRP水平及PWV均明显高于治疗前(P均<0.05),但FPS组均明显低于常规组(P均<0.05);2组患者IMT及BUN、SCr水平与治疗前比较差异均无统计学意义(P均>0.05),但FPS组IMT及BUN、SCr水平均显著低于常规组(P均<0.05);2组患者治疗前后Hb、ALB水平比较差异均无统计学意义(P均>0.05)。见表4。
2.5FPS组和常规组不良反应发生情况比较 FPS组发生恶心呕吐2例,腹泻1例;常规组发生恶心呕吐1例。2组不良反应发生情况比较差异无统计学意义(P>0.05)。
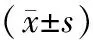
表4 FPS组和常规组治疗前后实验室各检测指标比较
注:①与治疗前比较,P<0.05;②与常规组比较,P<0.05。
3 讨 论
CKD尤其是终末期患者动脉粥样硬化的发生率比同龄一般人群高10~15倍,发病年龄提前至30~40岁,被称之为“加速性动脉粥样硬化”[4]。终末期CKD患者动脉粥样硬化加速发生的原因尚未阐明,多数学者认为与终末期CKD患者普遍存在高血压、高血脂症等传统危险因素和一些尿毒症所特有的危险因素有关,后者包括氧化应激、微炎症和羰基应激等备受关注的病理生理征象[5-7]。
氧化应激学说是动脉粥样硬化斑块形成学说中的重要组成部分[8],氧化应激时引起内皮细胞损伤和功能障碍,刺激平滑肌细胞增殖、单核巨噬细胞活化,导致部分炎症因子高表达,促进动脉粥样硬化的发生发展。AOPP是反映体内氧化应激的标志物[9],血液透析和未透析的CKD患者均存在高AOPP血症,且AOPP潴留随肾功能恶化而加重,终末期CKD患者循环中AOPP水平较正常人高2倍[10-11]。另外糖尿病患者血浆AOPP水平明显高于正常人,且肾功能受损者血浆AOPP水平比未出现肾功能损伤者更高[12]。有研究显示,AOPP水平是影响60岁以下CKD患者颈动脉中层-内膜厚度和切面内膜中层面积的重要因素,高AOPP血症可能是影响CKD患者动脉粥样硬化发生或发展的独立危险因素[10]。本研究发现CKD3期患者已存在AOPP水平升高、颈动脉IMT增厚和PWV加快,随着CKD的进展,AOPP水平进一步升高,动脉粥样硬化逐渐加重,且糖尿病患者AOPP水平和IMT、PWV均显著高于非糖尿病患者,与既往研究一致。
FPS是一种水溶性杂聚糖,含有强极性的活性基团硫酸酯,是一种强吸附剂,可充分吸附体内的一些毒素物质,有效清除体内过多的氧自由基,具有体内抗氧化作用,同时能改善肾脏病理损伤,延缓肾间质纤维化及肾小球硬化,改善肾功能[13-14]。本研究结果显示,治疗12个月后,2组患者AOPP、hs-CRP水平及PWV均明显高于治疗前,但FPS组均明显低于常规组;2组患者IMT及BUN、SCr水平与治疗前比较差异均无统计学意义,但FPS组IMT及BUN、SCr水平均显著低于常规组;2组患者治疗前后Hb、ALB水平和治疗过程中不良反应发生情况比较差异均无统计学意义。提示FPS既可以保护中晚期CKD患者肾功能,又可抗氧化应激,抑制炎症反应,延缓动脉粥样硬化进展,且具有良好的安全性,推测FPS延缓动脉粥样硬化的进展并不是依赖于其延缓肾衰进展,可能与抗氧化应激、抑制炎症反应等有关,为其临床应用提供了一定依据。关于FPS应用剂量与效果的关系和长期服用的可行性、有效性还有待进一步、大样本量的研究。
