一个甘蔗Ⅱd类WRKY转录因子基因的克隆和表达分析
2018-12-11张旭凌辉刘峰黄宁王玲毛花英李聪娜汤翰臣苏炜华苏亚春阙友雄
张旭,凌辉,刘峰,黄宁,王玲,毛花英,李聪娜,汤翰臣,苏炜华,苏亚春,阙友雄
一个甘蔗Ⅱd类WRKY转录因子基因的克隆和表达分析
张旭,凌辉,刘峰,黄宁,王玲,毛花英,李聪娜,汤翰臣,苏炜华,苏亚春,阙友雄
(福建农林大学农业部福建甘蔗生物学与遗传育种重点实验室/福建农林大学教育部作物遗传育种与综合利用重点实验室,福州 350002)
【目的】WRKY是植物特有的一类转录因子,在生理调控和逆境响应过程中有着重要作用。通过分析WRKY转录因子基因在甘蔗生长发育及抗逆境过程中的作用,为甘蔗抗逆分子育种提供优良的基因资源。【方法】从甘蔗转录组数据库中挖掘到一条WRKY基因Unigene序列,并通过RT-PCR扩增得到cDNA全长序列,利用ORF finder、Smart、ExPaSy、Prabi、NetPhos、Cell-PLOC 2.0和DNAMAN6.0软件对该基因序列及其编码蛋白序列进行生物信息学分析,并使用MEGA6.0软件构建系统进化树;构建pCAMBIA1300--融合表达载体,通过农杆菌转化本氏烟(),确定WRKY蛋白在烟草叶片中的亚细胞定位;利用酵母杂交试验验证WRKY是否具有转录自激活活性;采用实时荧光定量PCR(qRT-PCR)方法分析在甘蔗品种ROC22中的组织特异性(根、蔗芽、叶、蔗髓和皮)及其在MeJA(100 μmol·L-1)、SA(5 mmol·L-1)、PEG(25%)、NaCl(250 mmol·L-1)、CuCl2(500 mmol·L-1)和CdCl2(500 mmol·L-1)胁迫条件下表达量的变化。【结果】从甘蔗品种ROC22中克隆获得一个WRKY转录因子基因,命名为(GenBank登录号为MH393927)。该基因序列全长1 289 bp,包含1个1 059 bp的ORF,编码352个氨基酸,并具有45个磷酸化位点;理论等电点为9.73,不稳定指数为50.23,亲水性为-0.579,推测其为碱性不稳定亲水性蛋白。ScWRKY6蛋白具有1个WRKY结构域和1个锌指结构域(CX5CX23HXH),该蛋白氨基酸序列与高粱()WRKY(XP_002464211.1)的同源性最高,根据系统进化树分析可以推测其属于WRKY家族Ⅱd亚类。亚细胞定位结果显示,ScWRKY6::GFP融合蛋白定位在细胞核上。酵母转录激活验证试验显示,ScWRKY6蛋白不具有转录自激活活性。qRT-PCR分析表明,在甘蔗中为组成型表达,其表达量由大到小依次为蔗芽、叶、根、皮和蔗髓,其中蔗芽、叶和根的表达量分别为蔗髓的2.05、1.55和1.37倍。在NaCl、PEG、MeJA、重金属Cu2+和Cd2+胁迫诱导下表达量均上调,其在NaCl处理12 h时表达量最高,为对照的4.18倍;在PEG处理3 h时表达量最高,为对照组的6.88倍;在CuCl2和CdCl2诱导24 h时表达量最高,分别为对照组的3.63倍和4.86倍。【结论】ScWRKY6蛋白定位在细胞核上,不具有转录自激活活性;该基因在甘蔗不同组织部位中均有表达,且受NaCl、PEG、CuCl2和CdCl2等胁迫的诱导,推测可能在甘蔗干旱应答、耐盐及金属离子胁迫响应中发挥作用。
甘蔗;WRKY转录因子;外源胁迫;实时荧光定量PCR
0 引言
【研究意义】甘蔗(spp.)是生物产量巨大的C4型糖料作物,中国92%的食糖来源于甘蔗[1]。中国甘蔗主要种植于旱坡地上,其中主产区广西有90%以上的甘蔗种植在丘陵旱地[2]。甘蔗属于中度耐盐作物,盐胁迫能够降低甘蔗的产量和品质,而在干旱和半干旱地区灌溉条件下生长的甘蔗经常受到盐分胁迫[3],因此,提高甘蔗对干旱及盐胁迫的耐受性,选育高产、优质、高抗的甘蔗品种迫在眉睫。甘蔗为异源多倍体作物,遗传基础复杂,给直接利用表型性状进行传统抗性遗传研究和品种选育造成诸多困难[4];然而,甘蔗是无性繁殖作物,在组织培养过程中品种的特性稳定,因此,利用基因工程手段培育甘蔗抗性品种应用前景巨大,其中优良抗逆基因资源的发掘是首要基础。WRKY是植物中最大的转录因子家族之一,其在植物生长发育、生物及非生物逆境响应等过程起重要作用[5]。因此,对甘蔗WRKY转录因子的克隆和表达分析研究具有十分重要意义。【前人研究进展】WRKY转录因子蛋白均含有1个或2个WRKY结构域,其大约由60个氨基酸残基构成,该结构域因N端具有7个保守的“WRKYGQK”基序而得名,C端则含有1个锌指结构(CX4-7CX22–23HXH/C)[6]。根据其结构域特征,WRKY转录因子可分为3大类:第Ⅰ类含有2个WRKY结构域,锌指结构为C2H2(CX4-5-C-X22- 23-H-X1-H);第Ⅱ类含有1个WRKY结构域,锌指结构为C2H2(CX4-5-C-X22-23-H-X1-H),同时该类又可分成Ⅱa、Ⅱb、Ⅱc、Ⅱd和Ⅱe共5个亚类;第Ⅲ类含有1个WRKY结构域,锌指结构为C2-HC(C-X7-C-X23-HX)[6]。研究表明,WRKY是通过其WRKY结构域与目标基因W-BOX顺式作用元件TTGACC/T结合[7],从而调控下游靶基因的表达,最终在植物响应逆境胁迫过程中发挥作用[8]。广泛参与植物生物及非生物胁迫防御反应、生长发育、次生代谢物调控等重要生理过程[9]。如水稻的过表达能调节相关防御基因的表达,从而增强水稻()对白叶枯病菌(pv.)的抗性和对干旱胁迫的耐受性[10];YANG等[11]研究表明核桃()和通过脱落酸(abscisic acid,ABA)信号传导途径提高植物对盐、渗透和热胁迫等的耐受性;拟南芥()能够延缓植株叶片衰老[12],同时还能通过赤霉素(gibberellin,GA)介导的信号传导途径正向调节拟南芥开花进程[13]。青蒿()参与青蒿素的合成途径[14]。自1994年Ishiguro等[15]在甘薯中发现了第一个WRKY转录因子——后,越来越多的WRKY转录因子在植物中被发现。目前,在水稻中有109个WRKY转录因子[16],拟南芥中有72个[17],玉米()中有136个[18],白杨()中有104个[19],谷子()中有105个[20]。【本研究切入点】由于甘蔗遗传背景复杂、基因组庞大,对于WRKY转录因子的研究较晚,报道较少,Lambais等[21]对甘蔗26个WRKY类蛋白序列进行表达谱分析,表明其参与各种防御调控途径;Liu等[22]克隆了属于Ⅱc亚类的甘蔗,其受甘蔗黑穗病菌()、水杨酸(salicylic acid,SA)、氯化钠(sodium chloride,NaCl)和聚乙二醇(polyethylene glycol,PEG)强烈诱导。然而,对于甘蔗Ⅱd亚类WRKY转录因子的克隆及其参与非生物胁迫响应的机制尚未见报道。【拟解决的关键问题】本研究通过克隆甘蔗WRKY基因,对其进行生物信息学分析、亚细胞定位和酵母转录激活活性验证,并使用实时荧光定量PCR技术(quantitative real-time PCR,qRT-PCR)分析该基因的组织表达特异性及其在不同外源胁迫下的表达模式,以期阐述甘蔗响应非生物胁迫的作用及其机制,为深入解析该基因的功能和作用模式奠定基础,同时为甘蔗抗逆分子育种提供优良的基因资源。
1 材料与方法
试验于2016年9月至2018年4月在福建农林大学农业部福建甘蔗生物学与遗传育种重点实验室完成。
1.1 材料处理
组织特异性分析材料:参照黄宁等[23]方法,田间随机选取长势一致的甘蔗品种ROC22植株,连根挖出清洗干净,取幼嫩蔗根,在第七至第八节处取蔗芽、蔗髓和皮,并取甘蔗+1叶,每3株为一个样品,液氮速冻,-80℃保存备用[23]。每个组织取3个生物学重复。
不同外源胁迫处理材料:参考肖新换等[24]方法,田间随机选取长势一致的甘蔗品种ROC22植株,切成单芽蔗茎,在沙中培养至4片完全展开叶。随后放入清水中培养10 d待其长出新的水生根,再用培养液培养2周左右使其生长稳定。选取上述长势一致的甘蔗苗,每3株为一个生物学重复,对其进行分组处理:第1组分别在叶面喷施5 mmol·L-1SA(含0.01%吐温-20,v/v)、100 μmol·L-1茉莉酸甲酯(methyl jasmonate,MeJA)(含0.1%乙醇和0.05%吐温-20,v/v),均于0、3、6和12 h取样;第2组在含25%PEG水溶液中培养,取样时间点为0、3、6和12 h;第3组在含有250 mmol·L-1的NaCl水溶液中培养,于0、6、12和24 h分别取样;第4组分别在500 mmol·L-1氯化铜(cupric chloride,CuCl2)和500 mmol·L-1氯化铬(chromium chloride,CdCl2)水溶液中培养,均于0、12、24和48 h取样。每个处理各取3个生物学重复。每个样品取样完成,液氮速冻,-80℃保存。
1.2 总RNA的提取与cDNA第一链的合成
将上述甘蔗组织材料和外源胁迫材料,在液氮中研磨成粉末,再用Trizol试剂提取总RNA,用1.0%的琼脂糖凝胶电泳检测。参照RQ1 RNase-Free DNase(Promega,中国,上海)试剂使用说明书除去总RNA中含有的DNA污染,按照PrimeScript RT Reagent Kit(Perfect Real Time)(TaKaRa,中国,大连)的使用说明书反转录合成cDNA第一链,并用1.0%琼脂糖凝胶电泳检测所合成cDNA的质量,随后用于检测目的基因的相对表达量。
1.3 甘蔗WRKY的RT-PCR分析
根据甘蔗转录组数据库中发现的一条的Unigene序列,使用Primer Premier 5.0软件设计扩增引物(表1),以甘蔗品种ROC22在NaCl处理6 h的cDNA为模板,进行PCR扩增。PCR体系为cDNA 1.0 μL、DNA酶(5 U·μL-1)0.125 μL、10×Buffer 2.5 μL、dNTPs(2.5 mmol·L-1)2.0 μL、上下游引物ScWRKY6 F/R(10 μmol·L-1)各1.0 μL和ddH2O 17.375 μL。PCR扩增程序为94℃4 min;94℃30 s,65℃30 s,72℃1 min 30 s,35个循环,退火温度每个循环递减0.5℃;72℃10 min。产物经1.5%琼脂糖凝胶电泳检测及胶回收纯化后,连接、转化,PCR筛选阳性克隆,送上海生工生物工程技术服务有限公司进行测序分析。

表1 引物序列及用途
1.4 甘蔗WRKY的生物信息学分析
将测序得到的序列用NCBI中的在线工具ORF finder (https://www.ncbi.nlm.nih.gov/orffinder/)分析开放阅读框;通过在线软件Smart(http://smart. embl-heidelberg.de/)、ExPaSy(http://web.expasy.org/ protparam/)和Prabi(https://npsa-prabi.ibcp.fr/cgi-bin/ secpred_gor4.pl)分析其保守结构域、一级结构和二级结构。磷酸化位点预测:NetPhos(http://www.cbs. dtu.dk/services/NetPhos/);亚细胞定位预测:Cell-PLoc 2.0(http://www.csbio.sjtu.edu.cn/bioinf/plant-multi/)。用NCBI中Blastp工具查找甘蔗ScWRKY6蛋白同源氨基酸序列,并用DNAMAN 6.0软件多重比对同源氨基酸序列。参照Eulgem等[6]对拟南芥WRKY的分类,选取拟南芥8个不同类群的WRKY氨基酸序列、甘蔗中已发表的Sc-WRKY氨基酸序列以及ScWRKY6蛋白同源氨基酸序列,使用MEGA6.0软件中邻位相连法(Neighbor-Joining,NJ)(Bootstrap= 1 000)构建系统进化树。
1.5 甘蔗ScWRKY6蛋白的亚细胞定位分析
通过设计亚细胞定位引物GFP-ScWRKY6-F/R(表1),在目的基因ORF(去掉终止密码子)两端加入酶切位点Ⅰ和Ⅰ,以测序成功的阳性质粒pMD19-T-为模板进行扩增、回收。连接亚细胞定位质粒pCAMBIA1300-,用Ⅰ和Ⅰ双酶切。用T4DNA连接酶将目的基因连接载体pCAMBIA1300-,并转化大肠杆菌DH5α感受态细胞,经测序及酶切验证,获得重组质粒pCAMBIA1300-。将重组质粒和对照空载质粒pCAMBIA1300-分别转入农杆菌GV3101菌株中,把菌液PCR检测为阳性的单克隆菌落于含有35 μg·mL-1利福平和50 μg·mL-1卡那霉素的LB液体培养基中培养,在28℃摇床以250 r/min培养14 h;收集菌体并洗去残留LB液体培养基,用MS液体培养基稀释至OD600=0.8,加入200 μmol·L-1乙酰丁香酮后黑暗中静置1 h。选择5—7片叶且长势一致的本氏烟(),用1.0 mL的针头注射含有目的基因和空载的菌液,暗培养12 h,再在光照16 h/黑暗8 h,最后在温度28℃环境中培养2 d。将含有目的基因和空载的烟草叶片剪下,叶背面朝下置于1 μg·mL-14',6-diamidino-2-phenylindole(DAPI)染色剂中,37℃避光温浴30 min,依次用生理盐水和无菌水清洗后制片,在激光共聚焦显微镜下观察烟草叶片细胞荧光定位情况[25]。
1.6 甘蔗WRKY的酵母转录自激活活性验证
在目的基因ORF(去掉终止密码子)两端加酶切位点Ⅰ和HⅠ,设计引物BD-ScWRKY6-F/R(表1),以阳性质粒pMD19-T-为模板,进行扩增、回收。将胶回收产物和空载质粒pGBKT7分别用Ⅰ和HⅠ进行双酶切,用T4DNA连接酶将连接到载体pGBKT7上,随后转化DH5α感受态细胞,经测序及酶切验证正确,获得酵母表达质粒pGBKT7-。参考徐群刚等[26]方法,以共转载体pGBKT7-53+pGADT7-T为阳性对照,空载pGBKT7为阴性对照,重组质粒pGBKT7-为试验组,分别转化酵母菌株Y2HGold,然后以100、10-1、10-2和10-3倍数稀释,分别点在含SD/-Trp、SD/-Trp(+X-α-Gal)和SD/-Trp(+X-α-Gal+ AbA) 3种平板上,将其放在30℃培养箱,培养2—3 d后拍照[26]。
1.7 甘蔗WRKY的组织特异性及其在不同外源胁迫条件下的表达特性分析
使用Primer Premier 5.0软件设计定量引物qScWRKY6-F/R(表1),以clathrin adaptor complex()和()为内参[27],通过qRT-PCR方法检测目的基因在甘蔗不同组织和不同外源胁迫处理样品中的相对表达量。qRT-PCR反应体系参照SYBR Green PCR Master Mix Kit (Roche,中国,上海)说明书配置,扩增程序为50℃ 2 min;95℃10 min;95℃15 s,60℃ 1 min,40个循环;增加熔解曲线,95℃ 15 s,60℃ 1 min,95℃ 15 s,60℃ 15 s;每个反应3次重复。采用2-△△Ct法计算基因的相对表达量[28],用DPS 9.50软件分析数据的显著性水平,并用软件Origin 8.0绘图。
2 结果
2.1 甘蔗ScWRKY6全长cDNA序列的RT-PCR扩增及序列获得
根据甘蔗转录组数据库挖掘的WRKY基因Unigene序列设计扩增引物,通过RT-PCR扩增得到一个甘蔗类基因,命名为,GenBank登录号为MH393927。序列分析结果表明(图1),该基因序列全长1 289 bp,包括1个1 059 bp的ORF(91—1 149 bp),编码一个含352个氨基酸的蛋白,并含有1个WRKY结构域和1个锌指结构域(CX5CX23HXH)(图1),推测其为第Ⅱ类WRKY转录因子。

*:终止密码子。红色框部分为WRKYGQK基序;黑色框部分为C2H2基序(CX5CX23HXH)
2.2 ScWRKY6及其编码蛋白的生物信息学分析
生物信息学分析显示,ScWRKY6蛋白的理论分子量为37 909.81,理论等电点为9.73,不稳定指数为50.23,是一个不稳定蛋白。此外,该蛋白含有27个酸性氨基酸残基(Asp+Glu)和46个碱性氨基酸残基(Lys+Arg),脂肪族指数为64.26,平均亲水性(GRAVY)为-0.579,由此说明ScWRKY6蛋白可能是一个亲水性蛋白。Smart分析显示(图2),该蛋白还含有EGF_CA(Calcium-binding EGF-like domain)和ChtBD2(Chitin-binding domain type 2)结构域。对ScWRKY6蛋白进行磷酸化位点预测(图3),ScWRKY6氨基酸序列含有45个磷酸化位点,包含35个丝氨酸(Serine)、9个苏氨酸(Threonine)和1个酪氨酸(Tyrosine),预测这些位点可能会发生磷酸化反应。ScWRKY6预测蛋白的二级结构分析显示,其主要具有无规则卷曲、α-螺旋和延伸链。

1:ChtBD2(286—332 bp);2:EGF_CA(282—326 bp)

图3 ScWRKY6磷酸化位点预测
通过NCBI中Blastp工具查找ScWRKY6蛋白的同源氨基酸序列,选取9个不同物种的WRKY氨基酸序列,分别为玉米(,ACG25409.1)、高粱(,XP_002464211.1)、黍(,PAN46075.1)、狗尾草(,XP_004982383.1)、二穗短柄草(,XP_010232453.1)、粗山羊草(,XP_020149328.1)、大麦(,BAJ85995.1)、小麦(,ACD80360.1)和水稻(,BAT17937.1),通过多重序列比对发现(图4),其与甘蔗ScWRKY6蛋白的序列相似度分别为90%、96%、93%、90%、84%、81%、81%、80%和81%,由此推测WRKY蛋白在不同植物中有较高的保守性。系统进化树结果显示(图5),甘蔗ScWRKY6与高粱WRKY和玉米WRKY在同一分支上且遗传距离较近,而与水稻WRKY分类距离较远;另一方面,甘蔗ScWRKY6与拟南芥AtWRKY15和AtWRKY39聚在同一分支上,参照Eulgem等[6]对拟南芥WRKY的分类,其属于WRKY家族中Ⅱd亚类。

玉米:Zea mays,ACG25409.1;高粱:Sorghum bicolor,XP_002464211.1;黍:Panicum miliaceum,PAN46075.1;狗尾草:Setaria viridis,XP_004982383.1;二穗短柄草:Brachypodium distachyum,XP_010232453.1;粗山羊草:Aegilops tauschii,XP_020149328.1;大麦:Hordeum vulgare,BAJ85995.1;小麦:Triticum aestivum,ACD80360.1;水稻:Oryza sativa,BAT17937.1
2.3 ScWRKY6蛋白的亚细胞定位
亚细胞定位结果如图6所示,在注射空载体pCAMBIA1300-的对照组中,绿色荧光在细胞膜、细胞核、细胞质中均有分布,而注射融合载体pCAMBIA1300-的细胞中,细胞核特异性染料DAPI影像与GFP绿色荧光能够完全重合,但在细胞膜和细胞质中均无荧光,说明ScWRKY6蛋白只定位在细胞核上。
2.4 ScWRKY6的转录激活活性分析
为了验证转录因子ScWRKY6的转录激活活性,将的编码区融合到载体pGBKT7的GAL4DNA结合域并转入酵母Y2HGold菌株中(图7),pGBKT7-和阴性对照只能在SD/-Trp和SD/-Trp (+X-α-Gal)培养基上正常生长,说明外源质粒pGBKT7-成功转入酵母中,但它们不能在金担子素A(AbA)缺陷型培养基SD/-Trp(+X-α-Gal+AbA)培养基上生长,且不能使X-α-Gal显蓝色,说明报告基因和均未被激活。而阳性对照组在3种培养基上都能正常生长,并使X-α-Gal显蓝色。结果表明,甘蔗ScWRKY6在酵母细胞中无转录自激活活性。

图5 不同植物WRKY蛋白的系统进化树
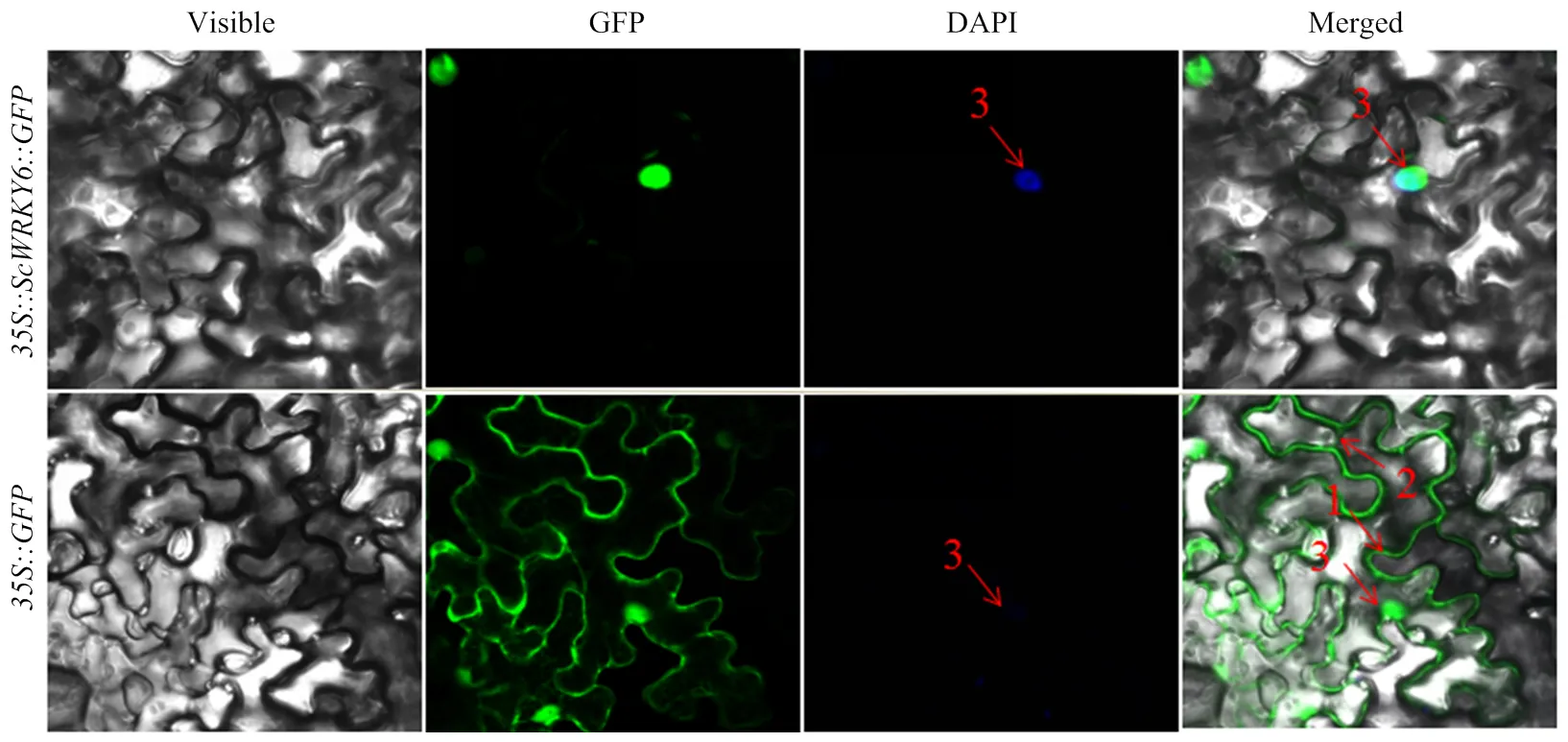
图片采用绿色荧光、明场、绿色荧光和明场叠加这3个视野拍摄。35S::GFP:携带空载pCAMBIA1300-GFP的农杆菌菌株。35S::ScWRKY6::GFP:携带重组载体pCAMBIA1300-ScWRKY6-GFP的农杆菌菌株。红色箭头1、2和3分别代表细胞膜、细胞质和细胞核。比例尺=25 μm

SD/-Trp:色氨酸营养缺陷型平板培养基;SD/-Trp (+X-α-Gal):色氨酸营养缺陷型平板培养基(添加5-溴-4-氯-3-吲哚-α-D-半乳糖苷);SD/-Trp (+X-α-Gal+AbA):色氨酸营养缺陷型平板培养基(添加5-溴-4-氯-3-吲哚-α-D-半乳糖苷和金担子素A)
2.5 ScWRKY6的组织特异性表达分析
组织特异性结果如图8显示,在甘蔗品种ROC22的不同组织中组成型表达,其在蔗芽中的表达量最高,其后由高到低依次为叶、根、皮和蔗髓。其中,蔗芽、叶和根的表达量依次为蔗髓的2.05、1.55和1.37倍。

不同小写字母表示差异显著性(p≤0.05),误差线为每组处理的标准误差(N=3)。下同
2.6 ScWRKY6在不同外源胁迫下的表达特性分析
利用qRT-PCR分析不同外源胁迫下的表达情况(图9)。从图中可以看出,的表达量在施加MeJA 6 h后显著上升,为对照组的2.01倍,随后其表达量无显著变化;在SA胁迫处理下,该基因的表达量无明显变化。在PEG胁迫诱导下,的表达量在3 h时显著上升并达到峰值,为对照组的6.88倍,随后该基因的表达量迅速下降并恢复到对照组水平。在NaCl处理下,的表达量在12 h达到峰值,为对照的4.18倍,而在处理后6 h与24 h,其表达量与对照均无显著差异。在重金属CuCl2胁迫下,的表达量在处理后12 h无显著变化,而在24和48 h其表达量相对于对照组显著上调;而在CdCl2胁迫下,的表达量整体处于上调的趋势,且在24 h达到最大值,约为对照组的4.86倍。
3 讨论
植物在生长过程中经常受到各种生物及非生物胁迫的影响,为适应这些不良环境,植物体形成了一套完善的防御调控机制[5]。转录调控是生物体控制基因表达的主要机制,对植物生长发育和应答外源胁迫具有重要意义[29]。WRKY转录因子是植物最大的转录因子家族之一[30],同时也是植物调控网络的重要组分。前人研究发现,WRKY基因家族在生物[31]及非生物[32-33]逆境应答、植物激素信号转导[9]、植物的生长发育[34]和物质代谢途径[35]等过程发挥作用,是一类广谱性调控因子。

图9 甘蔗ScWRKY6在不同外源胁迫下的表达特性
3.1 ScWRKY6蛋白结构与功能的关系
本研究从甘蔗中克隆得到的cDNA全长序列,生物信息学分析显示,该基因编码的蛋白可能为碱性不稳定亲水性蛋白,这与芍药(Pall)[36]、葡萄()[37]等中的分析结果相似。对ScWRKY6蛋白进行磷酸化位点预测,发现其有45个氨基酸磷酸化位点。前人研究发现蛋白质可以通过磷酸化来调控蛋白质活力与功能,进而在细胞信号转导中起重要作用[38],因此这些磷酸化位点可能与ScWRKY6蛋白的活性调控有关。甘蔗ScWRKY6蛋白含有1个WRKY结构域及1个ChtBD2几丁质结合域。前人研究表明含有几丁质结合域的几丁质酶一般具有抗菌和抗虫功能[39],由此推测可能对植物应对生物胁迫有积极响应。此外,ScWRKY6还含有一个EGF_CA,即钙结合表皮生长因子类结构域。拟南芥中也发现并分离出了类似的钙调蛋白结合域[40]。钙离子是细胞内的第二信使,对各种逆境信号起转导作用[41],而钙结合蛋白的含量与植物耐旱、耐盐和抗寒性有关[42],因此,EGF_CA结构域的存在,暗示可能在植物逆境响应机制中发挥作用。根据Eulgem等[6]对拟南芥WRKY的分类,AtWRKY15和AtWRKY39均属于Ⅱd亚类,系统进化树聚类结果表明ScWRKY6与其在同一分支上,同样属于WRKY家族Ⅱd亚类(图5),预测基因和拟南芥Ⅱd亚类WRKY基因有相似的功能。已被报道参与植物生长、盐胁迫和渗透压的调节[43]。Li等[44]发现受热胁迫的诱导并积极响应SA和JA的信号传导;由此为的功能研究提供线索。进化树中聚类关系越相近,各成员间功能类似的可能性越大[45],因此,进化树分析结果也暗示着甘蔗与高梁的亲缘关系最近(图5)。
3.2 ScWRKY6的作用方式
亚细胞定位结果显示ScWRKY6蛋白定位在细胞核上,这与生物信息学预测结果相同,同时与水稻[10]、棉花(spp.)[46]和谷子[47]等报道相同,这也与其在植物体中的转录调节功能一致。本研究发现甘蔗ScWRKY6转录因子在酵母体内不具有转录自激活活性,这与前人研究结果是类似的[48]。玉米ZmWRKY17在酵母中也未显示转录激活活性[49]。大豆()GmWRKY13、GmWRKY27、GmWRKY40和GmWRKY54蛋白也都不具有转录激活活性,在酵母双杂中GmWRKY13能形成蛋白二聚体,这可能与其转录功能的行使有关[48]。而对于ScWRKY6蛋白调控下游靶基因转录表达的机制有待进一步研究。基因在苹果(Mill.)[50]、白菜()[51]、大豆[52]、杨树(L.)[53]等多种植物的不同器官中均有表达,且表达量存在差异。本研究中,在甘蔗叶、皮、蔗髓、蔗芽和根中均有表达,其中在蔗芽中的表达量最高,在根中的表达量最低,表明该基因在甘蔗中组成型表达并具有组织特异性,这与芍药在芽、叶片和萼片的表达量较高,在茎和根中表达量较低的结果类似[36]。
3.3 不同外源胁迫对ScWRKY6表达特异性的影响
SA是病原菌侵染后植物防卫反应信号途径的重要组分[44],也是植物产生系统获得性抗性(systematic acquired resistance,SAR)的诱导因子[54]。SA通过诱导防御基因的表达或介导信号传导等方式参与植物抗病进程[55],SA还能作为胞外信号通过抑制过氧化氢酶活性,提高H2O2水平,进而促进木质素的合成,最终抑制病原菌的生长[56]。本研究中,表达量在SA诱导下无明显变化,推测该基因可能不参与SA介导的病原菌侵染过程。茉莉酸(jasmonic acid,JA)是一种重要的植物激素,除了能调节植物开花、叶片衰老等发育过程,还能介导植物对不同环境胁迫的响应[57]。Jiang等[58]发现拟南芥对灰葡萄孢菌()的负调控取决于JA信号传导途径,且能直接结合编码JA信号通路的2个重要阻遏物(JAZ1和JAZ5)的启动子上,并激活它们的转录;香蕉(Lour.)在冷胁迫或MeJA诱导下,其被诱导表达,进而提高香蕉果实的耐寒性[59]。本研究中,受MeJA诱导上调表达,推测参与了由MeJA介导的逆境胁迫防御过程和代谢途径。干旱和盐胁迫是2种主要的非生物胁迫,都会导致作物产量和品质的降低[60]。PEG是一种高分子渗透剂,其本身无法穿越细胞壁进入细胞质,不会造成壁分离,能使植物细胞和组织处于类似于干旱胁迫的状态中[61]。拟南芥能够赋予转基因水稻较高耐旱性,并且提高了其对PEG胁迫的耐受性,在胁迫条件下转基因植株脯氨酸含量和活性氧清除酶活性增强,胁迫响应基因(和)显著上调[62];本研究发现,甘蔗在PEG诱导下表达量明显上调,且在3 h处表达量最高,推测其可能通过渗透物质的调节、抗氧化酶的积累及干旱胁迫响应基因的诱导等途径参与甘蔗对干旱胁迫的响应。Gruber等[63]分析蒺藜苜蓿()根部所有转录因子,发现只有WRKY转录因子家族显著受到盐胁迫调控,表明WRKY类转录因子更广泛地参与植物的耐盐机制。在盐胁迫下,葡萄过表植株通过调节活性氧清除和渗透物质的积累来增加植株对盐胁迫的耐受性[64]。本研究中,甘蔗的表达量受NaCl胁迫的诱导显著增加,其可能通过相同途径来提高甘蔗对盐胁迫的耐受性。Cd2+能植物根系的有丝分裂,阻碍根伸长生长[65];过量的Cd2+和Cu2+则会抑制植物光合和呼吸作用,破坏DNA和细胞膜完整性,最终使植物生长发育受阻甚至引起死亡[66]。WRKY转录因子也能参与植物对金属胁迫响应及转运过程,比如Liu等[67]发现拟南芥中、和参与镉胁迫应答响应,且双突变体或三突变体对镉胁迫耐受性更强。本研究发现,甘蔗的表达同样受CdCl2和CuCl2胁迫的诱导表达,推测其可能通过增加逆境蛋白和脯氨酸的积累和抗氧化酶活性的提高,参与甘蔗Cd2+和Cu2+金属离子胁迫响应。综上所述,可能在甘蔗响应干旱、高盐及金属离子胁迫等多种非生物胁迫过程中起重要作用。
4 结论
从甘蔗中克隆获得一个WRKY转录因子基因,命名为,该基因序列全长1 289 bp,包含1个1 059 bp的ORF,编码352个氨基酸,预测其为碱性不稳定亲水性非分泌蛋白。该蛋白具有1个WRKY保守结构域和C2H2(CX5CX23HXH)锌指结构域,属于WRKY转录因子家族的Ⅱd亚类,定位于细胞核,没有自激活活性。在甘蔗中组成型表达并具有组织特异性,在蔗芽中表达量最高,根中的表达量最低;在NaCl、PEG、MeJA、重金属Cu2+和Cd2+胁迫诱导下表达量均上调,可能在甘蔗抗旱、耐盐及响应金属离子胁迫中发挥作用。
[1] 赵培方, 赵俊, 刘家勇, 昝逢刚, 夏红明, Jackson P A, Basnayake J, Inman-Bamber N G, 杨昆, 赵丽萍, 覃伟, 陈学宽, 赵兴东, 范源洪. 干旱胁迫对甘蔗4个生理指标遗传变异的影响中国农业科学, 2017, 50(1): 28-37.
ZHAO P F, ZHAO J, LIU J Y, ZAN F G, XIA H M, Jackson P A, Basnayake J, Inman-Bambe N G, YANG K, ZHAO L P, QIN W, CHEN X K, ZHAO X D, FAN Y H. Genetic variation of four physiological indexes as impacted by water stress in sugarcane., 2017, 50(1): 28-37. (in Chinese)
[2] 张风娟, 李健, 杜成忠, 杨丽涛, 李杨瑞, 邢永秀. 不同甘蔗品种叶片气孔对水分胁迫的响应. 广西植物, 2014, 34(6): 821-827.
ZHANG F J, LI J, DU C Z, YANG L T, LI Y R, XING Y X. Stomatal response to water stress in leaves of different sugarcane cultivars., 2014, 34(6): 821-827. (in Chinese)
[3] ASHRAF M, RAHMATULLAH, AHMAD R, AFZAL M, TAHIR M A, KANWAL S, MAQSOOD M A. Potassium and silicon improve yield and juice quality in sugarcane (L.) under salt stress., 2009, 195(4): 284-291.
[4] MENOSSI M, SILVAFILHO M C, VINCENTZ M, VANSLUYS M A, SOUZA G M. Sugarcane functional genomics: Gene discovery for agronomic trait development., 2008, 2008: 458732.
[5] 孔维龙, 于坤,但乃震, 杨绍宗, 包满珠, 黄向荣, 傅小鹏. 甜菜WRKY转录因子全基因组鉴定及其在非生物胁迫下的表达分析. 中国农业科学, 2017, 50(17): 3259-3273.
KONG W L, YU K, DAN N Z, YANG S Z, BAO M Z, HUANG X R, FU X P. Genome-wide identification and expression analysis of WRKY transcription factor under abiotic stress in, 2017, 50(17): 3259-3273. (in Chinese)
[6] EULGEM T, RUSHTON P J, ROBATZEK S, SOMSSICH I E. The WRKY superfamily of plant transcription factors., 2000, 5(5): 199-206.
[7] BAKSHI M, OELMULLER R. WRKY transcription factors., 2014, 9(2): e27700.
[8] PHUKAN U J, JEENA G S, SHUKLA R K. WRKY transcription factors: Molecular regulation and stress responses in plants, 2016, 7: 760.
[9] JIANG J J, MA S H, YE N H, JIANG M, CAO J, ZHANG J H. WRKY transcription factors in plant responses to stresses, 2017, 59(2): 86-101.
[10] LEE H, CHA J, CHOI C, CHOI N, JI H S, SANG R P, LEE S, HWANG D J. Riceplays a role in pathogen defense and drought tolerance, 2018, 11(1): 5.
[11] YANG G Y, YANG G Y, ZHANG W H, SUN Y D, ZHANG T T, HU D, ZHAI M Z. Two novelgenes from,and, are involved in abscisic acid-dependent stress responses., 2017, 61(4): 611-621.
[12] GUO P R, LI Z H, HUANG P X, LI B, FANG S, CHU J F, GUO H W. A tripartite amplification loop involving the transcription factor WRKY75, salicylic acid, and reactive oxygen species accelerates leaf senescence., 2017, 29: 2854-2870.
[13] Zhang L P, Chen L G, Yu D Q. Transcription factor WRKY75interacts with DELLA proteins to affect flowering., 2018, 176(1): 790-803.
[14] CHEN M H, YAN T X, SHEN Q, LU X, PAN Q F, HUANG Y R, TANG Y L, FU X Q, LIU M, JIANG W M, LV Z Y, SHI P, Ma Y N, HAO X L, ZHANG L D, LI L, TANG K X. Landular trichome-specific WRKY 1 promotes artemisinin biosynthesis in., 2017, 214(1): 304-316.
[15] ISHIGURO S, NAKAMURA K. Characterization of a cDNA encoding a novel DNA-binding protein, SPF1, that recognizes SP8 sequences in the 5' upstream regions of genes coding for sporamin and beta-amylase from sweet potato., 1994, 244(6): 563-571.
[16] ROSS C A, LIU Y, SHEN Q J. Thegene family in rice ()., 2007, 49(6): 827-842.
[17] Eulgem T, Somssich I E. Networks of WRKY transcription factors in defense signaling., 2007, 10(4): 366-371.
[18] WEI K F, CHEN J, CHEN Y F, WU L J, XIE D X. Molecular phylogenetic and expression analysis of the complete WRKY transcription factor family in maize., 2012, 19(2): 153-164.
[19] HE H S, DONG Q, SHAO Y H, JIANG H Y, ZHU S W, CHENG B J, XIANG Y. Genome-wide survey and characterization of thegene family in., 2012, 31(7): 1199-1217.
[20] MUTHAMILARASAN M, BONTHALA V S, KHANDELWAL R, JAISHANKAR J, SHWETA S, NAWAZ K, PRASAD M. Global analysis of WRKY transcription factor superfamily inidentifies potential candidates involved in abiotic stress signaling., 2015, 6: 910.
[21] LAMBAIS M R. In silico differential display of defense-related expressed sequence tags from sugarcane tissues infected with diazotrophic endophytes., 2001, 24(1/4): 103-111.
[22] LIU J X, QUE Y X, GU J L, XU L P, WU J Y, CHEN R K. Molecular cloning and expression analysis of a WRKY transcription factor in sugarcane, 2012, 11(24): 6434-6444.
[23] 黄宁, 张玉叶, 凌辉, 罗俊, 吴期滨, 阙友雄. 甘蔗二氨基庚二酸异构酶基因的克隆与表达分析.热带作物学报, 2013, 34(11): 2200-2208.
HUANG N, ZHANG Y Y, LING H, LUO J, WU Q B, QUE Y X. Cloning and expression analysis of a diaminopimelate epimerase gene in sugarcane., 2013, 34(11): 2200-2208. (in Chinese)
[24] 肖新换, 黄宁, 张玉叶, 杨宗锋, 凌辉, 黄珑, 苏炜华, 阙友雄. 甘蔗光合系统Ⅰ亚基O基因的克隆与表达分析. 应用与环境生物学报, 2015, 21(2): 208-214.
XIAO X H, HUANG N, ZHANG Y Y, YANG Z F, LING H, HUANG L, SU W H, QUE Y X. Cloning and expression of photosystem I subunit O gene from sugarcane.,2015, 21(2): 208-214. (in Chinese)
[25] 苏炜华, 黄珑, 黄宁, 刘峰, 苏亚春, 肖新换, 凌辉, 阙友雄. 甘蔗细胞色素P450还原酶基因的RT-PCR扩增与表达分析. 应用与环境生物学报, 2016, 22(2): 173-178. (in Chinese)
SU W H, HUANG L, HUANG N, LIU F, SU Y C, XIAO X H, LING H, QUE Y X. RT-PCR amplification and expression analysis of a cytochrome P450 reductase gene from sugarcane., 2016, 22(2): 173-178.
[26] 徐群刚, 邝健飞, 单伟, 陆旺金, 陈建业. 香蕉果实冷胁迫相关MaWRKY11转录因子的特性、互作蛋白筛选与鉴定. 热带亚热带植物学报, 2015, 23(5): 543-552.
XU Q G, KUANG J F, SHAN W, LU W J, CHEN J Y. Characterization and interacting-protein identification of MaWRKY11 transcription factor related to cold stress from banana fruits., 2015, 23(5): 543-552.(in Chinese)
[27] GUO J L, LING H, WU Q B, XU L P, QUE Y X. The choice of reference genes for assessing gene expression in sugarcane under salinity and drought stresses., 2014, 4: 7042.
[28] LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-△△Ctmethod., 2001, 25(4): 402-408.
[29] SHUAI L, LUO C G, ZHU L M, SHA R H, QU S C, CAI B H, WANG S H. Identification and expression analysis oftranscription factor genes in response to fungal pathogen and hormone treatments in apple ()., 2017, 60(2): 215-230.
[30] BANERHEE A, ROYCHOUDHURY A. WRKY proteins: Signaling and regulation of expression during abiotic stress responses., 2015, 2015: 807560.
[31] JIANG M, LIU Q E, LIU Z N, LI J Z, HE C M. Over-expression of a WRKY transcription factor geneenhances resistance to downy mildew in transgenicplants., 2016, 45(3): 327-334.
[32] CHEN L G, SONG Y, LI S J, ZHANG L P, ZOU C S, YU D Q. The role of WRKY transcription factors in plant abiotic stresses., 2012, 1819(2): 120-128.
[33] YUE H, WANG M, LIU S Y, DU X H, SONG W N, NIE X J. Transcriptome-wide identification and expression profiles of the WRKY transcription factor family in Broomcorn millet (L.)., 2016, 17(1): 343.
[34] VERWEIJ W, SPELT C E, BLIEK M, DE M V, WIT N, FARACO M, KOES R, QUATTROCCHIO F M. Functionally similar WRKY proteins regulate vacuolar acidification inand hair development in., 2016, 28(3): 786-803.
[35] GIRI C C, ZAHEER M. Chemical elicitors versus secondary metabolite productionusing plant cell, tissue and organ cultures: recent trends and a sky eye view appraisal., 2016, 126(1): 1-18.
[36] 李俊杰, 韩璐璐, 马燕, 姚汪劲, 松国静, 郭先锋. 芍药转录因子的克隆及表达分析. 植物生理学报, 2017, 53(4): 609-618.
LI J J, HAN L L, MA Y, YAO W J, SONG G J, GUO X F. Cloning and expression analysis oftranscription factor., 2017, 53(4): 609-618. (in Chinese)
[37] 肖培连, 冯睿杰, 侯丽霞, 吕晓彤, 朱丹, 刘新. 葡萄基因的克隆及表达特性分析. 植物生理学报, 2015, 51(3): 391-398.
XIAO P L, FENG R J, HOU L X, LVX T, ZHU D, LIU X. Gene cloning and expression analysis of., 2015, 51(3): 391-398. (in Chinese)
[38] LI R, ZHANG J, LI J, ZHOU G, WANG Q, BIAN W, ERB M, LOU Y. Prioritizing plant defence over growth through WRKY regulation facilitates infestation by non-target herbivores., 2015, 17(4): e04805.
[39] 欧阳石文, 冯兰香, 赵开军. 植物几丁质结合蛋白及几丁质结合域特征和作用. 生命科学, 2002, 14(2): 89-91.
OUYANG S W, FENG L X, ZHAO K J. Plant chitin-binding proteins and charaeters and roles of chitin binding domains., 2002, 14(2): 89-91. (in Chinese)
[40] PARK C Y, LEE J H, YOO J H, MOON B C, CHOI M S, KANG Y H, LEE S M, KIM H S, KANG K Y, CHUNG W S, LIM C O, CHO M J. WRKY group IId transcription factors interact with calmodulin., 2005, 579(6): 1545-1550.
[41] GILROY S, TREWAVAS A. Signal processing and transduction in plant cells: the end of the beginning?, 2001, 2(4): 307-314.
[42] HIRSCHI K D. The calcium conundrum. Both versatile nutrient and specific signal., 2004, 136(1): 2438-2442.
[43] VANDERAUWERA S, VANDENBROUCKE K, INZE A, VAN D C B, MUHLENBOCK P, DE R D, NAOUAR N, VAN G T, VAN M M C, VAN B F.perturbation abolishes the mitochondrial stress response that steers osmotic stress tolerance in., 2012, 109(49): 20113-20118.
[44] LI S J, ZHOU X, CHEN L G, HUANG W D, YU D Q. Functional characterization of, 2010, 29(5): 475-483.
[45] SHANG H H, WANG Z N, ZOU C S, ZHANG Z, LI W J, LI J, SHI Y Z, GONG W K, CHEN T T, LIU A Y, GONG J W, GE Q, YUAN Y L. Comprehensive analysis of NAC transcription factors in diploid: sequence conservation and expression analysis uncover their roles during fiber development., 2016, 59(2): 142-153.
[46] WANG X L, YAN Y, LI Y Z, CHU X Q, WU C G, GUO X Q., a multiple stress-responsive cottongene, plays an important role in the wounding response and enhances susceptibility toinfection in transgenic., 2014, 9(4): e93577.
[47] 祖倩丽, 尹丽娟, 徐兆师, 陈明, 周永斌, 李连城, 马有志, 闵东红, 张小红. 谷子WRKY36转录因子的分子特性及功能鉴定中国农业科学, 2015, 48(5): 851-860.
ZU Q L, YIN L J, XU Z S, CHEN M, ZHOU Y B, LI L C, MA Y Z, MIN D H, ZHANG X H. Molecular characteristics and functional identification of foxtail millet transcription factor WRKY36, 2015, 48(5): 851-860. (in Chinese)
[48] ZHOU Q Y, TIAN A G, ZOU H F, XIE Z M, LEI G, HUANG J, WANG C M, WANG H W, ZHANG J S, CHEN S Y. Soybean WRKY-type transcription factor genes,,, and, confer differential tolerance to abiotic stresses in transgenicplants., 2008, 6(5): 486-503.
[49] CAI R H, DAI W, ZHANG C S, WANG Y, WU M, ZHAO Y, MA Q, XIANG Y, CHENG B J. The maize WRKY transcription factor ZmWRKY17 negatively regulates salt stress tolerance in transgenicplants., 2017, 246(6): 1215-1231.
[50] 谷彦冰, 冀志蕊, 迟福梅, 乔壮, 徐成楠, 张俊祥, 董庆龙, 周宗山. 苹果基因家族生物信息学及表达分析. 中国农业科学, 2015, 48(16): 229-230.
GU Y B, JI Z R, CHI F M, QIAO Z, XU C N, ZHANG J X, DONG Q L, ZHOU Z S. Bioinformatics and expression analysis of thegene family in apple., 2015, 48(16): 229-230. (in Chinese)
[51] TANG J, WANG F, HOU X L, WANG Z, HUANG Z N. Genome-wide fractionation and identification of WRKY transcription factors in Chinese cabbage (ssp.) reveals collinearity and their expression patterns under abiotic and biotic stresses., 2014, 32(4): 781-795.
[52] YIN G J, XU H L, XIAO S Y, QIN Y J, LI Y X, YAN Y M, HU Y K. The large soybean () WRKY TF family expanded by segmental duplication events and subsequent divergent selection among subgroups., 2013, 13(1): 148.
[53] JIANG Y Z, DUAN Y J, YIN Y, YE S L, ZHU J R, ZHANG F Q, LU W X, FAN D, LUO K.Genome-wide identification and characterization of theWRKY transcription factor family and analysis of their expression in response to biotic and abiotic stresses., 2014, 65(22): 6629-6644.
[54] LIU B, XUE X D, CUI S P, ZHANG X Y, HAN Q M, ZHU L, LIANG X F, WANG X J, HUANG L L, CHEN X M, KANG Z S. Cloning and characterization of a wheat beta-1,3-glucanase gene induced by the stripe rust pathogenf. sp., 2010, 37(2): 1045-1052.
[55] VLOT A C,DEMPSEY D A, KLESSIG D F. Salicylic acid, a multifaceted hormone to combat disease.y, 2009, 47(1): 177-206.
[56] 龙亚芹, 王万东, 王美存, 陈于福, 解德宏, 陈华蕊, 俞艳春, 尼章光. 水杨酸(SA)诱导植物对病虫害产生抗性及作用机制研究. 热带农业科学, 2009, 29(12): 46-50.
LONG Y Q, WANG W D, WANG M C, CHEN Y F, XIE D H, CHEN H R, YU Y C, NI Z G. Salicylic acid induced resistance of plants against insects and diseases and its interaction mechanism., 2009, 29(12): 46-50. (in Chinese)
[57] CAO J J, LI M Y , CHEN J, LIU P, LI Z. Effects of MeJA onmetabolome under endogenous JA deficiency., 2016, 6: 37674.
[58] JIANG Y J, Yu D Q. The WRKY57 transcription factor affects the expression of jasmonate ZIM-domain genes transcriptionally to compromiseresistance, 2016, 171(4): 2771-2782.
[59] YE Y J, XIAO Y Y, HAN Y C, SHAN W, FAN Z Q, XU Q G, KUANG J F, LU W J, LAKSHMANAN P, CHEN J Y. Banana fruit VQ motif-containing protein5 represses cold-responsive transcription factorinvolved in the regulation of JA biosynthetic genes., 2016, 6: 23632.
[60] ZHU J K. Plant salt tolerance., 2001, 6(2): 66-71.
[61] ATTREE S M, FOWKE L C. Embryogeny of gymnosperms: advances in synthetic seed technology of conifers.,, 1993, 35(1): 1-35.
[62] JIANG Y J, QIU Y P, HU Y R, YU D Q. Heterologous expression ofconfers drought tolerance in., 2016, 7: 145.
[63] GRUBER V, BLANCHET S, DIET A, ZANAF O, BOUALEM A, KAKAR K, ALUNNI B, UDVARDI M, FRUGIER F, CRESPI M. Identification of transcription factors involved in root apex responses to salt stress in., 2009, 281(1): 55-66.
[64] ZHU D, HOU L X, XIAO P L, GUO Y, DEYHOLOS M K, LIU X. VvWRKY30, a grape WRKY transcription factor, plays a positive regulatory role under salinity stress., 2018.
[65] 王学华, 戴力. 作物根系镉滞留作用及其生理生化机制. 中国农业科学, 2016, 49(22): 4323-4341.
WANG X H, DAI L. Immobilization effect and its physiology and biochemical mechanism of the cadmium in crop roots., 2016, 49(22): 4323-4341. (in Chinese)
[66] SK0RZYNSKAPOLIT E, DRAZKIEWICZ M, KRUPA Z. Lipid peroxidation and antioxidative response inexposed to cadmium and copper., 2010, 32(1): 169.
[67] LIU Z Q, FANG H H, PEI Y X, JIN Z P, ZHANG L P, LIU D M. WRKY transcription factors down-regulate the expression of H2S-generating genes, LCD and DES in., 2015, 60(11): 995-1001.
Cloning and Expression Analysis of a Ⅱd Sub-group WRKY Transcription Factor Gene from Sugarcane
ZHANG Xu, LING Hui, LIU Feng, HUANG Ning, WANG Ling, MAO HuaYing, LI CongNa, TANG HanChen, SU WeiHua, SU YaChun, QUE YouXiong
(Key Laboratory of Sugarcane Biology and Genetic Breeding (Fujian), Ministry of Agriculture, Fujian Agriculture and Forestry University/Key Laboratory of Crop Genetics and Breeding and Comprehensive Utilization, Ministry of Education, Fujian Agriculture and Forestry University, Fuzhou 350002)
【Objective】 WRKY, a group of unique transcription factors in plants, plays an important role in plant physiological regulation and stress response. Through analysis of the role of transcription factor WRKYin sugarcane growth and development and stress resistance, this study will provide excellent gene resources for sugarcane resistance molecular breeding. 【Method】A unigene sequence ofgene was extracted from the sugarcane transcriptome database, and its full-length cDNA sequence was obtained byRT-PCR amplification. Bioinformatics analysis of this gene sequence and its encoded protein sequence was performed using ORF finder, Smart, ExPaSy, Prabi, NetPhos, Cell-PLOC 2.0 and DNAMAN6.0 softwares, and the phylogenetic tree analysis was constructed using MEGA6.0 software. The fusion expression vector of pCAMBIA1300-was constructed and delivered intobymediated method to determine the subcellular localization of WRKY protein in tobacco leaves. Yeast hybridization assay was used to verify whether WRKY possess transcriptional self-activation activity. The tissue specific expression (root, bud, leaf, stem pith and epidermis) ofand its dynamic expression under MeJA (100 μmol·L-1), SA (5 mmol·L-1), PEG (25%), NaCl (250 mmol·L-1), CuCl2(500 mmol·L-1) and CdCl2(500 mmol·L-1) stresses in sugarcane variety ROC22 were analyzed by quantitative real-time PCR (qRT-PCR) technique.【Result】A WRKY transcription factor gene, named(GenBank Accession Number: MH393927), was cloned from the sugarcane variety ROC22. This gene sequence was 1 289 bp in full length with a 1 059 bp ORF, encoding 352 amino acids, and contained 45 phosphorylation sites. The theoretical isoelectric point, the instability index and the hydrophilicity of ScWRKY6 protein was 9.73, 50.23 and -0.579, respectively, which is supposed to be an alkaline unstable hydrophilic protein. The ScWRKY6 protein has one WRKY domain and one zinc finger motif (CX5CX23HXH), and its amino acid sequence has the highest homology withWRKY(XP_002464211.1). It is speculated that this gene belongs to the Ⅱd sub-group of WRKY family according to phylogenetic tree analysis. Subcellular localization results showed that the ScWRKY6::GFP fusion protein was located in the nucleus. Yeast transcriptional activation verification experiments indicated that ScWRKY6 protein did not have transcriptional auto-activation activity. qRT-PCR analysis revealed thatwas constitutively expressed in sugarcane, and the expression level in order from high to low were in bud, leaf, root, stem epidermis and stem pith. Its expression in bud, leaf and root were 2.05, 1.55 and 1.37 times higher than that in stem pith, respectively. The expression level ofwas up-regulated under the stresses of NaCl, PEG, MeJA, Cu2+and Cd2+. Its highest expression was 4.18, 6.88, 3.63, 4.86 times higher than of the control when treated with NaCl for 12 h, PEG for 3 h, CuCl2for 24 h and CdCl2for 24 h, respectively.【Conclusion】 ScWRKY6 protein was located in the nucleus and did not have transcriptional auto-activation activity. The gene was expressed in different sugarcane tissues and was induced by NaCl, PEG, CuCl2and CdCl2treatments. It is presumed that themay play a role in response to drought stress, salt tolerance and metal ion stress in sugarcane.
sugarcane; WRKY transcription factor; exogenous stress; qRT-PCR
10.3864/j.issn.0578-1752.2018.23.002
2018-06-12;
2018-07-29
国家自然科学基金(31671752和31101196)、福建省杰出青年基金(2015J06006)、福建省高校杰出青年科研人才计划项目(苏亚春-2017)、国家农业产业技术体系项目(CARS-17))
张旭,E-mail:1280355947@qq.com。
阙友雄,E-mail:queyouxiong@126.com
(责任编辑 李莉)
