大豆GmLEA的分离及其在种子活力中的功能分析
2018-12-11周亚丽朱雅婧赵飞云王爽刘骕骦郭凌凯赵海红麻浩
周亚丽,朱雅婧,赵飞云,王爽,刘骕骦,郭凌凯,赵海红,麻浩
大豆的分离及其在种子活力中的功能分析
周亚丽,朱雅婧,赵飞云,王爽,刘骕骦,郭凌凯,赵海红,麻浩
(南京农业大学作物遗传与种质创新国家重点实验室,南京 210095)
【目的】大豆((L.) Merr.)种子从发育成熟期(R6或R7期)开始具有活力,在此时期容易受到高温高湿胁迫,导致种子活力下降。通过对的研究,揭示其高温高湿胁迫下的表达水平以及功能,为一步深入研究在参与大豆种子活力形成及响应非生物胁迫等方面奠定基础。【方法】利用Primer Premier 5.0软件设计引物,以宁镇1号和湘豆3号叶片的cDNA为模板,分离大豆的cDNA序列全长。通过NCBI网站Blast对GmLEA同源性氨基酸序列进行搜索,使用MEGA 6.0和DNAMAN多重比对蛋白质序列,并采用MEGA 6.0的N-J算法构建进化树。通过酵母双杂交试验验证GmLEA与GmCDPKSK5在酵母体内的互作。构建亚细胞定位和双分子荧光互补(bimolecular fluorescence complementation,BiFC)载体,通过基因枪介导法转化烟草叶片分析GmLEA与GmCDPKSK5在烟草叶片细胞内的互作及其编码蛋白的亚细胞定位。利用实时荧光定量PCR技术(qRT-PCR)对的组织特异性表达及其在高温高湿胁迫下的表达进行分析。构建pBI121融合表达载体,通过农杆菌介导法获得3个纯合的T3代过表达拟南芥株系,对高温高湿胁迫下拟南芥的种子活力进行分析。【结果】获得大豆的cDNA序列全长,该基因包含一个长1 377 bp的开放阅读框(ORF);且该基因所编码的蛋白定位在烟草叶片细胞的细胞膜上。酵母双杂交试验与双分子荧光互补(BiFC)试验结果表明,GmLEA与GmCDPKSK5分别在酵母体内与烟草叶片细胞的细胞膜上存在特异性互作。组织特异性分析结果表明,主要在宁镇1号和湘豆3号2个品种发育和成熟的种子中表达。在湘豆3号种子发育过程中的表达量呈先上升后下降的趋势,在开花后50 d达最大值,在宁镇1号种子发育过程中该基因的表达量呈上升的趋势,在开花后60 d达到最大值。高温高湿胁迫后,与对照相比,在湘豆3号中96 h时下调表达,其余时间点均上调表达,在宁镇1号中,仅24 h时下调表达。过表达拟南芥株系经高温高湿胁迫后的发芽势、发芽率及种子活力均显著(<0.01)高于野生型植株。【结论】参与高温高湿胁迫下种子活力的形成,与GmCDPKSK5存在特异性互作,二者可能共同参与高温高湿胁迫下种子活力的形成。
大豆;;;高温高湿;种子活力
0 引言
【研究意义】大豆是世界上最重要的饲粮兼用作物,可作为植物蛋白最主要来源之一。中国南方是春大豆生产的重要区域,然而在春大豆种子发育成熟时期(R6或R7期),该地区常处于高温、多雨、高湿的季节(6月底—8月初),同时大豆籽粒大,蛋白、脂肪和水分含量高,导致种子田间劣变严重,种子活力下降[1]。因此,耐高温高湿的大豆新品种的选育尤为重要。【前人研究进展】种子活力(seed vigor)是一种以植物生理学、生物化学和遗传学为根本的种子生理学方面的一个新领域[2]。通常来说,种子活力的高低主要是由遗传因子和种子发育过程中的条件一起决定的[3]。种子成熟后,会开始走向衰老和劣变即老化,这一过程是不可逆的。种子老化与其贮藏条件密切相关,其中高温高湿的环境是引起种子老化的重要因素。一般来说,种子老化后,会造成活力降低,细胞质膜完整性破坏,内部保护酶系统活性降低,脂质过氧化加剧、有毒有害物质积累等[4]。目前,对于种子收获和储藏时种子发生劣变从而导致大豆种子活力降低的各种因素已成为研究的热点[5-9]。大豆在种子发育成熟期遭遇高温、多雨的天气会导致种子活力降低、营养品质和外观品质下降[3,5,10-11],高温高湿胁迫已成为造成大豆种子劣变的重要原因之一[12]。关于高温高湿胁迫后对种子活力影响生理方面的研究已取得重大进展,但关于分子机制的研究较少。近几年,关于分子机制的研究取得了一定的进展。在不抗种子田间劣变春大豆种质宁镇1号和抗种子田间劣变春大豆种质湘豆3号生理成熟期,宋利茹等对其进行模拟田间高温高湿胁迫处理,通过2-DE电泳和MALDI-TOF/TOF鉴定了33个差异蛋白,这些蛋白在贮藏蛋白、转运过程、氧化还原平衡、能量代谢、蛋白合成等代谢途径与细胞过程中发挥作用[13]。王爽[1]研究发现在响应高温高湿胁迫中发挥重要作用,并以GmCDPKSK5为诱饵,构建高温高湿胁迫下抗种子田间劣变春大豆种质种子膜蛋白酵母双杂交文库,筛选到6个与之互作的蛋白,GmLEA是筛选到的互作蛋白之一。LEA蛋白的积累与抵抗逆境胁迫之间存在正相关的关系,普遍认为其在应对外界胁迫中发挥着重要作用[14-15]。研究表明,LEA蛋白具有广泛的功能,对ABA、低温、盐害与干旱等非生物胁迫都具有一定的抵抗作用,在保护酶活性与膜结构、结合金属离子、清除活性氧自由基等方面均发挥作用[16-17]。【本研究切入点】据报道,多种蛋白质已被证明与CDPK蛋白相互作用,并在植物生长和发育中发挥重要作用,但关于LEA蛋白与CDPK的相互作用鲜有报道,王爽[1]通过酵母双杂筛选,初步筛选到GmLEA是GmCDPKSK5的互作蛋白之一。【拟解决的关键问题】本研究克隆大豆,并对其编码的蛋白进行亚细胞定位;分析GmLEA与GmCDPKSK5的互作情况;研究其在高温高湿胁迫下的表达水平及功能。以期为进一步深入研究在参与大豆种子活力形成和响应非生物胁迫等方面奠定基础,从而为探明田间高温高湿胁迫下春大豆种子活力形成的机制奠定基础。
1 材料与方法
1.1 试验材料
供试大豆材料为南京农业大学作物遗传与种植创新国家重点实验室麻浩教授课题组保存的抗种子田间劣变春大豆品种湘豆3号和不抗品种宁镇1号。试验所需大肠杆菌DH5α感受态细胞购自南京博尔迪生物技术公司;GV3101拟南芥遗传转化菌株购自南京百思禾生物科技有限公司;pMD19-T载体购自TaKaRa公司;植物瞬时表达载体pA7-GFP、双分子荧光互补(BiFC)载体pSAT1-nEYFP-C1与pSAT1-cEYFP- C1-B、酵母双杂交试验载体pPR3N-NubG-X、pOST1- NubG与pBT3-SUC以及植物表达载体pBI121-GUS均由麻浩教授课题组保存。
1.2 总DNA和RNA的提取及cDNA的合成
以2周苗龄的大豆幼叶为材料,按照CTAB法提取DNA,参照杭州宝赛新型植物总RNA提取试剂盒说明书提取大豆各种材料的RNA,采用TaKaRa公司的RTase M-MLV试剂盒合成第一链cDNA,-20℃保存备用。
1.3 大豆GmLEA的分离与进化树分析
研究所用的引物以NCBI(https://www.ncbi.nlm. nih.gov/)公布的(Genbank:NM_001251272.1)的CDS序列及DNA序列作为模板,使用Primer Premier5.0软件设计引物(电子附表1),对湘豆3号和宁镇1号的DNA与cDNA模板进行PCR扩增。PCR体系与反应程序参照王爽[1]的研究。PCR产物经检测后回收、连接,并转化。挑取阳性克隆送上海铂尚生物技术有限公司测序,将测序正确的阳性克隆命名为T-GmLEA。通过NCBI的BLASTN分别对nr数据库和EST数据库同源性搜索,BLASTX对nr数据库进行相似性搜索;使用MEGA 6.0和DNAMAN多重比对蛋白质序列;采用MEGA 6.0的N-J算法构建进化树, BootStrap值为1 000。
1.4 酵母双杂交试验
pBT3-SUC-GmCDPKSK5与pPR3N-GmLEA载体由麻浩教授课题组保存。将pBT3-SUC-GmCDPKSK5与pPR3N-GmLEA共转入酵母菌株NMY32中,四缺(SD/-Trp-Leu-His-Ade)培养基30℃培养筛选阳性克隆。pNubG-Fe65与pTSU2-APP质粒组合为阳性对照,pPR3N与pTSU2-APP质粒组合为阴性对照,pPR3N与pBT3-SUC-GmCDPKSK5质粒组合为自激活对照,pPR3N-GmLEA与pBT3-SUC为自激活对照。使用HTX高通量β-半乳糖苷酶试剂盒(Dualsystems Biotech,Swiss)测定β-半乳糖苷酶活性。
1.5 GmLEA蛋白的亚细胞定位
通过设计的ORF引物,利用限制性内切酶Ⅰ和Ⅰ对pA7空载和目的片段进行酶切,并通过酶切重组的方法将目的基因构建到pA7-GFP表达载体上,获得pA7-GmLEA-GFP重组载体。取叶脉较少的烟草叶片并剪去主脉,叶片背面朝上平贴于MS培养基,25℃暗培养。使用PDS-1000/He基因枪(Bio-Rad)将重组质粒转化到烟草叶片细胞中,25℃暗培养16 h,激光共聚焦显微镜下观察GFP蛋白表达信号。
1.6 双分子荧光互补试验
通过对和的ORF进行引物的设计,利用限制性内切酶Ⅰ和HⅠ对nE-YFP和cE-YFP 2个空载和目的片段进行酶切,并通过酶切重组的方法将目的基因分别构建到nE-YFP和cE-YFP 2个载体上,共得到nE-GmCDPKSK5和cE-GmLEA 2个重组载体。采用上述1.5相同的方法将重组质粒转化到烟草叶片细胞中,25℃暗培养16 h,激光共聚焦显微镜下观察YFP蛋白表达信号。
1.7 GmLEA的表达分析
将大豆种子播种于塑料花盆中,每盆约3—5粒种子;并将其置于正常条件下生长。当大豆生长至R6与R7之间时,置于人工气候培养箱中,模拟田间高温高湿环境条件进行处理,正常环境中生长植株为对照。大豆植株正常生长条件与处理条件见表1。在处理期间的0、24、48、96和168 h收集来自处理和对照植物中部的种子。
当大豆生长至一节期(V1)时,采集大豆植株的子叶、根、茎及叶;花取自其盛花期(R2);幼荚和幼嫩的豆粒取自盛荚期(R4);成熟的荚和成熟的豆粒取自完熟期(R8),进行组织特异性表达分析。
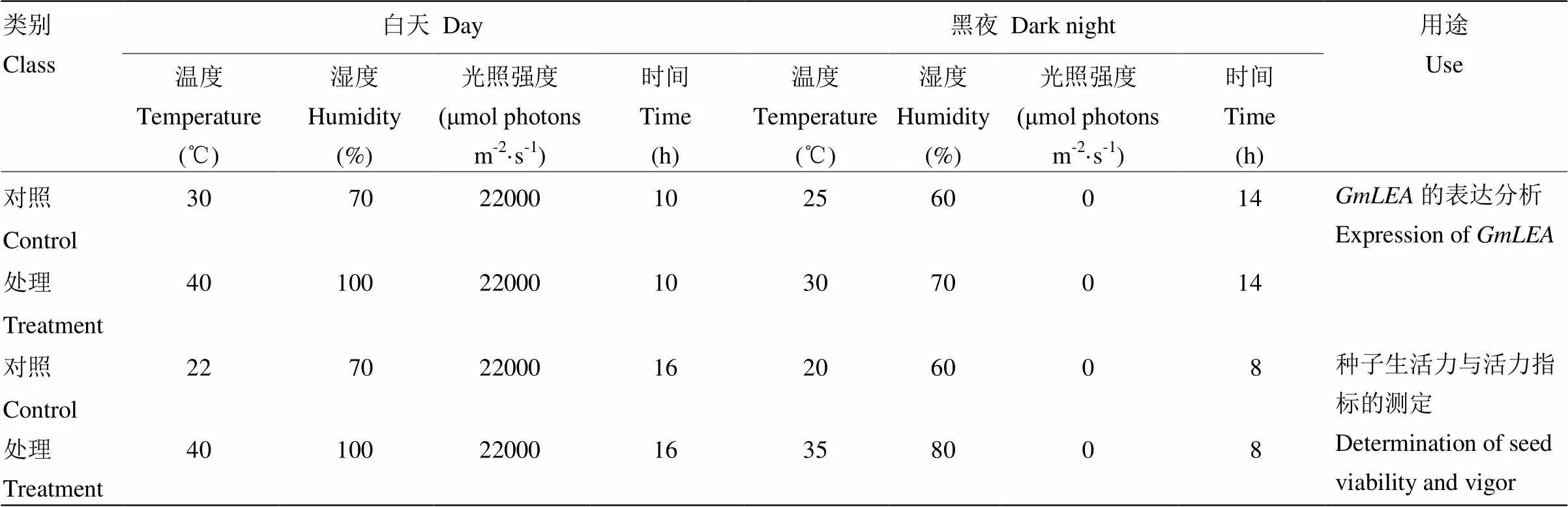
表1 植物生长条件
当大豆植株处于盛花期(R2)时,选取植株上部的花在花柄处挂牌并标注日期,从花后15 d开始到花后60 d结束,每隔5 d取一次样,收集整个荚,进行种子发育时期分析。
所有样品取样后立即于液氮中冷冻,-80℃保存备用。参照WANG等[18]方进行法qRT-PCR分析,设置3次重复。
1.8 拟南芥转化及转基因纯合植株的获得
将的ORF区域构建到pBI121-GUS 植物过表达载体上,该载体主要包括Kan抗性基因、CaMV35S启动子和。通过农杆菌介导法转化野生型拟南芥(WT)。经筛选鉴定得到3个过表达阳性株系LEA-1、LEA-2和LEA-3,分别收获纯合的T3代过表达拟南芥种子进行功能分析。
1.9 过表达拟南芥种子生活力与活力指标的测定
按表1将WT、pBI121-GUS过表达和过表达植株荚黄熟期的植株处理2 d,同时设置对照。
待种子收获后,处理组和对照组各株系拟南芥种子各取100粒,进行TTC染色,种胚全部或大部分被染成红色的为具有生活力的种子,反之为死种子,观察种子生活力。另外,分别取100粒种子点播于MS培养基上,从播种后的第1天至第5天,每半天记录一次种子的发芽数,称取第5天拟南芥幼苗重量,统计种子发芽率、发芽势、发芽指数、活力指数及平均发芽天数。
1.10 数据处理
使用软件DPS进行方差(ANOVA)分析,检测差异显著性。
2 结果
2.1 GmLEA的分离与进化树分析
以湘豆3号和宁镇1号的cDNA为模板进行PCR扩增,在1 377 bp处有与预期大小相同的特异性条带,经测序发现该基因的cDNA序列在2个品种间没有差异。以湘豆3号和宁镇1号的DNA为模板,经PCR扩增得到长度为1 879 bp的DNA序列。进化树分析结果显示,按科分为4大类,分别为豆科(Leguminosae)、蝶形花科(Papilionaceae)、葫芦科(Cucurbitaceae)和小杆科(Rhabditidae),GmLEA与豆科的LEA蛋白亲缘关系比较近(图1)。
2.2 GmLEA与GmCDPKSK5的酵母双杂交验证
由图2可知,全部质粒组合均在SD-TL(SD/-Trp- Leu)培养基上正常生长,说明全部质粒组合均成功转入酵母细胞,只有pNubG-Fe65与pTSU2- APP和pPR3N-GmLEA与pBT3SUC-GmCDPKSK5 2个质粒组合能够正常生长在SD-TLHA(SD/-Trp-Leu- His-Ade)培养基上且能被X-α-Gal染成蓝色,而其他3个质粒组合的酵母细胞不能在SD-TLHA培养基上生长,且pPR3N-GmLEA与pBT3SUC-GmCDPKSK5质粒组合的β-半乳糖苷酶活性值显著高于3个质粒组合,表明GmLEA与GmCDPKSK5在酵母体内存在特异性互作。
2.3 GmLEA的亚细胞定位
采用基因枪介导法将融合表达载体共转入烟草叶片细胞中,在激光共聚焦显微镜下观察荧光位置。发现pA7-GmLEA-GFP融合蛋白在烟草叶片细胞细胞膜上表达且与膜Marker蛋白pm-ck CD3-1001信号重合,而pA7-GFP空载分布在烟草叶片细胞的整个细胞中(图3)。结果表明,GmLEA定位于烟草叶片细胞膜上。

Gm:大豆Glycine max,NP001238201.1;Gs:野生大豆Glycine max,KHN03228.1;Cc:木豆Cajanus cajan,KYP57744.1;Va:红豆Vigna angularis,XP017413051.1;Pv:菜豆Phaseolus vulgaris,XP007154470.1;Ts:地三叶草Trifolium subterraneum,GAU16739.1;Mt:蒺藜苜蓿Medicago truncatula,XP003609877.1;Ms:紫花苜蓿Medicago sativa,ACD14089.1;La:狭叶羽扇豆Lupinus angustifolius,OIV95293.1;Cm:甜瓜Cucumis melo,ADN34043.1;Aa:小花南芥Arabis alpina,CCO06495.1;Ce:秀丽隐杆线虫Caenorhabditis elegans,NP001256172.1;蝶形花科 Papilionaceae;豆科Leguminous;葫芦科Cucurbitaceae;小杆科Rhabditidae

图2 GmLEA与GmCDPKSK5蛋白的酵母双杂交验证
2.4 BiFC验证GmLEA与GmCDPKSK5互作
采用基因枪介导法将融合表达载体共转入烟草叶片细胞中,在激光共聚焦显微镜下观察荧光位置。将nEYFP-GmCDPKSK5与cEYFP-GmLEA质粒共转入烟草叶片细胞中,在烟草叶片细胞的细胞膜上可观察到有黄色荧光分布,并且与膜Marker蛋白pm-ck CD3-1001信号重合,而nEYFP与cEYFP-GmLEA、nEYFP-GmCDPKSK5与cEYFP和nEYFP与cEYFP质粒组合共转入烟草叶片中没有观察到黄色荧光(图4)。说明GmLEA与GmCDPKSK5蛋白主要在烟草叶片细胞的细胞膜上发生特异性互作。
2.5 GmLEA的组织表达分析
为了解在大豆不同组织器官的表达特性,通过qRT-PCR分别检测了在湘豆3号和宁镇1号不同组织器官中的表达情况。主要在2个品种发育中的种子及成熟的种子中表达,在荚中有少量表达,在根、茎、叶、花和子叶中几乎无表达(图5)。

图3 GmLEA在烟草叶肉细胞中的亚细胞定位
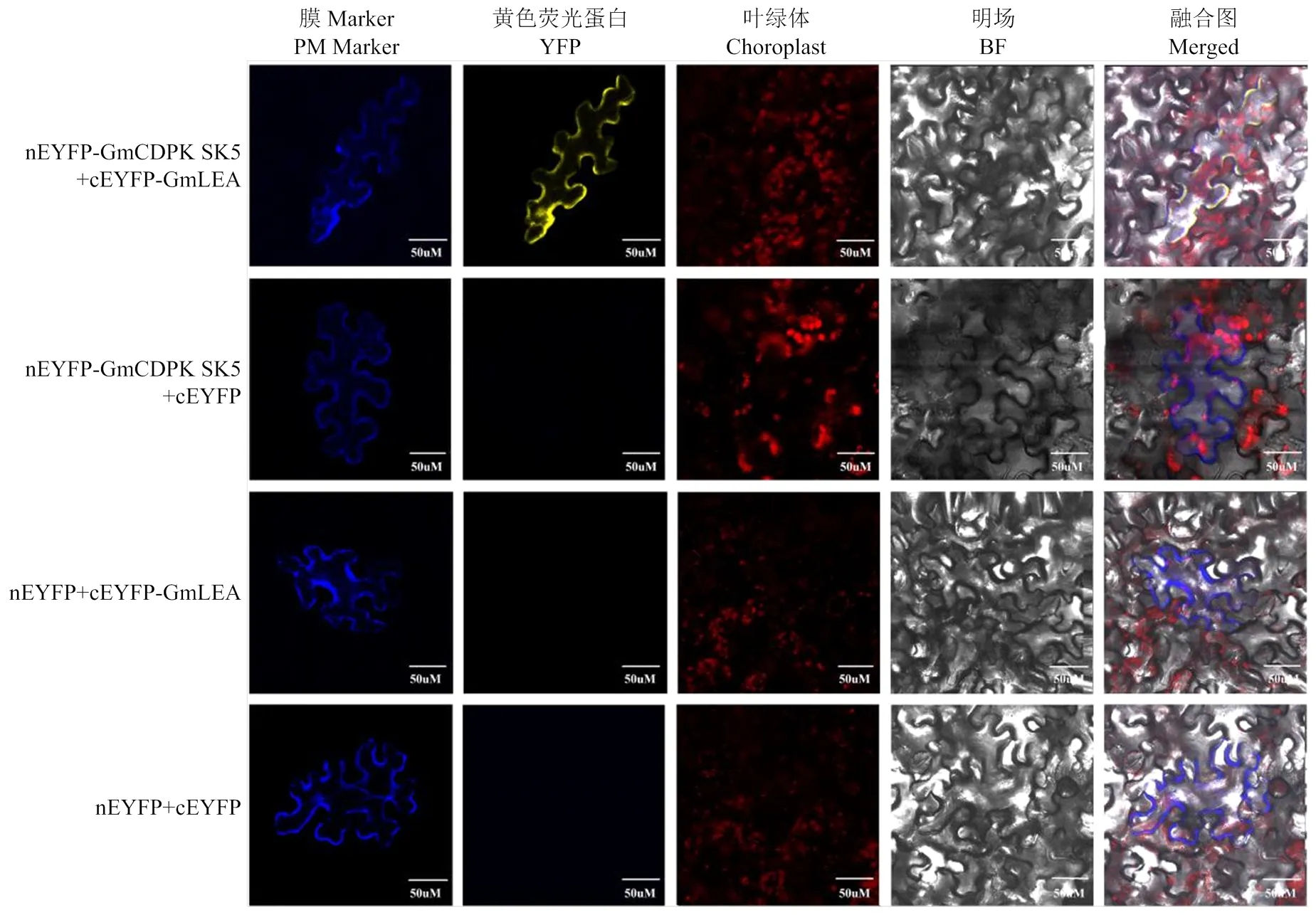
图4 GmLEA与GmCDPKSK5蛋白在烟草叶片细胞中的BiFC验证
2.6 大豆种子发育过程中GmLEA的表达特性
通过组织表达特性分析,发现在湘 豆2号和宁镇1号种子中的表达量很高,进一步分析了该基因在2个品种种子发育过程中的表达水平。结果表明,在湘豆3号种子发育过程中表达量先上升后下降,并且在开花后50 d达到 最大值。在宁镇1号种子发育过程中表达量呈上升的趋势,并且在开花后60 d达到最大值(图6)。结果表明,可能参与了种子发育过程。
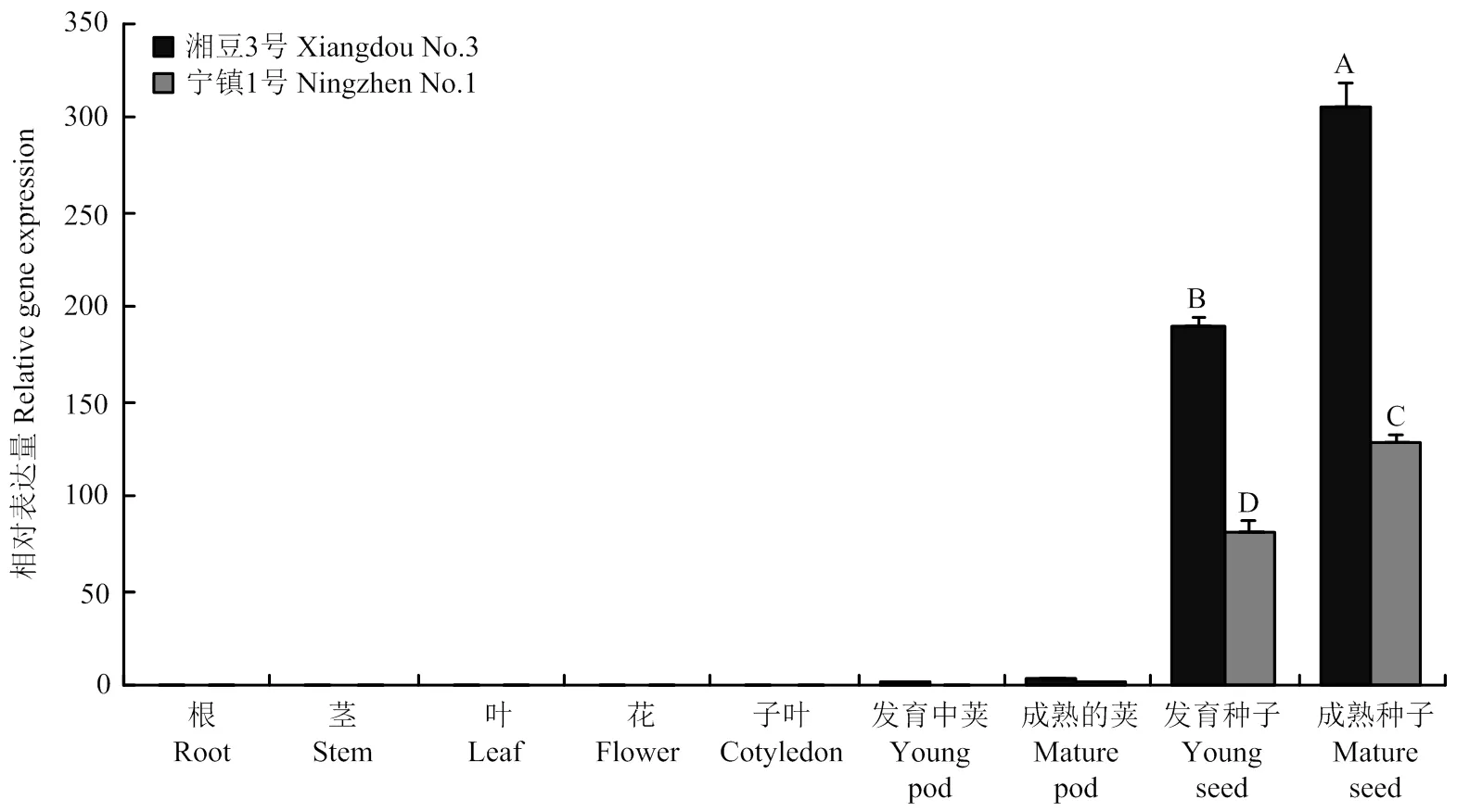
不同大写字母表示在P<0.01水平差异显著
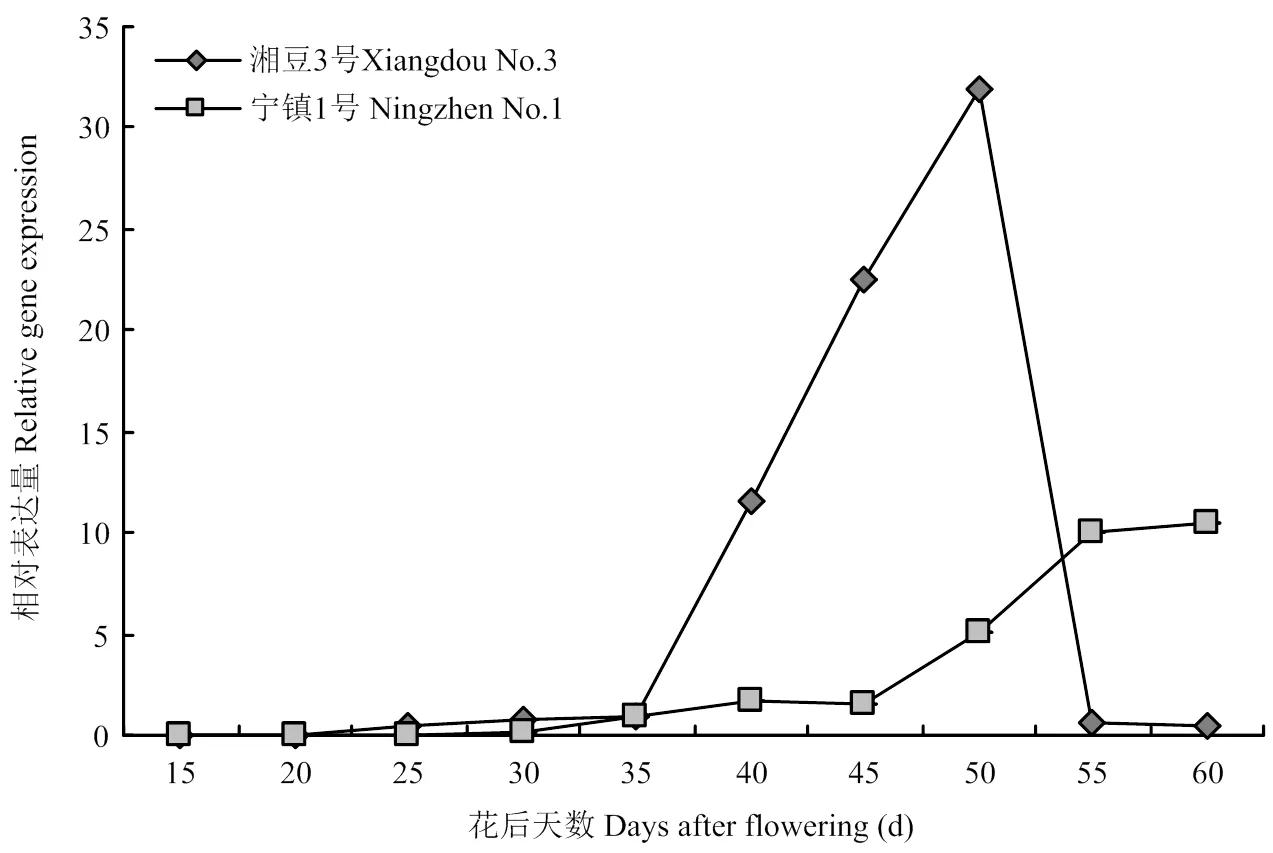
图6 大豆种子发育过程中GmLEA的相对表达量
2.7 高温高湿胁迫下GmLEA的表达特性
大豆植株在种子生理成熟期经高温高湿胁迫处理后,在湘豆3号种子中,仅在96 h下调表达,在其余时间点均上调表达,且在24、48、96和168 h差异达极显著(<0.01)水平;在宁镇1号种子中,的表达量仅在24 h低于对照组,在其余时间点表达量均高于对照组,且在48 h和96 h差异达极显著(<0.01)水平(图7)。结果表明,响应高温高湿胁迫,并推测其可能参与春大豆种子田间劣变抗性过程。
2.8 高温高湿胁迫下GmLEA过表达拟南芥种子的活力分析
通过对种子进行高温高湿胁迫,在正常生长条件下,所有植株的种子在第5天发芽率均能达到90%左右,且都能正常生长为幼苗;而经高温高湿胁迫后,各个株系种子的发芽率均有所下降,但过表达植株下降的幅度最小,状态要好于其他2个株系(图8-A和图8-B)。TTC染色结果与种子萌发的结果基本一致(图8-C)。表2显示高温高湿胁迫后,过表达植株、pBI121-GUS过表达植株与WT植株的发芽势和发芽指数均显著(<0.01)低于对照组,但是过表达植株优于(<0.01)其他2个株系;而WT、pBI121-GUS过表达株系和过表达株系种子的平均发芽天数比对照组均有所提高,过表达植株种子的平均发芽天数低于WT、pBI121-GUS过表达植株。结果表明,高温高湿胁迫后过表达株系的种子活力显著高于野生型。
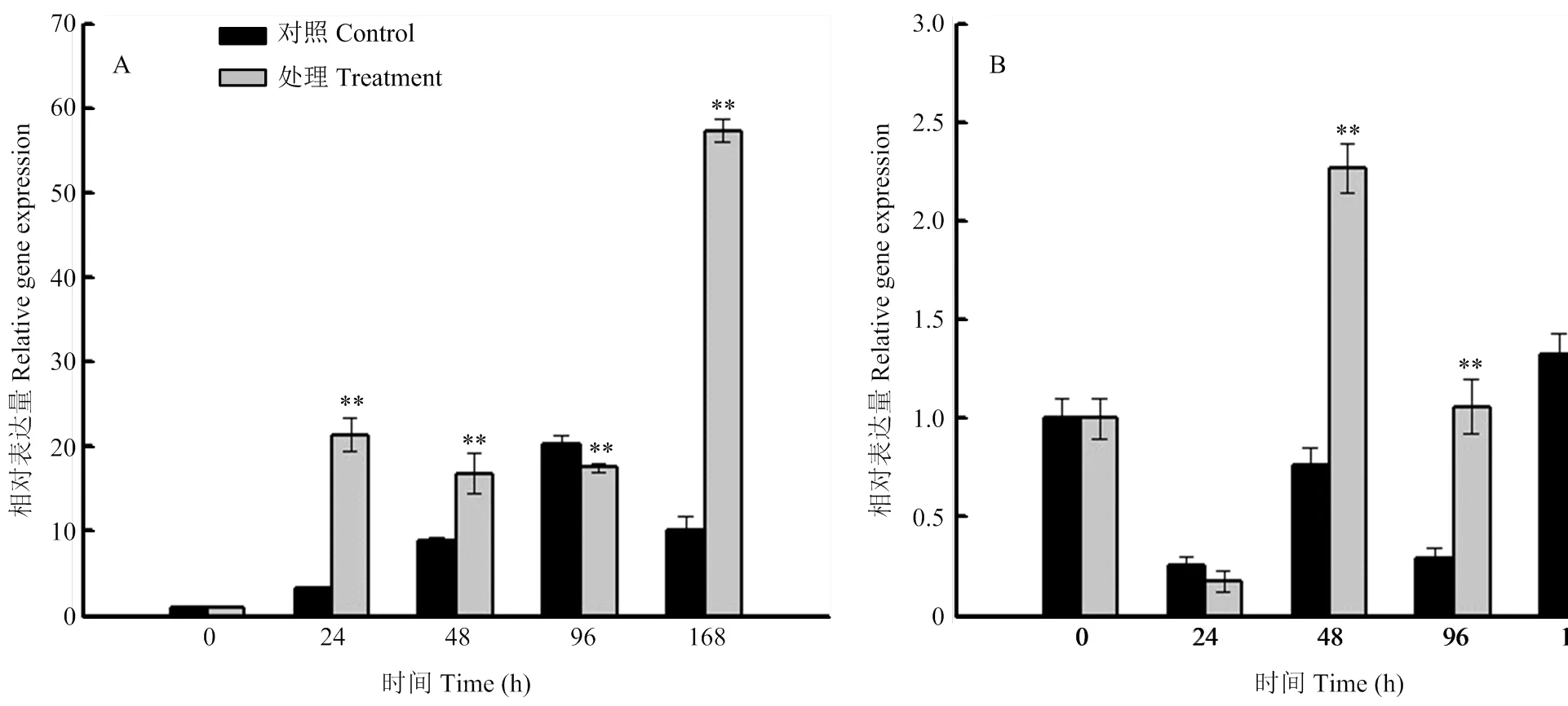
A:湘豆3号;B:宁镇1号。**表示差异极显著(P<0.01)
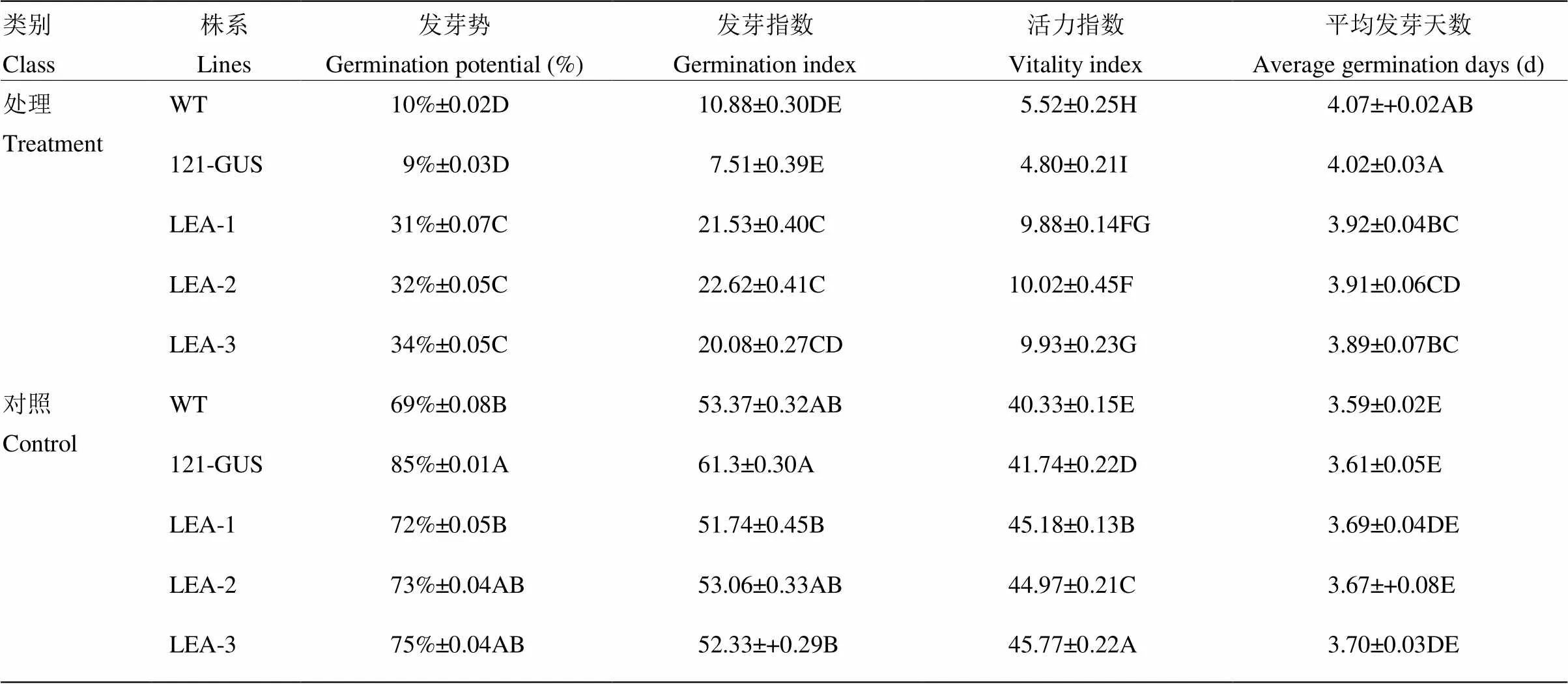
表2 高温高湿处理对拟南芥种子萌发特性的影响
同列不同大写字母表示在<0.01水平差异显著
Different capital letters in the same column indicate significant difference at<0.01 level
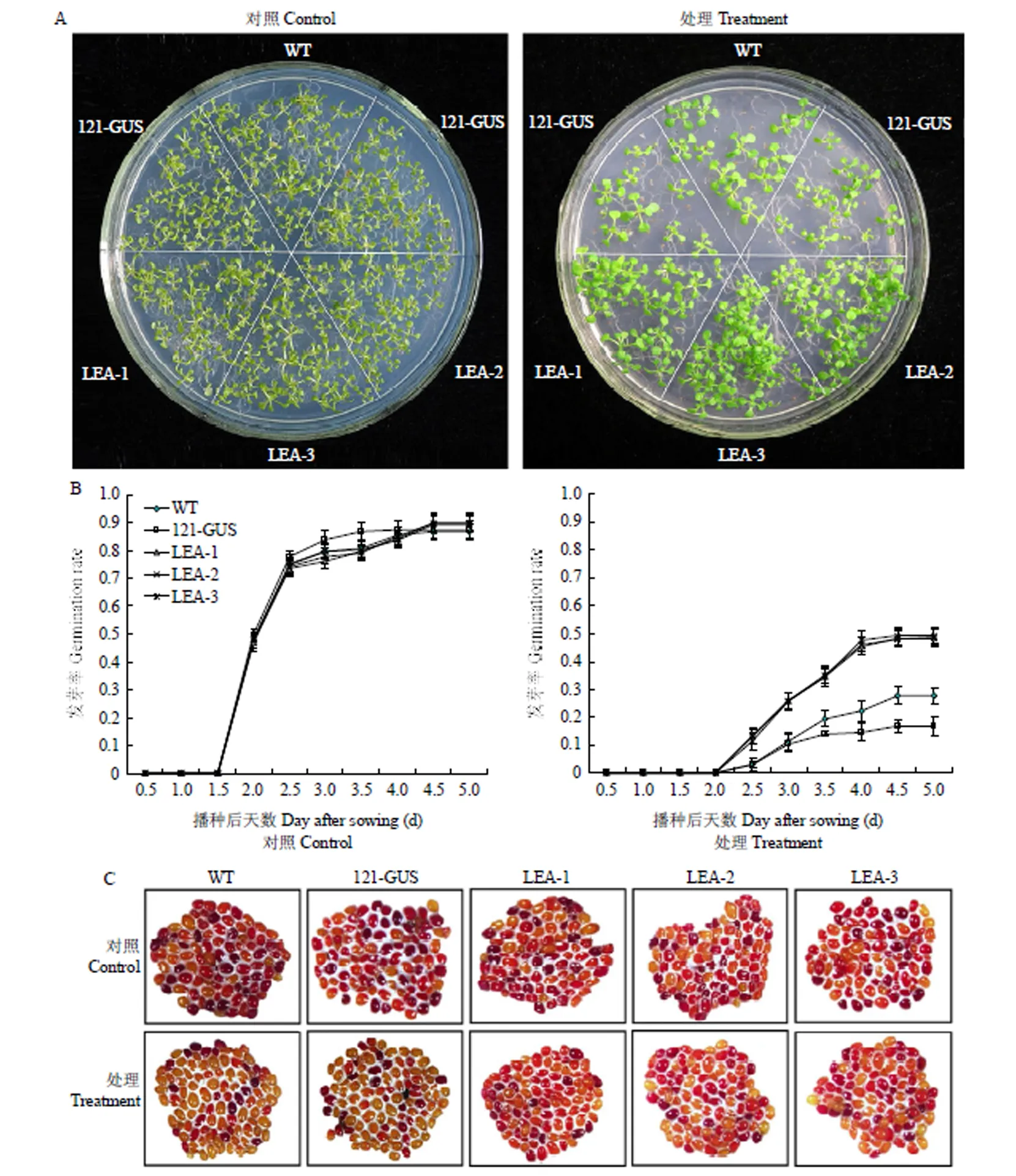
A:播种7 d后的经高温高湿处理2 d收获的野生型和转基因株系幼苗;B:对照条件下与经高温高湿处理的种子发芽率;C:经高温高湿处理的种子TTC染色,bar=2 mm
3 讨论
3.1 GmLEA的表达分析
LEA蛋白是一类在生物体内广泛存在的蛋白质,它参与植物抵抗胁迫和渗透调节等过程,在植物的不同器官中都有LEA蛋白的广泛分布,不仅在高等植物种子中分布,花粉管和营养组织中也有分布,主要在种子胚胎发育后期积累[19-21]。有研究表明LEA在种子发育过程中逐渐积累[22]。本研究中组织特异性表达结果显示在种子中大量表达,由此推测可能参与种子的发育;但值得注意的是在宁镇1号种子发育该基因表达低于湘豆3号种子,通过2个品种中该基因的序列比对,发现其在2个品种间没有差异,因此,推测该基因在2个品种中差异表达可能是由于该基因在不同大豆品种的启动子序列或者上游调控基因的差异造成的,关于造成该基因转录模式差异的具体原因尚不明确,还需进一步研究中。
3.2 GmLEA参与高温高湿胁迫反应
有研究表明,在干旱胁迫下,植物体内的LEA蛋白的构象会发生变化,形成α螺旋结构,可以和膜脂结合从而阻止水分的进一步丧失[23]。Liu等[24]研究发现蜡梅(Link)中过表达能够在一定程度上加强过表达拟南芥对低温胁迫的抵抗能力。大豆中的2个LEA蛋白,即GmPM1和GmPM9都可以通过C端的组氨酸与Cu2+和Fe3+结合,以清除羟基自由基,减少金属离子的毒害[25]。柑橘中的脱水素Cucor19能够清除羟基自由基和过氧化氢,一定程度上减轻活性氧自由基对植物造成的伤害[26]。目前关于LEA蛋白的功能已经有许多研究,但是该类蛋白在高温高湿方面的研究鲜有报道。本研究发现在转录水平上响应高温高湿胁迫。此外,高温高湿胁迫处理后收获的过表达植株种子的发芽率、发芽势、发芽指数、活力指数均优于WT和pBI121-GUS过表达植株,且过表达植株种子的平均发芽天数明显缩短。因此可以推测高温高湿胁迫后过表达可以提高拟南芥种子的活力。
3.3 GmLEA与GmCDPKSK5相互作用
据报道,许多蛋白质已被证明与CDPK蛋白相互作用,并在植物生长和发育中发挥重要作用。AtCPK10与HSP1相互作用,在调节由ABA和钙离子介导的气孔运动中发挥重要作用[27]。麻浩老师课题组前期研究发现GmCDPKSK5与高温高湿胁迫下春大豆种子活力的形成相关,以GmCDPKSK5为诱饵构建高温高湿胁迫下抗种子田间劣变春大豆种子膜蛋白酵母双杂交文库,在细胞膜上初步筛选到6个与之互作的蛋白,分别为1个LEA蛋白、1个翻译控制肿瘤蛋白、1个种子成熟蛋白、1个微粒体油酸脱氢酶以及2个未知功能蛋白[28]。进一步研究发现,GmCDPKSK5与GmTCTP相互作用并在植物响应高温高湿胁迫中发挥重要作用[18]。在本研究中,通过酵母双杂交试验验证了GmLEA与GmCDPKSK5在酵母体内存在特异性互作;又通过BiFC试验对GmLEA与GmCDPKSK5的互作进行了进一步的验证,结果发现二者在烟草叶片细胞的细胞膜上发生特异性互作。
有趣的是,结合实验室前期对的研究结果[1],发现高温高湿胁迫后无论是还是都能够响应高温高湿的胁迫,而且表达趋势基本上一致。这种现象一种可能的解释就是GmLEA与GmCDPKSK5相互作用共同响应大豆种子发育过程中的高温高湿胁迫。
基于以上结果,推测GmLEA和GmCDPKSK5相互作用共同对高温高湿胁迫应激反应,但是GmLEA和GmCDPKSK5如何参与响应高温高湿胁迫的机制需要进一步研究。
4 结论
从大豆中扩增获得,其cDNA全长1 377 bp,DNA序列全长1 879 bp,由2个外显子和1个内含子组成。GmLEA蛋白定位于烟草叶片细胞膜上,与GmCDPKSK5在细胞膜上特异性互作。具有组织特异性表达,在大豆种子中表达量最高;过表达能够提高拟南芥种子的活力。
[1] 王爽. 高温高湿下大豆钙依赖蛋白激酶基因在种子活力中的功能分析[D]. 南京: 南京农业大学, 2016.
WANG S. Function analysis of soybean [(L.) Merr.]genes on seed vigor under high temperature and humidity[D]. Nanjing: Nanjing Agricultural University, 2016. (in Chinese)
[2] 刘毓侠, 王铁固. 种子活力研究进展. 玉米科学, 2012, 20(4): 90-94.
LIU Y X, WANG T G. Research progress on seed vigor., 2012, 20(4): 90-94. (in Chinese)
[3] 唐桂香, 汪自强. 春播和秋播对南方春大豆种子活力的影响. 作物学报, 1998, 24(2): 243-247.
TANG G X, WANG Z Q. Effects of spring and autumn sowing on seed vigor of spring soybean in South China., 1998, 24(2): 243-247. (in Chinese)
[4] 赵欣欣, 宋丽荣, 权薇竹. 高温高湿老化处理对不同豆类种子活力及生长能力的影响. 作物杂志, 2017(5): 168-172.
ZHAO X X, SONG L R, QUAN W Z. Effects of high temperature and high humidity aging on the vigor and growth capability of different beans., 2017(5): 168-172. (in Chinese)
[5] 王芳, 王丽群, 田鑫, 顾卫红, 麻浩. 中国南方春大豆收获前后种子劣变的抗性研究. 中国农业科学, 2007, 40(11): 2637-2647.
Wang F, Wang L Q, Tian X, Gu W H, MA H. Pre-harvest and post-harvest seed deterioration resistance of spring soybean germplasm in south China., 2007, 40(11): 2637-2647. (in Chinese)
[6] 寿惠霞, 宋文坚, 张刚, 王文杰. 栽培与野生大豆资源抗种子劣变性差异的研究. 大豆科学, 1998(2): 59-64.
SHOU H X, SONG W J, ZHANG G, WANG W J. Study on the difference of anti-seed degradation of cultivated and wild soybean resources., 1998(2): 59-64. (in Chinese)
[7] 寿惠霞, 宋文坚. 大豆种子抗劣变性的鉴定方法研究. 种子, 1999, 101(2): 3-5.
SHOU W X, SONG W J. Study on identification method of soybean seed degradation resistance., 1999, 101(2): 3-5. (in Chinese)
[8] 唐善德. 大豆种子劣变研究概况. 种子, 1992, 59(3): 43-45.
TANG S D. Research progress of soybean seed deterioration., 1992, 59(3): 43-45. (in Chinese)
[9] Egli D B, TeKrony D M, Heitholt J J, RUPE J. Air temperature during seed filling and soybean seed germination and vigor., 2005, 45(4): 1329-1335.
[10] Saha R R, Sultana W. Influence of seed ageing on growth and yield of soybean., 2008, 37(1): 21-26.
[11] 李灵芝, 王丽娜, 刘志强, 耿香利, 张京慧. 贮藏时间对大豆种子活力和若干性状的影响. 中国油料作物学报, 2003, 25(2): 25-28.
LI L Z, WANG L N, LIU Z Q, GENG X L, ZHANG J H. Effects of storage time on seed vigor and some characters of soybean., 2003, 25(2): 25-28. (in Chinese)
[12] 唐善德, 黄敏珍, 成金莲. 春大豆种子劣变的研究. 大豆科学, 1994, 13(3): 230-236.
TANG S D, HUANG M Z, CHENG J L. Study on the deterioration of spring soybean seeds., 1994, 13(3): 230-236. (in Chinese)
[13] 宋利茹, 王爽, 牛娟, 马洪雨, 舒英杰, 杨艳, 顾卫红, 麻浩. 春大豆种子田间劣变性和劣变抗性的差异蛋白质组学研究. 中国农业科学, 2015, 48(1): 23-32.
SONG L R, WANG S, NIU J, MA H Y, SHU Y J, YANG Y, GU W H, MA H. Differential proteomics study on degeneration and deterioration resistance of spring soybean seeds., 2015, 48(1): 23-32. (in Chinese)
[14] BATTAGLIA M, COVARRUBIAS A A. Late embryogenesis abundant (LEA) proteins in legumes., 2013, 4: 190.
[15] OLVERA-CARRILLO Y, LUIS REYES J, COVARRUBIAS A A. Late embryogenesis abundant proteins: versatile players in the plant adaptation to water limiting environments., 2011, 6(4): 586-589.
[16] 王艳蓉, 张治国, 吴金霞. LEA蛋白及其在植物抗逆改良中的应用. 生物技术通报, 2015, 3: 1-9.
WANG Y R, ZHANG Z G, WU J X. LEA protein and its application in plant resistance improvement., 2015, 3: 1-9. (in Chinese)
[17] 刘露露, 陈雷, 张春艳, 石瑞杰, 任江萍, 孟凡荣, 尹钧, 李永春. 两个小麦基因的特征及其对非生物胁迫的响应. 中国农业科学, 2014, 47(19): 3736-3745.
LIU L L, CHEN L, ZHANG C Y, SHI R J, REN J P, MENG F R, YIN J, LI Y C. Characteristics of two wheatgenes and their responses to abiotic stress., 2014, 47(19): 3736-3745. (in Chinese)
[18] WANG S, TAO Y, ZHOU Y L, NIU J, SHU Y J, YU X W, LIU S S, CHEN M, GU W H, MA H. Translationally controlled tumor protein GmTCTP interacts with GmCDPKSK5 in response to high temperature and humidity stress during soybean seed development., 2017, 82(1): 187-200.
[19] SWIRE-CLARK G A, MARCOTTE W R. The wheat LEA protein Em functions as an osmoprotective molecule in., 1999, 39(1): 117-128.
[20] 张林生, 赵文明. LEA蛋白与植物的抗旱性. 植物生理学通讯, 2003, 39(1): 61-66.
ZHANG L S, ZHAO W M. LEA protein and drought resistance of plants., 2003, 39(1): 61-66. (in Chinese)
[21] 李乐, 许红亮, 杨兴露. 大豆基因家族全基因组鉴定、分类和表达. 中国农业科学, 2011, 44(19): 3945-3954.
LI L, XU H L, YANG X L. Whole genome identification, classification and expression of soybeangene family., 2011, 44(19): 3945-3954. (in Chinese)
[22] BATTAGLIA M, OLVERA-CARRILLO Y, GARCIARRUBIO A, CAMPOS F, COVARRUBIAS A A. The enigmatic LEA proteins and other hydrophilins., 2008, 148(1): 6-24.
[23] 李翔. 植物基因家族的分子进化研究和一拟南芥非典型基因功能的初步分析[D]. 南京: 江苏大学, 2016.
LI X. Molecular evolutionary research of the plantgene family and preliminary functional analysis of an atypicalgene in[D]. Nanjing: Jiangsu University, 2016. (in Chinese)
[24] LIU Y, XIE L, LIANG X, ZHANG S H., the late embryogenesis abundant protein gene from, possesses low temperature and osmotic resistances in prokaryote and eukaryotes., 2015, 16(11): 26978-26990.
[25] LIU G, XU H, ZHANG L, ZHENG Y. Fe binding properties of two soybean (L.) LEA4 proteins associated with antioxidant activity., 2011, 52(6): 994-1002.
[26] HARA M, FUJINAGA M, KUBOI T. Radical scavenging activity and oxidative modification of citrus dehydrin., 2004, 42(7/8): 657-662.
[27] ZOU J J, WEI F J, WANG C, WU J J, LIU W X, WU W H.calcium-dependent protein kinase CPK10 functions in abscisic acid- and Ca2+-mediated stomatal regulation in response to drought stress., 2010, 154(3): 1232-1243.
[28] 麻浩, 王爽, 周亚丽. 植物中钙依赖蛋白激酶的研究进展. 南京农业大学学报, 2017, 40(4): 565-572.
MA H, WANG S, ZHOU Y L. Research progress of calcium- dependent protein kinases in plants., 2017, 40(4): 565-572. (in Chinese)
Isolation and Functional analysis of soybeanin seed vigor
ZHOU YaLi, ZHU YaJing, ZHAO FeiYun, WANG Shuang, LIU SuShuang, GUO LingKai, ZHAO HaiHong, MA Hao
(National Key Laboratory of Crop Genetics and Germplasm Enhancement, Nanjing Agricultural University, Nanjing 210095)
【Objective】Soybean((L.) Merr.) seed generally form vitality from their physiological maturity period(R6 or R7 period). However, the seed is susceptible to high temperature and humidity (HTH) stress during this period. This will lead to a decline in seed vigor. The results will lay a foundation for further studying the mechanism of seed vigor formation under abiotic stress. 【Method】Primer Premier 5.0 was used to design primers, and the full length cDNA sequence ofwas isolated by using the cDNA of leaves of cv. Ningzhen No.1 and Xiangdou No.3 as template. The homologous amino acid sequence of GmLEA was searched by BLAST at NCBI, the protein sequences were multiple aligned using MEGA 6.0 and DNAMAN, and the phylogenetic tree was constructed using the N-J algorithm of MEGA 6.0. Yeast two-hybrid experiments were performed to verify the interaction of GmLEA and GmCDPKSK5 in yeast. A subcellular localization and bimolecular fluorescent complementation (BiFC) vector were constructed, The interaction between GmLEA and GmCDPKSK5 in tobacco leaf cells and the subcellular localization of the encoded protein were analyzed by gene-gun-mediated transformation of tobacco leaves. In addition, the tissue-specific expression ofgene and the expression pattern ofgene under HTH were analyzed by qRT-PCR, respectively. The pBI121 fusion expression vector was constructed and three homozygous overexpressedlines were obtained through Agrobacterium- mediated method, and three independent homozygous T3transgenic lines were used for analysis. 【Result】The cDNA sequence ofgene contains a 1 377 bp open reading frame (ORF), and the subcellular localization result showed that the encoded protein was located on the cell membrane. The results of yeast two-hybrid rotation verification showed that GmLEA could interact with GmCDPKSK5 in yeast. In addition, bimolecular fluorescence complementation (BiFC) experiment showed that GmLEA could interact with GmCDPKSK5 on cell membrane of tobacco leaf cells. The results of tissue-specific analysis showed thatgene had higher expression levels in developing and mature seeds of both cultivars. The expression level ofwas increased first and then decreased during the development of cv. Xiangdou No. 3 seeds. During the process of seed development of cv. Ningzhen No.1, the level ofexpression was on the rise and reached the highest at 60 days after flowering. After high temperature and high humidity (HTH) stress, the expression ofwas decreased at 96 h in cv. Xiangdou No. 3, and the other time points were increased. However, the expression was decreased at 24 h in cv. Ningzhen No.1. The germination potential, germination rate and seed vigor ofgene in transgenicthaliana were significantly (<0.01) higher than those of the wild type plants under HTH stress. 【Conclusion】Theis involved in the formation of seed vigor under HTH stress,and has specific interaction with GmCDPKSK5, It is speculated that they may participate in the formation of seed vigor under HTH stress.
soybean;;; high temperature and high humidity stress; seed vigor
10.3864/j.issn.0578-1752.2018.23.001
2018-06-22;
2018-07-29
国家自然科学基金(31671772,31371711)、科技部国家重点研发计划(2018YFD0100905)
周亚丽,Tel:15062270213;E-mail:807834731@qq.com。
麻浩,Tel:025-84395324;E-mail:Lq-ncsi@njau.edu.cn
(责任编辑 李莉)
