Cd胁迫水培试验下水稻糙米Cd累积的关键生育时期
2018-12-11王倩倩贾润语李虹呈周航杨文弢辜娇峰彭佩钦廖柏寒
王倩倩,贾润语,李虹呈,周航,杨文弢,辜娇峰,彭佩钦,廖柏寒
Cd胁迫水培试验下水稻糙米Cd累积的关键生育时期
王倩倩,贾润语,李虹呈,周航,杨文弢,辜娇峰,彭佩钦,廖柏寒
(中南林业科技大学环境科学与工程学院/稻米品质安全控制湖南省工程实验室,长沙 410004)
【目的】探究水稻不同生育时期Cd胁迫对水稻成熟期糙米Cd累积的影响,明确糙米Cd累积关键生育时期,以期适时采取阻控措施降低糙米Cd含量,为水稻安全生产提供理论参考。【方法】以水稻品种湘晚籼13号(晚稻品种)为研究对象,采用水培试验,共设计7个添加外源Cd处理,即CG(全生育时期Cd胁迫,102 d)、TS(分蘖期Cd胁迫,15 d)、JS(拔节期Cd胁迫,15 d)、BS(孕穗期Cd胁迫,21 d)、FS(灌浆期Cd胁迫,18 d)、DS(腊熟期Cd胁迫,15 d)、MS(成熟期Cd胁迫,18 d),以全生育时期无Cd胁迫作为空白对照(CK),每个处理重复3次。各处理外源Cd胁迫浓度相同,均为20 μg·L-1。水培试验于2017年7月23日开始,在湖南省长沙市中南林业科技大学水稻试验基地进行。2017年11月19日,水稻成熟后,整株采集水稻,测定指标为不同生育时期Cd胁迫下水稻农艺性状(株高、分蘖数和各部位生物量)和水稻各部位(根、茎、叶、穗、谷壳和糙米)Cd含量,计算水稻各部位Cd累积量以及不同生育时期Cd累积对成熟期糙米Cd累积的相对贡献率。【结果】不同生育时期Cd胁迫对水稻株高、分蘖数以及各部位生物量没有显著影响。灌浆期Cd胁迫下,水稻成熟期糙米Cd含量最高,为1.05 mg·kg-1,显著高于水稻成熟期(0.57 mg·kg-1)、孕穗期(0.52 mg·kg-1)、腊熟期(0.38 mg·kg-1)、拔节期(0.31 mg·kg-1)和分蘖期(0.17 mg·kg-1)Cd胁迫下糙米Cd含量。各生育时期Cd胁迫下水稻成熟期糙米Cd累积量范围为0.18—1.56 μg/株,糙米Cd累积量大小顺序为:全生育时期Cd胁迫>灌浆期Cd胁迫>成熟期Cd胁迫>孕穗期Cd胁迫>拔节期Cd胁迫>分蘖期Cd胁迫。孕穗期、灌浆期和成熟期是水稻糙米Cd累积的关键生育时期,对成熟期糙米Cd累积相对贡献率分别为19.7%、39.3%和22.6%,而分蘖期、拔节期和腊熟期的Cd累积对成熟期糙米Cd累积相对贡献较小,贡献率分别为2.4%、4.2%和11.9%。除全生育时期Cd胁迫外,水稻根、茎、穗和谷壳Cd含量均在孕穗期和灌浆期Cd胁迫下较高;各生育时期Cd胁迫下,水稻叶Cd含量无显著性差异。孕穗期和灌浆期Cd胁迫下根Cd累积量较高,分别为86.09 μg/株和79.23 μg/株,显著高于其他生育时期Cd胁迫下根Cd累积量(31.55—40.37 μg/株)。与其他生育时期Cd胁迫相比,水稻植株Cd总累积量在孕穗期和灌浆期Cd胁迫下较高,分别为107.13 μg/株和98.35 μg/株,显著高于其他生育时期Cd胁迫下水稻植株Cd总累积量(42.24—52.47 μg/株)。【结论】水稻的孕穗期、灌浆期和成熟期是控制水稻糙米Cd累积的关键时期。在孕穗期和灌浆期Cd胁迫下,水稻成熟期根和糙米累积Cd最多,因此可以在水稻孕穗期和灌浆期施加改良剂阻隔根系吸收Cd或者阻隔根系吸收的Cd向糙米中转运,从而降低水稻糙米中Cd的累积。
水稻;水培试验;Cd胁迫;生育时期;Cd累积
0 引言
【研究意义】我国土壤重金属污染日益严重,土壤Cd点位超标率为7.0%[1]。水稻(L.)是我国重要的粮食作物[2],对Cd富集能力强[3],土壤中的Cd能够被水稻吸收和累积,通过食物链危害人体健康[4]。探究水稻Cd吸收与累积的机理,控制土壤Cd向水稻的迁移是目前的研究热点。【前人研究进展】研究发现,糙米中的Cd不仅来源于水稻成熟期吸收的Cd,还包括水稻孕穗期前吸收的Cd[5-6],这一部分Cd在水稻生长后期进行转移,并在灌浆期随营养物质传输而在糙米中累积[7-9]。近年来,一些研究将水稻不同生育时期作为控制稻田Cd污染的重点,不仅仅注重对水稻成熟期Cd吸收累积状况的研究。张振兴等[10]研究发现,在水稻插秧前、分蘖期、孕穗期、灌浆期施用生石灰能够有效降低成熟期糙米Cd含量,与对照相比分别下降了55.6%、48.6%、22.2%和22.2%。靳磊等[11]研究表明,在水稻分蘖期和孕穗期喷施叶面Zn肥,可以显著降低成熟期糙米Cd含量,与未喷施相比分别降低了45.9%和47.5%。【本研究切入点】水稻成熟期糙米中的Cd并不全部来源于灌浆期到成熟期水稻根系对土壤Cd的吸收,还包括了水稻生育前期已经累积在水稻根系以及茎叶中Cd的再转运。因此,我们认为在水稻某个特定生育时期添加外源Cd,成熟期糙米Cd的累积量应该在一定程度上反映这一生育时期Cd胁迫对成熟期糙米Cd累积的影响。为了印证这一推测,在前人研究基础上[7,12-13],我们开展了不同水稻生育时期Cd胁迫下的水培试验。【拟解决的关键问题】明确不同生育时期Cd胁迫对糙米Cd的影响,及确定水稻体内Cd累积的关键生育时期。
1 材料与方法
1.1 供试材料
供试水稻为湘晚籼13号,常规晚籼品种,由湖南省水稻研究所和金健米业股份有限公司合作选育;水稻培养营养液采用木村营养液[14]。
1.2 试验设计
水培试验在中南林业科技大学生命科学楼水稻试验基地进行,该基地光、气、热均为自然状态。该地区为亚热带季风性气候,降水丰沛,气候温和,雨热同期。2017年7月10日,水稻种子用30% H2O2消毒15 min,用去离子水洗净,再用湿润的纱布包裹,置于人工培养箱(温度30℃,湿度50%)中培养发芽,芽长至1 cm左右,播种于未受Cd污染的土壤中。2017年7月23日,将水稻幼苗(三叶一心)根系用自来水冲洗,去除根系附着的黏土,用海绵包裹、泡沫浮板固定水稻幼苗,放入装有18 L营养液的无盖长方体容器(长50 cm、宽25 cm、高15 cm)中进行前期培养,使水稻幼苗正常生长,满足后期试验要求。2017年8月11日选择长势均匀一致的水稻幼苗,五叶一心,1穴2株,移入装有2.5 L营养液的圆柱形塑料桶中(内径20 cm,高24 cm)进行水培试验。根据试验设计要求在不同生育时期添加外源Cd,使营养液中Cd2+浓度达到20 μg·L-1[6,13,15](外源Cd由CdCl2·2.5H2O配制),每3 d更换一次营养液,同时控制营养液的pH在5.5左右(以NaOH和HCl调节)。试验共设计7个添加外源Cd处理,即CG(全生育时期Cd胁迫,102 d)、TS(分蘖期Cd胁迫,15d)、JS(拔节期Cd胁迫,15 d)、BS(孕穗期Cd胁迫,21 d)、FS(灌浆期Cd胁迫,18 d)、DS(腊熟期Cd胁迫,15 d)、MS(成熟期Cd胁迫,18 d),以全生育时期无Cd胁迫作为空白对照(CK),每个处理重复3次,具体试验设计见表1。根据实际情况喷洒农药,防止病虫害。
2017年11月19日,收获水稻植株,先用自来水冲洗去除水稻表面浮土,再用去离子水清洗3次。将根系剪下,用去离子水冲洗数次,然后放入5 mmol·L-1的CaCl2溶液浸泡15 min,以去除根系表面吸附的Cd2+[16]。然后将根及洗净的其他水 稻部位自然风干后放入烘箱,105℃杀青30 min,70℃烘干至恒重,分别记录根、茎、叶、穗、谷壳和糙米的干重,所有样品粉碎并用密封袋保存待测。
1.3 样品分析测定方法
水稻样品采用干灰法进行消解(GB/T 5009—2003),水稻样品溶液中的Cd含量使用石墨炉原子吸收分光光度计(iCE-3500,Thermo)测定。所有样品分析过程中以湖南大米(GBW 10045(GSB-23))进行质量控制,Cd的回收率为98.2%—101.8%,同时做空白试验。
1.4 数据统计与分析
水稻各部位(根、茎、叶、穗、谷壳、糙米)Cd累积量(μg/株)用BAi表示[17]:
BAi=Ci×Bi
式中,Ci是水稻各部位(根、茎、叶、穗、谷壳、糙米)Cd 含量(mg·kg-1),Bi是水稻各部位生物量(干重,g/株)。
水稻植株Cd累积量=∑BAi
水稻不同生育时期Cd累积对成熟期糙米Cd累积相对贡献率用P表示:
P=(Cj×Bj-Ck×Bk)/∑(Cj×Bj-Ck×Bk)×100%
式中,Cj是不同生育时期Cd胁迫(分蘖期、拔节期、孕穗期、灌浆期、腊熟期、成熟期)下糙米Cd 含量(mg·kg-1),Bj是不同生育时期Cd胁迫下糙米生物量(干重,g/株),Ck是全生育时期无Cd胁迫下糙米Cd 含量(mg·kg-1),Bk是全生育时期无Cd胁迫下糙米生物量(干重,g/株)。
本研究数据统计与分析采用SPSS19.0 Duncan多重比较法(<0.05),图形采用Origin 9.0进行绘制。
2 结果
2.1 不同生育时期Cd胁迫对水稻生长的影响
对成熟期水稻株高、分蘖数和生物量进行测定(表2),各处理间水稻生长差异不明显。从水稻生物量来看,各处理糙米生物量与对照(CK)均不存在显著差异(>0.05);与全生育时期Cd胁迫(CG)相比,除MS处理的茎生物量之外,其余处理均不存在显著差异(>0.05);MS处理与JS和FS处理的谷壳生物量之间存在显著差异(<0.05)。各处理水稻株高与CK和CG处理均不存在显著差异(>0.05)。JS处理的分蘖数最多,且与CG处理存在显著差异(<0.05)。

表1 试验设计
表中TS代表分蘖期,JS代表拔节期,BS代表孕穗期,FS代表灌浆期,DS代表蜡熟期,MS代表成熟期,CG代表全生育时期。下同
In this table, TS represents tilling stage, JS represents jointing stage, BS represents booting stage, FS represents filling stage, DS represents dough stage, MS represents maturing stage, and CG represents the whole growth stages. The same as below
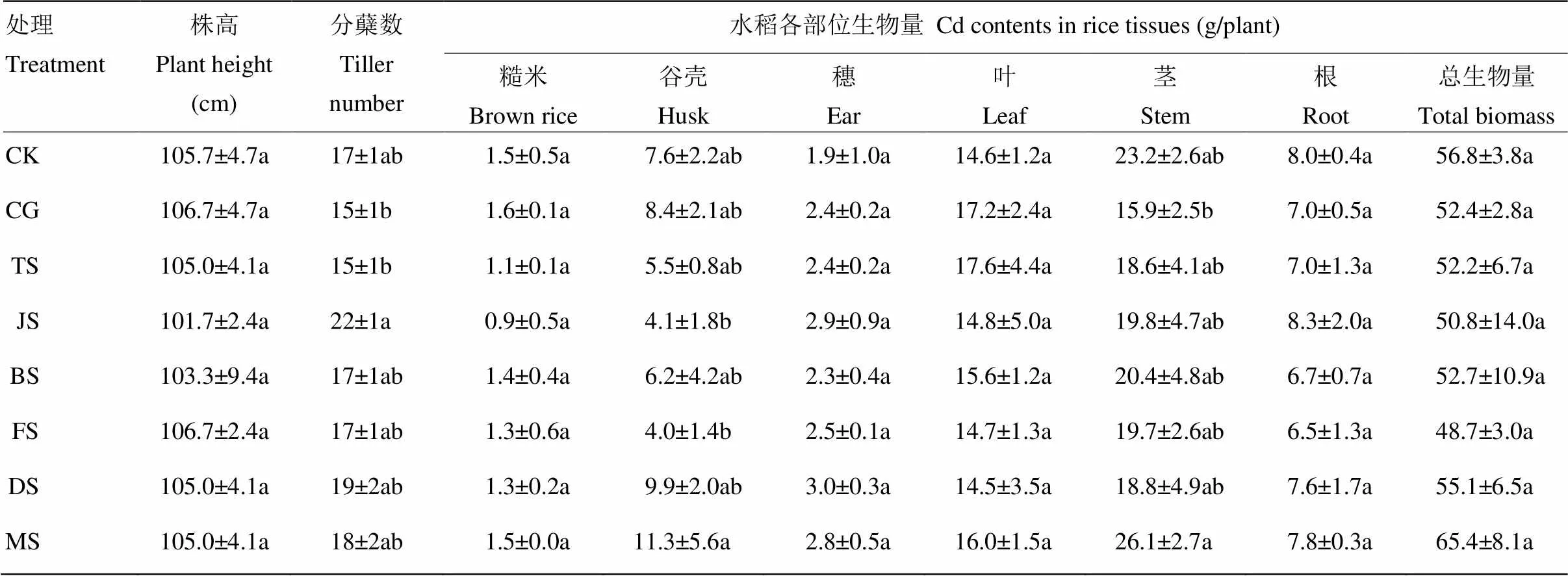
表2 不同生育时期Cd胁迫对水稻生长的影响
同一列不同小写字母表示不同处理间差异显著(<0.05),下同
Different letters in the same column indicate significant differences under different treatment (<0.05). The same as below
2.2 不同生育时期Cd胁迫对水稻成熟期各部位Cd含量的影响
图1是不同生育时期Cd胁迫对水稻成熟期糙米Cd含量的影响。各处理下糙米Cd含量范围在0.17—1.05 mg·kg-1。除FS处理外,各处理下糙米Cd含量均显著低于CG处理(<0.05)。FS处理下糙米Cd含量最高(1.05 mg·kg-1),分别为CG、TS、JS、BS、DS和MS处理下糙米Cd含量的1.08、6.34、3.38、2.01、2.75和1.84倍;其次是MS处理(0.57 mg·kg-1)(除CG外),显著高于TS、JS和DS处理;除CK外,TS处理下糙米Cd含量最低(0.17 mg·kg-1),与BS、FS、DS和MS处理均存在显著差异(<0.05)。
表3为不同生育时期Cd胁迫对水稻成熟期根、茎、叶、穗和谷壳Cd含量的影响。可以看出,各处理下根Cd含量变化范围最大,为4.09—22.32 mg·kg-1,大小顺序为CG>BS≈FS>TS≈JS≈DS≈MS,均高于CK(1.60 mg·kg-1)。BS和FS处理下根Cd含量显著高于TS、JS、DS和MS处理(<0.05)。除CG处理外,各处理茎、叶和穗Cd含量差异不显著(>0.05)。各处理下谷壳Cd含量变化范围为0.27—1.04 mg·kg-1,除CG处理外,FS处理下Cd含量最高(0.96 mg·kg-1),显著高于TS、JS、DS和MS处理;其次为BS处理(0.71 mg·kg-1),除CK外,DS和MS处理下谷壳Cd含量最低(0.27 mg·kg-1)。
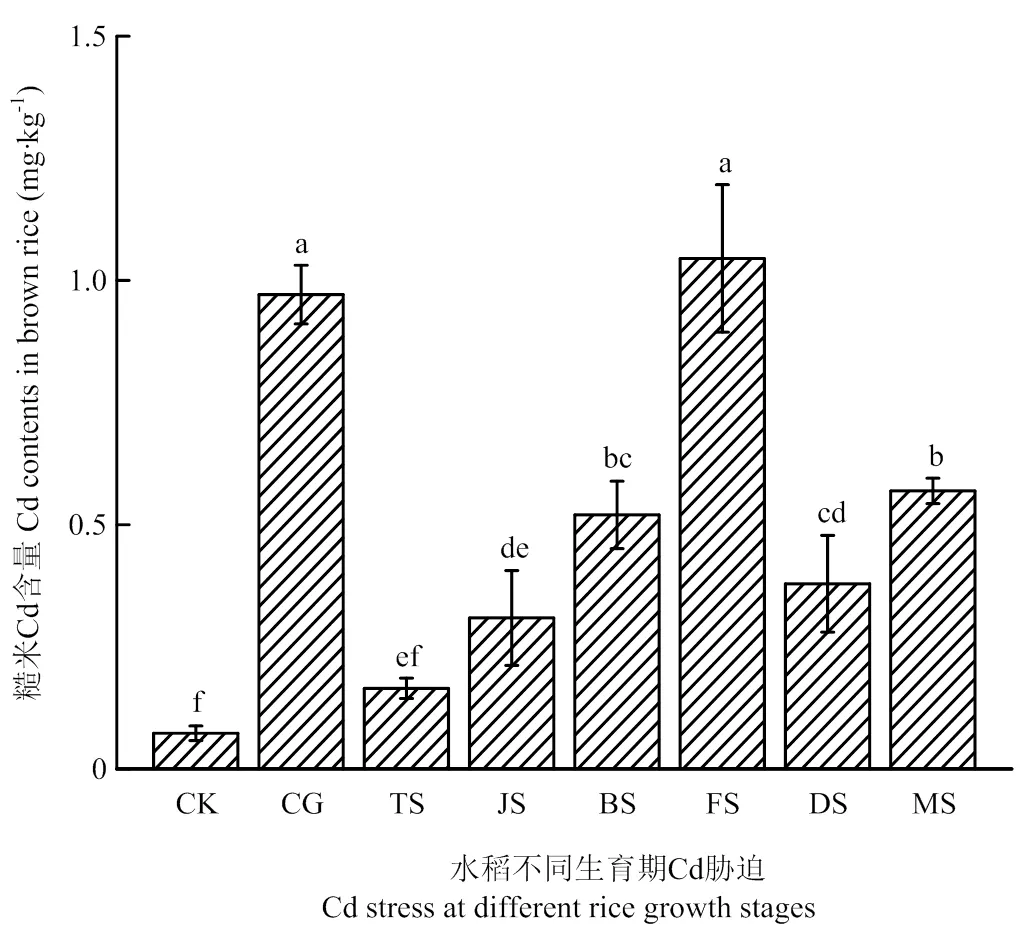
不同小写字母表示不同处理间差异显著(P<0.05)
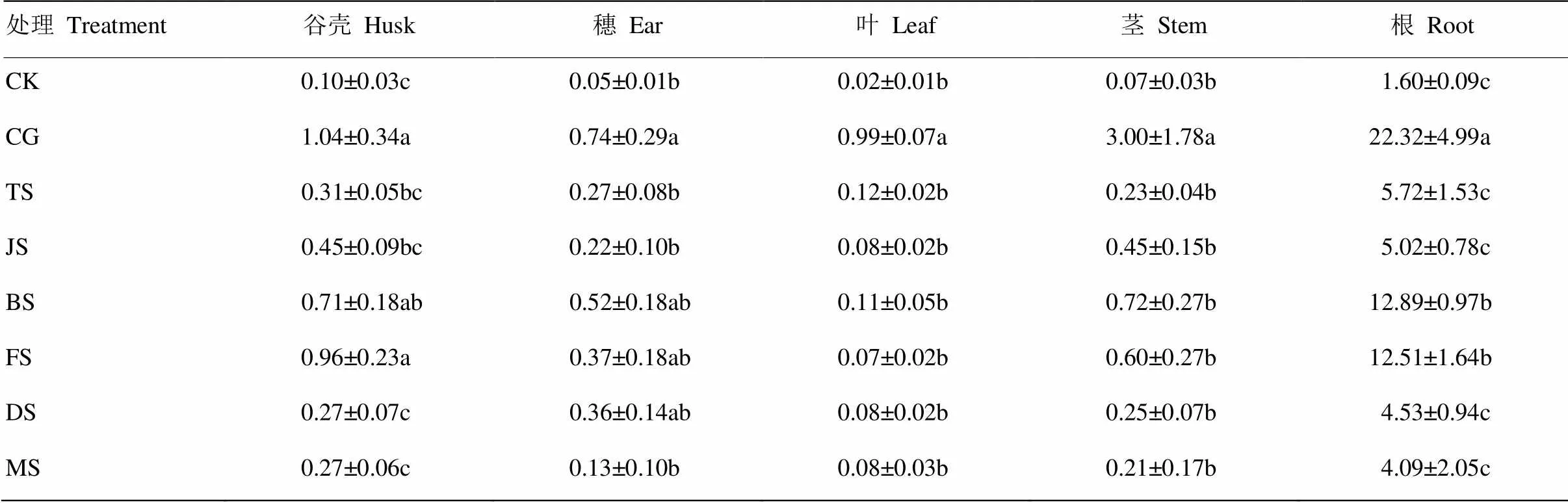
表3 不同生育时期Cd胁迫对水稻成熟期根、茎、叶、穗和谷壳Cd含量的影响
2.3 不同生育时期Cd胁迫对水稻成熟期各部位Cd累积量的影响
不同生育时期Cd胁迫对水稻植株Cd累积量影响显著(表4)。各处理下水稻植株Cd总累积量为42.24—228.21 μg/株,大小顺序为CG>BS≈FS>TS≈JS≈DS≈MS,均高于CK(15.45 μg/株)。各处理下成熟期糙米Cd累积量为0.18—1.56 μg/株,除CG处理外,FS处理糙米Cd累积量最高(1.39 μg/株),MS处理次之(0.84 μg/株),TS处理最低(0.18 μg/株)。各处理下根Cd累积量变化范围为31.55—155.87 μg/株,BS和FS处理根Cd累积量较高(86.09和79.23 μg/株),显著高于其他处理(<0.05)。除CG处理外,BS处理谷壳Cd累积量最高,但与其他处理不存在显著差异;各处理下茎、叶和穗Cd累积量变化不显著(>0.05)。
2.4 不同生育时期Cd累积对水稻成熟期糙米Cd累积的相对贡献
图2表述了水稻在不同生育时期Cd累积对成熟期糙米Cd累积的相对贡献率,其中灌浆期累积的Cd对糙米Cd累积相对贡献最大,其次是成熟期和孕穗期。不同生育时期累积的Cd对水稻糙米Cd累积的相对贡献大小顺序为灌浆期(39.3%)>成熟期(22.6%)>孕穗期(19.7%)>腊熟期(11.9%)>拔节期(4.2%)>分蘖期(2.4%),说明水稻孕穗至灌浆阶段以及水稻在成熟期吸收累积的Cd是成熟期糙米中Cd的主要来源。
3 讨论
3.1 不同生育时期Cd胁迫对水稻各部位Cd累积影响差异
水稻在不同生育时期吸收的Cd对成熟期各部位Cd累积量均产生一定影响(表4),同时水稻各部位累积Cd的关键生育时期存在差异。除全生育时期Cd胁迫外,孕穗期和灌浆期Cd胁迫下,根Cd累积量显著高于其他生育时期Cd胁迫下的Cd累积量,分别为86.09 μg/株、79.23 μg/株。孕穗期是水稻生长发育的重要时期,生理活动旺盛,吸收各种营养元素的能力提高[18];水稻在孕穗期形成发达的根系[19],增大了根和营养液的接触面积,而根系作为水稻吸收养分和矿质元素的主要器官,对Cd的吸收自然也较多[20]。孕穗期和灌浆期Cd胁迫下,水稻茎、谷壳和植株Cd累积量均较高[21];糙米Cd累积量(0.75 μg/株、1.39 μg/株)也仅略低于全生育时期胁迫下糙米Cd累积量(1.56 μg/株),说明孕穗期和灌浆期对水稻累积Cd十分关键[22]。孕穗期是水稻谷壳进一步形成、完善的重要时期,水稻大部分营养物质提供给稻穗,所以该时期谷壳Cd累积较多[7]。除全生育时期Cd胁迫外,分蘖期Cd胁迫下叶的Cd累积量最高。在水稻分蘖期,叶片对营养元素的需求量大,Cd能够随营养元素,通过主动运输和被动运输等方式被水稻吸收进入叶片并累积下来[7,23-24]。各生育时期Cd胁迫下的根、茎、穗、谷壳、糙米Cd累积量总和分别为308.11、47.56、4.71、17.34、3.89 μg/株,均高于全生育时期Cd胁迫下根、茎、穗、谷壳、糙米Cd累积量(155.87、43.02、1.76、8.85、1.56 μg·株-1)(表4)。处于全生育时期Cd胁迫下的水稻,能通过合成应激物质(乙烯或蛋白)增强自身对Cd的耐性,此类物质能阻挡水稻根系吸收以及向茎叶中转运Cd,来降低水稻对Cd的吸收累积[25-27]。这种植物适应Cd胁迫的耐性机制,导致全生育时期Cd胁迫下Cd累积量显著低于各生育时期Cd胁迫下的总和。
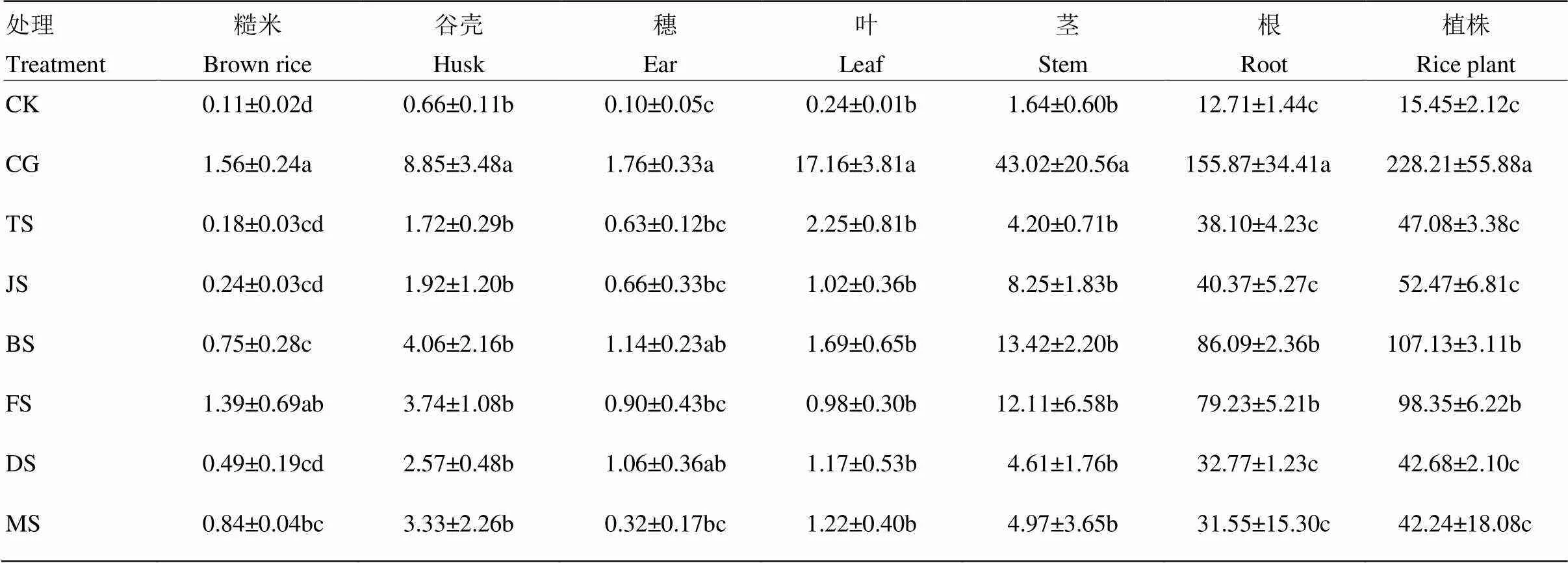
表4 不同生育时期Cd胁迫对水稻成熟期各部位(根、茎、叶、穗、谷壳和糙米)Cd累积量的影响
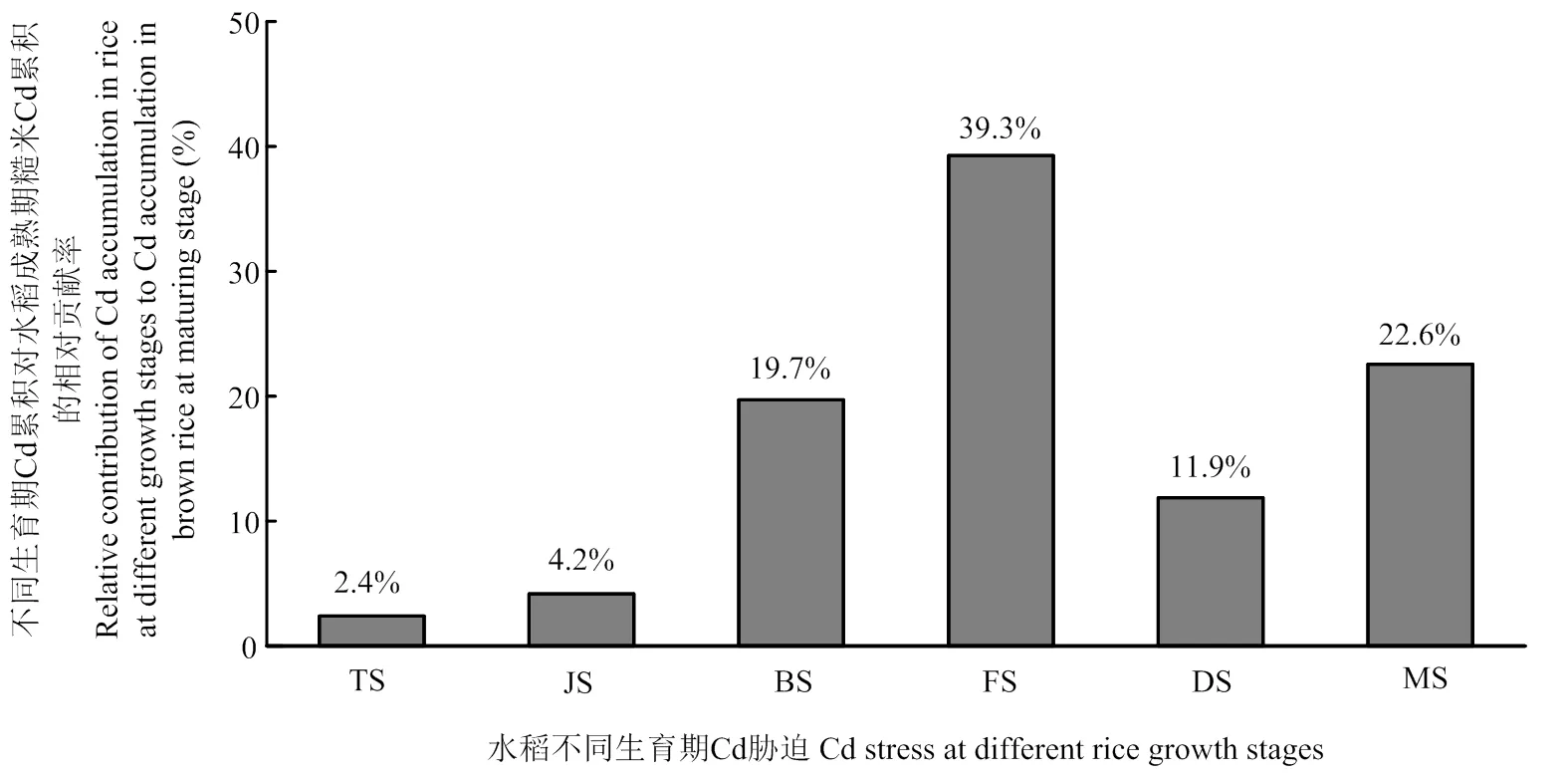
图2 不同生育时期Cd累积对水稻成熟期糙米Cd累积的相对贡献率
3.2 不同生育时期Cd胁迫对水稻成熟期糙米Cd累积相对贡献差异
本研究通过在水稻不同生育时期添加外源Cd来探究成熟期糙米Cd累积的关键生育时期。孕穗期、灌浆期、腊熟期和成熟期Cd胁迫下,成熟期糙米Cd含量均高于分蘖期和拔节期Cd胁迫下的糙米Cd含量,说明水稻在孕穗到成熟阶段吸收转运的Cd对糙米Cd累积的贡献比孕穗期前吸收转运的Cd要大(图1)。值得一提的是,灌浆期Cd胁迫下,成熟期糙米Cd含量最高(1.05 mg·kg-1),显著高于其他处理(<0.05),甚至高于全生育时期Cd胁迫下糙米的Cd含量(0.97 mg·kg-1),表明在水稻灌浆期,糙米累积Cd的能力较强[22]。研究发现,在水稻灌浆期,土壤中的Cd被植物根系吸收进入水稻植株体内,能与木质部中大量有机酸和氨基酸结合形成复合物,随着茎的木质部蒸腾流输送到地上部位,直接转运至糙米中[15,28]。另外,贮藏在水稻茎鞘中的淀粉和蔗糖等非结构性碳水化合物,以及叶光合作用产物被大量转运到籽粒胚乳中[29],Cd也随着灌浆物质被转运至糙米。冯雪敏[30]通过稳定性同位素示踪技术发现,拔节期、抽穗期和灌浆期Cd胁迫对水稻成熟期糙米Cd累积的贡献达到65%—75%,且灌浆期从根部吸收的Cd对成熟期糙米Cd累积贡献最大。本研究同样发现,水稻不同生育时期Cd累积对糙米Cd累积的贡献存在显著差异,与唐皓和李鹏等的研究结果一致[31-32]。孕穗期、灌浆期和成熟期是糙米Cd累积关键时期,这3个时期Cd累积对糙米中Cd累积贡献较大,相对贡献率分别为19.7%、39.3%和22.6%,这与Rodda等[15]的研究结果相近,水稻扬花期后根系吸收的Cd是糙米中Cd的主要来源。灌浆期是糙米Cd累积最重要的时期,主要是因为在该时期,水稻籽粒中蛋白质合成加剧[33],重金属Cd能够被叶和茎节中的OsLCT1和OsNRAMP1等转运蛋白转运到籽粒中[34],籽粒中的Cd与蛋白质结合而被固定[35],因此几乎不向其他水稻部位转运而被累积在糙米中,这与彭鸥等[13]的水培试验结果基本一致。本研究主要属于理论研究,与水稻的实际种植有很大差异。在后期的研究中,我们将应用水培试验的结果来进行水稻的土壤栽培试验,希望能够找到利用土壤调理剂(或钝化剂)控制土壤Cd向糙米转运最佳时机和最佳方法。
4 结论
不同生育时期Cd胁迫对水稻生长没有显著影响。在孕穗期和灌浆期,水稻根系吸收累积转运Cd的能力较强,这是水稻植株累积Cd的重要时期。水稻成熟期糙米中的Cd主要来源于孕穗期、灌浆期和成熟期营养物质运输的吸收、转运和累积。因此,孕穗期、灌浆期和成熟期是糙米Cd累积关键时期,对糙米Cd累积的相对贡献分别为19.7%、39.3%和22.6%。
[1] 环境保护部, 国土资源部. 全国土壤污染状况调查公报. 中国环保产业, 2014, 36(5): 10-11.
Ministry of Environmental Protection, Ministry of Land and Resources. Bulletin of the national soil pollution survey.2014, 36(5): 10-11. (in Chinese)
[2] 杨文弢, 周航, 邓贵友, 朱维, 吴玉俊, 邹紫今, 王艳, 廖柏寒. 组配改良剂对污染稻田中铅、镉和砷生物有效性的影响. 环境科学学报, 2016, 36(1): 257-263.
YANG W T, ZHOU H, DENG G Y, ZHU W, WU Y J, ZOU Z J, WANG Y, LIAO B H. Effects of combined amendment on bioavailability of Pb, Cd, and As in polluted paddy soil., 2016, 36(1): 257-263. (in Chinese)
[3] CHANEY R L, REEVES P G, PHILIP P G, SIMMONS R W, WELCH R M, ANGLE J S. An improved understanding of soil Cd risk to humans and low cost methods to phytoextract Cd from contaminated soils to prevent soil Cd risks., 2004, 17(5): 549-553.
[4] 张小敏, 张秀英, 钟太洋, 江洪. 中国农田土壤重金属富集状况及其空间分布研究. 环境科学, 2014, 35(2): 692-703.
ZHANG X M, ZHANG X Y, ZHONG T Y, JIANG H. Spatial distribution and accumulation of heavy metal in arable land soil of China., 2014, 35(2): 692-703.(in Chinese)
[5] 史静, 李正文, 龚伟群, 潘根兴. 2种常规水稻Cd、Zn吸收与器官分配的生育期变化: 品种、土壤和Cd处理的影响. 生态毒理学报, 2007, 2(1): 32-40.
SHI J, LI Z W, GONG W Q, PAN G X.Uptake and partitioning of Cd and Zn by two non-hybrid rice cultivars in different growth stages: effect of cultivars, soil type and Cd spike., 2007, 2(1): 32-40. (in Chinese)
[6] YONG F Y, DOUG H C, DO S K, YUN W L. Absorption, translocation, and remobilization of cadmium supplied at different growth stages of rice., 2010, 13(2):113-119.
[7] 叶长城, 陈喆, 彭鸥, 周细红, 铁柏清, 刘孝利, 雷鸣, 魏祥东, 孙健. 不同生育期Cd胁迫对水稻生长及镉累积的影响. 环境科学学报, 2017, 37(8): 3201-3206.
YE C C, CHEN Z, PENG O, ZHOU X H, TIE B Q, LIU X L, LEI M, WEI X D, SUN J. Effects of cadmium stress on growth and cadmium accumulation in rice at different growth stages., 2017, 37(8): 3201-3206.(in Chinese)
[8] GREGER M, LOFSTEDT M. Comparison of uptake and distribution of cadmium in different cultivars of bread and durum wheat., 2004, 44(2): 111-113.
[9] KASHIWAGI T, SHINDOH K, HIROTSU N, ISHIMARU K. Evidence for separate translocation pathways in determining cadmium accumulation in grain and aerial plant parts in rice., 2009, 9(1): 8.
[10] 张振兴, 纪雄辉, 谢运河, 官迪, 彭华, 朱坚, 田发祥. 水稻不同生育期施用生石灰对稻米镉含量的影响. 农业环境科学学报, 2016, 35(10): 1867-1872.
ZHANG Z X, JI X H, XIE Y H, GUAN D, PENG H, ZHU J, TIAN F X. Effects of quicklime application at different rice growing stage on the cadmium contents in rice grain.,2016, 35(10): 1867-1872.(in Chinese)
[11] 靳磊, 胡召华, 纪雄辉, 魏维, 谢运河. 不同时期喷施Zn肥抑制水稻Cd吸收转运的效果. 湖南农业科学, 2017, 8(1): 37-40.
JIN L, HU S H, JI X H,WEI W, XIE Y H. Effects of Zinc foliar application at different growth stages on cadmium absorption and transport in rice.,2017, 8(1): 37-40.(in Chinese)
[12] ZHOU H, ZHU W, YANG W T, GU J F, GAO Z X, CHEN L W, DU W Q, ZHANG P, PENG P Q, LIAO B H. Cadmium uptake, accumulation, and remobilization in iron plaque and rice tissues at different growth stages., 2018, 152: 91-97
[13] 彭鸥, 铁柏清, 叶长城, 张淼, 刘孝利, 魏祥东, 孙健. 稻米镉关键积累时期研究. 农业资源与环境学报, 2017, 34(3): 272-279.
PENG O, TIE B Q, YE C C, ZHANG M, LIU X L, WEI X D, SUN J. The key period of cadmium accumulation in rice.,2017, 34(3): 272-279.(in Chinese)
[14] 薛应龙. 植物生理学实验手册. 上海: 上海科学技术出版社, 1985.
XUE Y L.. Shanghai: Shanghai Scientific & Technical Publishers, 1985. (in Chinese)
[15] RODDA M S, LI G, REID R J. The timing of grain Cd accumulation in rice plants: the relative importance of remobilisation within the plant and root Cd uptake post-flowering., 2011, 347(1/2): 105-114.
[16] 胡莹, 黄益宗, 段桂兰, 刘云霞. 镉对不同生态型水稻的毒性及其在水稻体内迁移转运. 生态毒理学报, 2012, 7(6): 664-670.
HU Y, HUANG Y Z, DUAN G L, LIU Y X.Cadmium toxicity and its translocation in two ecotype rice cultivars., 2012, 7(6): 664-670.(in Chinese)
[17] 胡莹, 黄益宗, 黄艳超, 刘云霞. 不同生育期水稻根表铁膜的形成及其对水稻吸收和转运Cd的影响. 农业环境科学学报, 2013, 32(3): 432-437.
HU Y, HUANG Y Z, HUANG Y C, LIU Y X. Formation of iron plaque on root surface and its effect on Cd uptake and translocation by rice (L) at different growth stages., 2013, 32(3): 432-437.(in Chinese)
[18] LIU H J, ZHANG J L, CHRISTIE P, ZHANG F S. Influence of external zinc and phosphorus supply on Cd uptake by rice (L.) seedlings with root surface iron plaque., 2007, 300(1/2): 105-115.
[19] 史锟, 张福锁, 刘学军, 张旭东. 不同时期施铁对水稻根表铁胶膜中铁镉含量及根系含镉量的影响. 农业环境科学学报, 2004, 23(1): 6-12.
SHI K, ZHANG F S, LIU X J, ZHANG X D. Effects of different periods applied Fe2+and concentrations on Fe and Cd contents in iron plaque on rice root., 2004, 23(1): 6-12.(in Chinese)
[20] 辜娇峰. 组配改良剂对稻田镉砷复合污染的调控效果及机制研究[D]. 长沙: 中南林业科技大学, 2017.
GU J F. Mechanisms and effects of combined amendment regulating paddy soil complexly contaminated with cadmium and arsenic[D]. Changsha: Central South University of Forestry and Technology, 2017.(in Chinese)
[21] 陈宝玉, 王洪君, 曹铁华, 梁烜赫, 杨建, 任军. 不同磷肥浓度下土壤-水稻系统重金属的时空累积特征. 农业环境科学学报, 2010, 29(12): 2274-2280.
CHEN B Y, WANG H J, CAO T H, LIANG X H,YANG J, REN J. Spatio-temporal characteristics of heavy metal accumulation in soil-rice cropping system under different phosphate fertilizer concentrations., 2010, 29(12): 2274-2280.(in Chinese)
[22] 李冰, 王昌全, 李枝, 李仕贵. Cd胁迫下杂交水稻对Cd的吸收及其动态变化. 生态环境学报, 2014, 23(2): 312-316.
LI B, WANG C Q, LI Z, LI S G. Absorption of Cd by hybrid rice under the Cd stress and its dynamic change., 2014, 23(2): 312-316.(in Chinese)
[23] 莫争, 王春霞, 陈琴, 王海, 薛传金, 王子健. 重金属Cu, Pb, Zn, Cr, Cd在水稻植株中的富集和分布. 环境化学, 2002, 21(2): 110-116.
MO Z, WANG C X, CHEN Q, WANG H, XUE C J, WANG Z J. Distribution and enrichment of heavy metals of Cu, Pb, Zn, Cr and Cd in paddy plant., 2002, 21(2): 110-116.(in Chinese)
[24] 张路, 张锡洲, 李廷轩, 余海英, 戢林. Cd胁迫对水稻亲本材料Cd吸收分配的影响. 农业环境科学学报, 2014, 33(12): 2288-2295.
ZHANG L, ZHANG X Z, LI T X, YU H Y, JI L. Effects of cadmium stress on uptake and distribution of cadmium in different rice varieties., 2014, 33(12): 2288-2295.(in Chinese)
[25] 荆红梅, 郑海雷, 赵中秋, 张春光. 植物对镉胁迫响应的研究进展. 生态学报, 2001, 21(12): 2125-2130.
JIN H M, ZHENG H L, ZHAO Z Q, ZHANG C G. Progresses of plants response to cadmium., 2001, 21(12): 2125-2130.(in Chinese)
[26] 张军, 束文圣. 植物对重金属镉的耐受机制. 植物生理与分子生物学学报, 2006, 32(1): 1-8.
ZHANG J, SHU W S. Mechanisms of heavy metal cadmium tolerance in plants., 2006, 32(1): 1-8. (in Chinese)
[27] 陈爱葵, 王茂意, 刘晓海, 曾小龙. 水稻对重金属镉的吸收及耐性机理研究进展. 生态科学, 2013, 32(4): 514-522.
CHEN A Q, WANG M Y, LIU X H, ZENG X L.Research progress on the effect of cadmium on rice and its absorption and tolerance mechanisms., 2013, 32(4): 514-522.(in Chinese)
[28] 叶瑶瑶, 王飞娟, 石晓柳, 王高阳, 俞姣, 朱诚. Cd在水稻籽粒中的积累及运输机制. 园艺与种苗, 2012, 11(1): 58-61.
YE Y Y, WANG F J, SHI X L, WANG G Y, YU J, ZHU C. Mechanisms of Cd accumulation and transportation in rice grain., 2012, 11(1): 58-61.(in Chinese)
[29] 潘俊峰, 王博, 崔克辉, 黄见良, 聂立孝. 氮肥对水稻节间和叶鞘非结构性碳水化合物积累转运特征的影响. 中国水稻科学, 2016, 30(3): 273-282.
PAN J F, WANG B, CUI K H, HUANG J L, NIE L X. Effects of nitrogen application on accumulation and translocation of non- structural carbohydrates in internodes and sheaths of rice., 2016, 30(3): 273-282.(in Chinese)
[30] 冯雪敏. 水稻富集镉砷的关键部位、生育时期及相关元素的研究[D]. 北京: 中国农业科学院, 2017.
FENG X M. The key parts, important growth stages and related elements in Cd/As accumulation of rice[D]. Beijing: Chinese Academy of Agricultural Sciences, 2017.(in Chinese)
[31] 唐皓, 李廷轩, 张锡洲, 余海英, 陈光登. 水稻镉高积累材料不同生育期镉积累变化特征研究. 农业环境科学学报, 2015, 34(3): 471-477.
TANG H, LI T X, ZHANG X Z, YU H Y, CHEN G D. Cadmium accumulation in high cadmium-accumulating rice cultivars at different growth stages., 2015, 34(3): 471-477.(in Chinese)
[32] 李鹏, 葛滢, 吴龙华, 沈丽波, 谭维娜, 骆永明. 两种籽粒镉含量不同水稻的镉吸收转运及其生理效应差异初探. 中国水稻科学, 2011, 25(3): 291-296.
LI P, GE Y, WU L H, SHEN L B, TAN W N, LUO Y M. Uptake and translocation of cadmium and its physiological effects in two rice cultivars differed in grain cadmium concentration., 2011, 25(3): 291-296.(in Chinese)
[33] 梁成刚, 陈利平, 汪燕, 刘佳, 许光利, 李天. 高温对水稻灌浆期籽粒氮代谢关键酶活性及蛋白质含量的影响. 中国水稻科学, 2010, 24(4): 398-402.
LIANG C G, CHEN L P, WANG Y, LIU J, XU G L, LI T. Effects of high temperature on key enzyme activities of nitrogen metabolism and protein content during rice grain filling., 2010, 24(4): 398-402.(in Chinese)
[34] URAGUCHI S, KAMIYA T, SAKAMOTO T, KASAI K, SATO Y, NAGAMURA Y, YOSHIDA A, KYOZUKA J, ISHIKAWA S, FUJIWARA T. Low-affinity cation transporter (OsLCT1) regulates cadmium transport into rice grains., 2011, 108(52): 20959-20964.
[35] 杨居荣, 何孟常, 查燕, 刘虹, 张平. 稻、麦籽实中Cd的结合形态. 中国环境科学, 2000, 20(5): 404-408.
YANG J R, HE M C, CHA Y, LIU H, ZHANG P. Binding forms of Cd in the rice and wheat seeds., 2000, 20 (5): 404-408.(in Chinese)
Study on Key Growth Stage of Cd Accumulation in Brown Rice Through a Hydroponic Experiment with Cd Stress
WANG QianQian, JIA RunYu, LI HongCheng, ZHOU Hang, YANG WenTao, GU JiaoFeng, PENG PeiQin, LIAO BoHan
(College of Environment Science and Engineering, Central South University of Forestry and Technology/Hunan Engineering Laboratory for Control of Rice Quality and Safety, Changsha 410004)
【Objective】 The objectives of this study were to explore the effects of Cd stress on Cd accumulation in brown rice at different growth stages (tillering stage, jointing stage, booting stage, filling stage, dough stage, and maturing stage) of rice plants, to clear and definite the key growth stages of rice plants for Cd accumulating in brown rice, so as to provide directions of rice safety production by taking suitable measures timely for reducing Cd contents in brown rice.【Method】 Taking Xiangwanxian 13 (a late rice variety) as the studied plant, a hydroponic experiment with rice plants was conducted with seven treatments of exogenous Cd application, including CG (whole growth stages with Cd stress, 102 d), TS (tilling stage with Cd stress, 15 d), JS (jointing stage with Cd stress, 15 d), BS (booting stage with Cd stress, 21 d), FS (filling stage with Cd stress, 18 d), DS (dough stage with Cd stress, 15 d), and MS (maturing stage with Cd stress, 18 d). All seven treatments were repeated 3 times and another treatment of the whole growth stages without Cd stress as control (CK). Exogenous Cd in each treatment was the same as 20 μg·L-1. The hydroponic experiment started in July 23, 2017, at the rice experiment base of Central South University of Forestry and Technology in Changsha, Hunan province. Agronomic characters (plant height, tiller number, and biomass of rice tissues) and Cd contents in various rice tissues were determined after harvest in November 19, 2017. Cd amountsand the relative contribution rates of Cd accumulation at different growth stages to Cd accumulation in brown rice at maturing stage were calculated. 【Result】 The results showed that exogenous Cd application at different growth stage of rice plants did not affect plant height, tiller number, and biomass of rice tissues. At the filling stage with Cd stress, Cd contents in brown rice was the highest and reached to 1.05 mg·kg-1, which was significantly higher than Cd contents in brown rice with Cd stress at the maturing stage (0.57 mg·kg-1), booting stage (0.52 mg·kg-1), dough stage (0.38 mg·kg-1), jointing stage (0.31 mg·kg-1), and tilling stage (0.17 mg·kg-1). The range of Cd amounts in brown rice with Cd stress at different growth stages were 0.18-1.56 μg/plant, and the sequence of Cd amounts were: whole growth stages with Cd stress>filling stage with Cd stress>maturing stage with Cd stress>booting stage with Cd stress>jointing stage with Cd stress>tilling stage with Cd stress. The booting stage, filling stage and maturing stage of rice plants were the key growth stages for Cd accumulating in brown rice, and the relative contribution rates of Cd accumulating in brown rice at these three growth stages were 19.7%, 39.3%, and 22.6%, respectively. The contributions of Cd stress to Cd accumulating in brown rice were 2.4%, 4.2%, and 11.9% at the tillering, jointing, and dough stage, respectively, which were relatively lower compared with the other three stages. Cd contents in rice roots, stem, ear, and husk at booting stage and filling stage were all higher except the whole growth stages with Cd stress. There was no significant difference in Cd content in rice leaves (>0.05) at different growth stages with Cd stress. At the tillering stage and filling stage with Cd stress, Cd amounts in rice roots were 86.09 μg/plant and 79.23 μg/plant, respectively, which was significantly higher than those at the other stages of rice plants (31.55-40.37 μg/plant). Compared to the other stages, Cd amounts in rice plants at the booting stage and filling stage with Cd stress were high, reaching 107.13 μg/plant and 98.35 μg/plant, respectively, which was significantly higher than those at the other four stages of rice plants (42.24-52.47 μg/plant). 【Conclusion】 The booting stage, filling stage, and maturing stage of rice plants were the key growth stages for controlling Cd accumulation in brown rice. With Cd stress at the booting stage and filling stage, the Cd accumulation in the root and brown rice at the maturing stage were higher than those other stages. therefore, the Cd accumulation in brown rice could be reduced by applying soil amendments at the booting stage and filling stage of rice plants to obstruct root absorbing Cd or reducing Cd transportation from rice root to brown rice.
rice (L); hydroponic experiment; Cd stress; growth stage; Cd accumulation
10.3864/j.issn.0578-1752.2018.23.003
2018-06-13;
2018-08-14
国家重点研发计划(2016YFD0800705)、国家自然科学基金(41501344)、湖南省重点学科建设项目(2006180)、研究生科技创新基金项目(20183022)
王倩倩,E-mail:13657319540@163.com。
周航,E-mail:zhouhang4607@163.com。通信作者廖柏寒,E-mail:liaobh1020@163.com
(责任编辑 杨鑫浩)
