骨形态生成蛋白2联合转化生长因子β3诱导髓核间充质干细胞向类髓核细胞分化的实验研究*
2018-12-11程实应金威文天用裴世深苏凌浩王德利阮狄克
程实 应金威 文天用 裴世深 苏凌浩 王德利 阮狄克**
(1.海军总医院骨科,北京 100048;2.北京大学深圳医院骨关节科,广东 深圳 518035)
椎间盘退行性疾病是引起临床下腰痛症状的重要病因之一,多种因素在椎间盘退变的过程中发挥作用[1]。目前认为椎间盘退变始于髓核,髓核细胞数量减少及功能失调是导致椎间盘退变的重要原因之一[2],因此多数研究也都围绕髓核展开。在各种针对椎间盘退变的生物学治疗手段中,间充质干细胞因其具有自我复制和多系分化能力而在椎间盘退变修复中显示出巨大的应用潜力[3,4]。近年研究[5,6]发现,髓核组织内存在髓核间充质干细胞(nucleus pulposus mesenchymal stem cells,NPSCs),并且在维持髓核组织正常功能及内环境稳态中发挥重要作用。研究[7]发现,退变及衰老个体的椎间盘内髓核间充质干细胞分化能力减弱,无法继续发挥作用。因此,通过激活NPSCs向类髓核细胞分化以达到组织的自我修复是理想的治疗方法。骨形态生成蛋白2(bone morphogenetic protein 2,BMP-2)和转化生长因子β3(transforming growth factorβ3,TGF-β3)都可以促进干细胞表达软骨相关基因,在调控干细胞向类软骨细胞分化及代谢中具有重要作用[8,9]。目前关于两者对于诱导NPSCs向类髓核细胞分化的作用及其最佳条件的报道较为少见。本实验旨在研究联合应用BMP-2和TGF-β3对NPSCs向类髓核细胞分化的作用,为进一步应用NPSCs修复椎间盘退变打下基础。
1 材料与方法
1.1 实验动物来源
3月龄健康雄性SD大鼠10只,体质量约330~350 g,均由海军总医院动物实验中心提供,动物处理方案符合伦理要求。
1.2 髓核间充质干细胞的分离、培养及鉴定
经腹腔过量注射10%水合氯醛处死SD大鼠,70%酒精浸泡消毒后切除鼠尾,无菌刀片切开纤维环,显微镜下分离髓核组织,转移至15 ml离心管中,加PBS漂洗3次去除血污,于六孔板内将髓核组织切成1 mm3的小块,加入2 mlⅡ型胶原酶消化4 h,终止消化,离心后将细胞转移至25 cm2培养瓶中,加入10%血清DMEM培养基(Gibco公司,美国),在37℃,5%CO2条件下培养,6 h后弃培养基及未贴壁的细胞,此后每3 d换液一次,倒置相差显微镜观察细胞形态,待融合至80%~90%时,用0.25%胰酶消化后按1∶3比例传代,取P3代细胞用于后续实验。
1.3 三系分化实验
取P3代NPSCs,分别加入成脂、成骨、成软骨诱导培养基(赛业生物科技公司,中国)诱导21 d,21 d后收集细胞分别进行油红O、茜素红、阿利新蓝染色观察分化效果。
1.4 流式细胞仪检测干细胞表型表达情况
取P3代NPSCs,消化后重悬调整细胞浓度为2×106个/ml,取100µl细胞悬液加入荧光标记抗体CD73、CD90、CD105及 CD34、CD45(Abcam公司,美国),染色30 min后上流式分析仪进行检测(BD,San Jose,CA,USA)。
1.5 C C K-8实验
取对数生长期NPSCs,3000个/孔的密度接种于96孔板内,每组样本均设5个复孔。分为对照组、TGF-β3组(20 ng/ml,Prospec公司,以色列)、BMP-2组(100 ng/ml,Prospec公司,以色列)和20 ng/ml TGF-β3+100 ng/ml BMP-2组。37℃、5%CO2条件下培养1、3、5、7 d,终止培养后PBS洗3次,每孔加入含10µl CCK-8试剂(Dojindo,日本)的培养基 110 µl,孵育1.5 h,酶标仪450 nm测定各孔吸光度(OD)值,取5孔平均值作为实验结果。实验重复3次。
1.6 诱导N M P S C s向类髓核细胞分化后阿利新蓝染色
取P3代NPSCs,按上述分组在培养基中加入不同组合细胞因子。诱导14 d后,取各组细胞,弃培养基,PBS清洗2遍,加入多聚甲醛固定12 h,阿利新蓝染液浸染4 h,倒置显微镜下观察细胞外基质表达。使用Image-j软件进行定量分析。
1.7 R T- P C R检测髓核特异基因的表达
分别在诱导7 d和14 d后取各组细胞,使用Trizol试剂(Invitrogen公司,美国)提取各组细胞总RNA,使用逆转录试剂盒(Takara公司,日本)按步骤将RNA逆转录为cDNA,实时定量PCR的反应体系为:cDNA模版1µl;上下游引物各1µl;反应工作液10µl;无菌双蒸水7µl;反应参数设置为95℃30 s预变性,95℃10 s,56℃30 s,共40个循环。检测目的基因为Aggrecan、SOX-9、Collagen-2、Krt19,内参基因为GADPH,各引物序列见表1。实验重复3次。

表1 P C R引物序列表
1.8 统计学方法
采用SPSS 19.0软件(Chicago,美国)进行统计学分析,计量资料以均数±标准差表示,组间比较采用单因素方差分析和t检验,以P<0.05为差异有统计学意义。
2 .结果
2.1 细胞生长状况及三系分化结果
P3代细胞与原代细胞形态一致,呈长梭形生长,形态均一,状态良好,折光性好。成功进行三系诱导分化,成骨诱导可见橘红色矿质结节,成脂诱导油红O染色可见脂滴形成,成软骨诱导(图1)。
2.2 流式细胞仪鉴定表面标志物结果
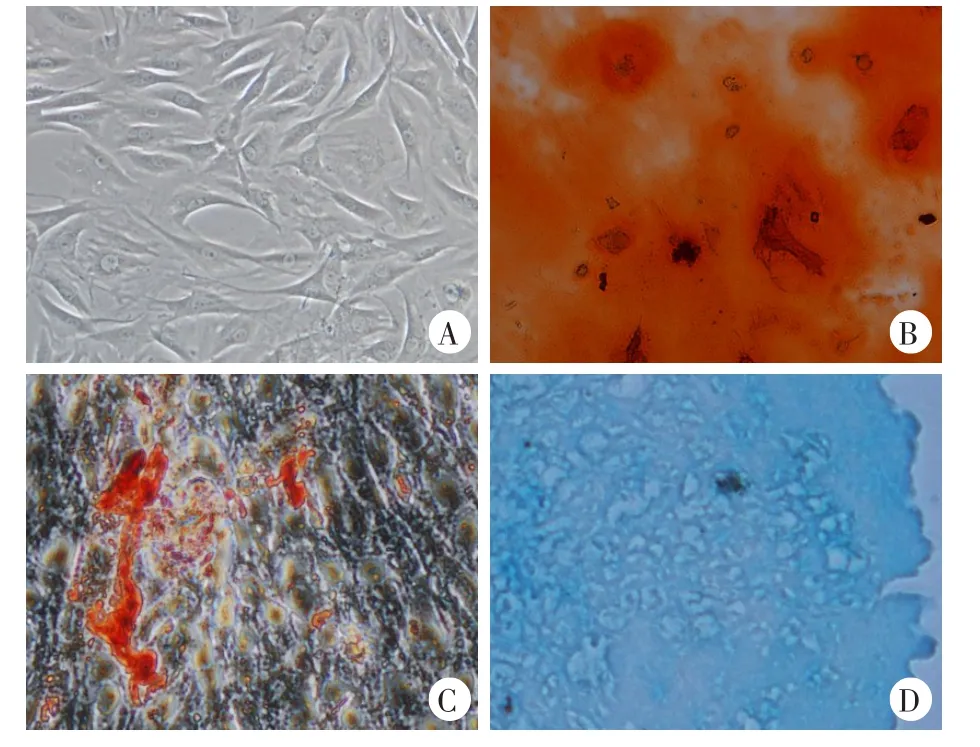
图1 细胞形态及三系分化结果

图2 各组细胞CCK-8增殖曲线
所获NPSCs高表达干细胞阳性标志物CD73、CD90、CD105,阳性率分别是97.26%~99.22%、98.0%~99.2%、95.33%~99.65%,阴性表达CD34、CD45,阴性率分别为1.51%~3.61%、2.89%~4.07%。
2.3 C C K-8检测各组细胞增殖水平
CCK-8结果显示,实验组从第3天开始其增殖水平高于对照组(P<0.05),实验组3组内增殖水平差异无统计学意义(P>0.05,图2)
2.4 R T- P C R检测各组7 d及14 d髓核细胞标志基因表达

图3 诱导7 d,RT-PCR检测各组细胞髓核特异基因SOX-9、COL2、Aggrecan、Krt19的表达相对量

图4 诱导14 d,RT-PCR检测各组细胞髓核特异基因SOX-9、COL2、Aggrecan、Krt19的表达相对量
RT-PCR结果显示,诱导7 d后,实验组髓核细胞标志基因(SOX-9、COL2、Aggrecan、Krt19)的表达均高于对照组,差异有统计学意义(P<0.05),而3个实验组各个基因表达量比较,差异无统计学意义。在诱导14 d后,实验组髓核细胞标记基因的表达仍高于对照组,联合使用TGF-β3和BMP-2组中各个基因的表达量明显高于其他3组(P<0.05,图3~4)。
2.5 阿利新蓝染色检测细胞外基质分泌
各组诱导14 d后,阿利新蓝染色结果显示,对照组仅有微弱的蛋白多糖分泌,实验组则均有大量蛋白多糖分泌,肉眼观察实验组蓝染面积及程度均高于对照组,使用Image-J软件定量分析后发现实验组均较对照组染色更深,联合使用TGF-β和BMP-2组较其他组蓝染程度更深(P<0.05),表明联合组蛋白多糖的分泌更多,NPSCs分化更优(图5~6)。
3 讨论
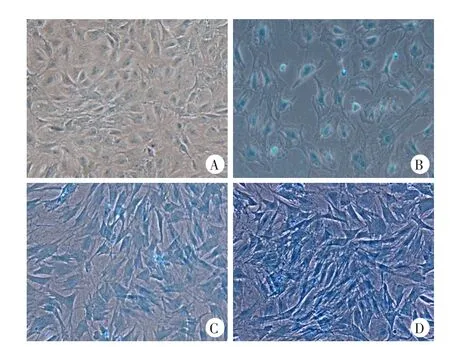
图5 诱导14 d后阿利新蓝染色结果
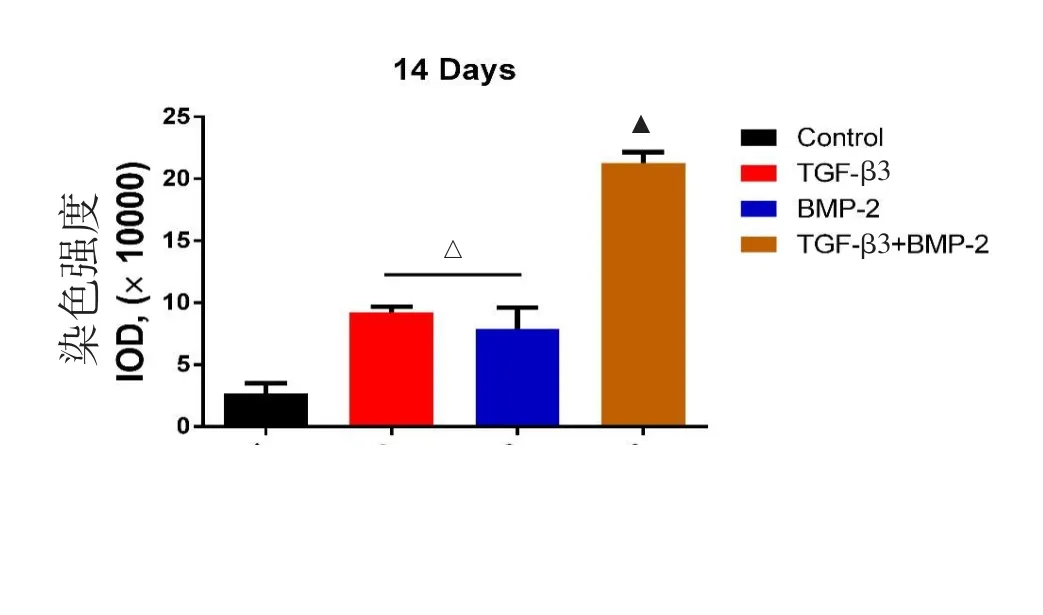
图6 Image-J定量分析蓝染程度
椎间盘是人体最大的无血管器官,其退变的一大特征是髓核细胞的减少,细胞外基质代谢失衡[10]。近年来,研究热点主要集中在利用细胞治疗、基因治疗、细胞因子治疗、组织工程等方法修复椎间盘退变。其中,组织工程被认为是最具有前景的治疗方法[11]。在构建组织工程髓核过程中,种子细胞及生长因子的选择仍尚未确定并需要继续探索。NPSCs是近年来新发现的存在于髓核组织内的一类间充质干细胞,相比利用其他组织来源的间充质干细胞如骨髓间充质干细胞、脂肪间充质干细胞等,NPSCs更能适应退变椎间盘复杂的内环境。有学者比较NPSCs与BMSCs生物学特性,发现NPSCs有更好的向类软骨细胞分化能力[12],此外,Han等[13]研究发现,相比脂肪间充质干细胞,NPSCs在酸性环境下活性更优。因此,利用髓核组织内部存在的髓核间充质干细胞修复退变椎间盘具有天然优势。本研究分离大鼠尾椎髓核组织内的髓核间充质干细胞,通过三系分化及干细胞表型检测,证实成功分离了NPSCs。
髓核细胞特性类似于软骨细胞,但又有差别,研究[14]显示,相对于软骨细胞髓核细胞高表达keratin19(Krt 19),配对盒基因1(PAX1)等脊索细胞特征性表型分子,且高表达转录因子SOX-9,细胞外基质蛋白如二型胶原COL2和蛋白多糖Aggrecan,而一型胶原COL1的表达较低。软骨细胞COL1和COL2的表达明显较高,而蛋白多糖的表达相对较低[15]。结合krt19、COL2、SOX-9及Aggrecan,可以将髓核细胞同软骨细胞区分开,因此在本研究中选取krt19、COL2、SOX-9及Aggrecan作为向髓核细胞分化的标志。
TGFb-3及BMP-2均属于TGF-β超家族成员,能够调控多种细胞生理功能,主要作用于细胞增殖及分化的进程。Colomiber研究[16]发现,联合TGF-β1和GDF5可以促进脂肪间充质干细胞向类髓核细胞分化。Zhou等[17]研究发现,单独使用BMP-3可以促进骨髓间充质干细胞增殖及向类髓核细胞分化,联合TGF-β则可以进一步促进髓核特异基因的表达。McCanless等[18]则利用藻酸盐支架、间充质干细胞和BMP-2复合构建出组织工程髓核。这些研究都表明了TGF及BMP在诱导干细胞向类髓核细胞分化中的重要调控作用。与上述研究相比,本研究也观察到类似现象,CCK-8及RT-PCR结果显示,两种细胞因子都能够促进髓核间充质干细胞增殖并促进其向类髓核细胞转化。但是相比于单独应用TGF-β3或BMP-2,两者联合使用在诱导14 d时能够明显提高NPSCs髓核特异基因的表达,因此具有协同作用。
TGF-β3及BMP-2主要通过与细胞表面受体TGF-βR和BMPR结合发挥作用。两种细胞因子与相应细胞表面受体结合后均可激活下游smad蛋白的表达,TGF-β家族主要磷酸化激活smad2/3,而BMP家族主要磷酸化激活smad1/5/8。但是,两种细胞因子能够共同激活smad4的表达,当两种细胞因子同时作用时有协同刺激smad4表达的效应[19]。此外,有研究[20]发现,TGF-β3与BMP-2联合使用时能够明显促进BMP-2受体BMPR-2的表达。故推测TGF-β3联合BMP-2明显提高NPSCs向类髓核细胞分化能力的机制可能与促进smad4蛋白和BMPR-2的表达有关。
综上,本研究成功分离NPSCs,并发现联合使用TGF-β3及BMP-2较单独使用能更有效诱导NPSCs向类髓核细胞分化。本研究存在局限之处,体外实验需要持续加入细胞因子,因此操作复杂且干扰因素多。除单独细胞因子外,三维环境对干细胞成软骨分化也有促进作用,下一步我们将采用病毒转染及三维支架材料进一步促进NPSCs向类髓核细胞分化。
