柑橘黄烷酮对β胡萝卜素胶束化的影响
2018-12-10,,,,3,*,,,3,*,,
,,,,3,*,,,3,*,,
(1.南京农业大学食品科技学院,江苏南京 210095; 2.江苏省农业科学院农产品加工研究所,江苏南京 210014; 3.国家蔬菜加工技术研发分中心,江苏南京 210014)
β-胡萝卜素是一种广泛存在于果蔬中的脂溶性营养成分[1],是具有VA活性最高的类胡萝卜素,具有抗癌、抗氧化、预防心血管疾病、防止晒伤等生理功能[2]。β-胡萝卜素只有被小肠吸收才能发挥其生物活性,研究发现,食物基质中的β-胡萝卜素在人体中生物利用率较低[3],热加工的橙色甘薯果肉中β-胡萝卜素生物利用率仅有0.5%~1.1%[4],机械加工联合油脂处理后南瓜中β-胡萝卜素的生物利用率低于5%[5]。因此,提高β-胡萝卜素生物利用率对VA缺乏人群具有重要意义。
影响类胡萝卜素生物利用率的因素主要包括食物基质环境、食品组分间相互作用、主体营养状况、遗传因素等[6]。目前,食品组分间相互作用的影响研究主要集中在脂类对β-胡萝卜素生物利用率的影响[7-8]。食物基质中的一些微量物质,如蔗糖酯、植物固醇类、膳食纤维等已证明可能会影响类胡萝卜素的生物利用率[9]。此外,不同种类类胡萝卜素在消化吸收过程中可能发生竞争性抑制,从而影响其生物利用率[10]。类黄酮是植物来源膳食中重要的微量营养成分[11],以每L柑橘汁为例,其含有橙皮苷约300~700 mg,而类胡萝卜素量约10~30 mg[12],在日常膳食中类黄酮不可避免地会与类胡萝卜素相互作用。近年来研究发现,类黄酮会影响类胡萝卜素吸收和生物利用率。Reboul等[13]发现,柚皮素显著降低叶黄素的肠道吸收,而槲皮素可以增加β-胡萝卜素在肝脏中的含量[14]。Marie 等[10]研究发现,葡萄汁中的柚皮苷降低橙色甘薯中β-胡萝卜素的生物利用率,但对β-胡萝卜素的肠道吸收没有显著影响。然而 Claudie等[15]研究发现,柑橘果汁中的类黄酮显著促进β-胡萝卜素的肠道吸收。以上研究主要集中在类黄酮对类胡萝卜素吸收影响的宏观调控层次上,两者的相互作用机制尚不明确。
类胡萝卜素的脂溶性特性使其需要被转化成水溶性的混合胶束才能通过水相,然后随胶束一起转移到小肠上皮细胞被吸收利用,因此类胡萝卜素的胶束化特性直接决定其生物利用率[16]。本研究选择柑橘属类黄酮中四种常见的黄烷酮,即橙皮素、柚皮素及其对应糖苷橙皮苷、柚皮苷,基于体外模拟研究4种柑橘黄烷酮对β-胡萝卜素胶束化的影响及调控机理,可以为其他植物源的类黄酮体外评价作出初步的判断,亦可为进一步研究β-胡萝卜素的高效利用提供理论依据。
1 材料与方法
1.1 材料与仪器
全反式β-胡萝卜素、来源于柑橘中的橙皮素、柚皮素、柚皮苷、芘 美国Sigma公司;来源于柑橘中的橙皮苷 Santa Cruz Biotechnology;胃蛋白酶(酶活力:3000 U/mg)、胰酶(酶活力:250 U/mg) 南京奥多福尼生物科技有限公司;胆盐 北京奥博星生物技术有限责任公司;正己烷、丙酮、无水乙醇、三氯甲烷(均为国产分析纯) 国药集团化学试剂有限公司;甲基叔丁基醚(methyl tert-butyl ether,MTBE)、甲醇(均为色谱纯) 美国Javascript公司;卵磷脂、油酸甘油酯 山东西亚化学股份有限公司;人结肠腺癌细胞株(Caco-2) 中国科学院上海细胞库;高糖DMEM培养液、青-链霉素双抗液、胎牛血清、0.25%胰酶-EDTA、磷酸盐缓冲液(PBS) 赛默飞世尔生物化学制品有限公司;BCA蛋白浓度测定试剂盒 上海碧云天生物公司;细胞培养瓶T25、6孔transwell细胞培养板 美国康宁公司。
HZQ-F100全温度振荡培养箱 太仓市华美生化仪器厂;TG16-WS台式高速离心机 湖南长沙湘仪离心机仪器有限公司;FE20实验室pH计 梅特勒-托利多仪器上海有限公司;BS224S电子分析天平 北京赛多利斯科学仪器公司;RE52CS旋转蒸发仪、D10氮气吹扫仪 杭州奥盛仪器有限公司;1200高效液相色谱仪 美国安捷伦科技有限公司;DW-86L828型超低温冰箱 青岛海尔股份有限公司;Cary Eclipse分子荧光光谱仪 美国瓦里安公司;MZS90纳米粒度测定仪 英国马尔文仪器有限公司;XD-202倒置显微镜 南京江南永新光学有限公司;BHC-1300IIA/B2型生物洁净安全柜 苏州净化设备有限公司;TDL-80-2C低速台式离心机 上海安亭科学仪器厂;ERS-2上皮跨膜细胞电阻仪 美国密理博公司。
1.2 实验方法
1.2.1β-胡萝卜素胶束溶液的制备 参考文献[10]并作出调整。取适当体积的β-胡萝卜素储备液制成5 μmol/L的工作液(人体正常生理状态下β-胡萝卜素浓度约为5 μmol/L,溶剂为三氯甲烷∶甲醇=2∶1),4种黄烷酮(甲醇)的工作液浓度分别为25 μmol/L[17],在氮气下吹干大部分有机溶剂,残余溶剂于真空条件下室温干燥24 h过夜除去,加入5 mL胆盐溶液,于37 ℃恒温培养箱中150 r/min 振荡5 h,5000×g离心10 min得到上清液,上清液过0.22 μm有机滤膜过滤制成胶束。
1.2.2 胆盐、脂类存在下柑橘黄烷酮对β-胡萝卜素胶束化率的影响 按1.2.1方法制备β-胡萝卜素胶束。胶束中胆盐浓度分别选择5、10、15 mmol/L,研究胆盐存在下柑橘黄烷酮对β-胡萝卜素胶束化率的影响。在胆盐浓度为15 mmol/L胶束中添加油酸甘油酯或卵磷脂,研究脂类存在下柑橘黄烷酮对β-胡萝卜素胶束化率的影响。β-胡萝卜素胶束化率的测定参考1.2.4。
1.2.3 黄烷酮在不同浓度胆盐溶液中的溶解度 分别称取一定量的4种黄烷酮纯品,加入5 mL 胆盐溶液,使之最后形成饱和溶液。胆盐浓度梯度:5、10、15、30 mmol/L,于37 ℃恒温培养箱中150 r/min 振荡5 h,于5000×g离心10 min得到上清液,上清液过0.22 μm有机滤膜得到黄烷酮-胆盐溶液。提取黄烷酮方法参考文献[18],提取后待HPLC分析。
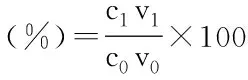
式中:c1为溶液中黄烷酮的摩尔浓度(μmol/L);c0为初始加入黄烷酮的摩尔浓度(μmol/L);v1为溶液体积(mL);v0为初始加入黄烷酮的体积(mL)。
黄烷酮液相色谱条件[19]:色谱柱:Agilent Eclipse XDB-C18(250 mm×4.6 mm,5 μm);柱温30 ℃;进样体积 10 μL;流速 1.0 mL/min;检测波长为 287 nm。以乙腈-0.1%甲酸水溶液为流动相。
1.2.4β-胡萝卜素胶束化率的测定
1.2.4.1β-胡萝卜素标准曲线的制作 准确称量10 mgβ-胡萝卜素溶解定容至10 mL,取适量体积储备液稀释制成0.5、1、2、4、8、10、20 μg/mL的标准液,待HPLC分析,以对应的峰面积为纵坐标,制成标准曲线。
1.2.4.2β-胡萝卜素的萃取 避光条件下,在胶束中加入等体积萃取剂(正己烷∶乙醇∶丙酮=2∶1∶1,V/V/V),轻微振荡,静置分层;反复萃取至下层无色,合并萃取液,旋转蒸发,氮气吹干,用正己烷溶解,待HPLC分析。
1.2.4.3 HPLC条件 色谱柱为YMC-C30(4.6 mm×250 mm,5 μm)色谱柱;柱温:25 ℃;检测器DAD,波长450 nm,流动相:A:V(水∶MTBE∶甲醇)=5∶2 5∶70;B:V(水∶MTBE∶甲醇)=5∶85∶10;进样量 20 μL;线性梯度洗脱,流速为0.6 mL/min,梯度洗脱程序:0~4.5 min 95%~80% A;4.5~12.5 min 80%~50% A;12.5~18 min 50%~25% A;18~24 min 25%~5% A;24~30 min 5% A;30~35 min 5%~95% A。
1.2.4.4β-胡萝卜素胶束化率的计算
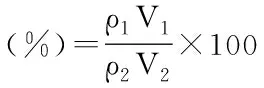
式中:ρ1为胶束中β-胡萝卜素的质量浓度(μg/mL);ρ2为初始加入β-胡萝卜素浓度(μmol/L);V1为胶束体积(mL);V2为β-胡萝卜素工作液体积(mL)。
1.2.5 胶束溶液物化性质的测定
1.2.5.1 胶束溶液极性的测定 参考文献[20],取制备的胶束溶液,加入适量芘溶液(无水乙醇),芘最终浓度为8×10-7mol/L,充分振荡均匀,静置3 h 后进行荧光扫描,记录芘的发射光谱中第1、3个峰的荧光强度:I1和I3值。荧光光谱测定条件:荧光激发波长 334 nm,激发狭缝宽度为5 nm,发射狭缝宽度为1 nm,发射波长范围为350~450 nm,测定在室温下进行。
1.2.5.2 胶束溶液粒径、电位的测定 取制备的胶束溶液,利用纳米粒度测定仪室温条件下进行粒径分布测定,结果以平均粒径(nm)表示,同时进行ζ-电位测定。
1.2.6β-胡萝卜素生物可利用率的测定 该方法参考文献[16,21],并作出调整。胃消化法:加入10 mL胃液(50 mmol/L NaCl、3.60 mmol/L MgCl2·6H2O、10 mmol/L CaCl2·2H2O、3.50 mmol/L KH2PO4、14 mmol/L KCl),用1 mol/L HCl调节pH至2.0,加入2 mL胃蛋白酶液(50.25 mg/mL,胃蛋白酶溶于0.1 mol/L HCl)保鲜膜封口放入摇床,于37 ℃恒温培养箱中120 r/min消化1 h。
肠消化法:取出锥形瓶,用1 mol/L NaHCO3调节pH至6.90±0.01,加入9 mL胆盐-胰酶液(胆盐终浓度为15 mmol/L(见2.1.1)、胰酶终浓度2.4 mg/mL;胆盐、胰酶溶于0.1 mol/L NaHCO3),封口放入摇床,于37 ℃恒温培养箱中120 r/min消化2 h。
上述消化过程结束后于5 000×g离心10 min得到上清液,上清液过0.22 μm有机滤膜得到胶束,用于分析β-胡萝卜素生物可利用率。
式中:c1为上清液过滤后胶束中β-胡萝卜素的质量浓度(μg/mL);c2为初始加入β-胡萝卜素浓度(μmol/L);V1为上清液过滤后胶束体积(mL);V2为β-胡萝卜素工作液体积(mL。)
1.2.7β-胡萝卜素体外吸收率的测定 Caco-2细胞培养在含10%胎牛血清、1%青-链霉素双抗液的高糖DMEM完全培养基中,置于5% CO2浓度,37 ℃恒温培养箱条件下生长。用含0.25%胰蛋白酶-EDTA溶液消化成单个细胞悬液后以2×105个/mL接种transwell的聚碳酸酯膜上,培养21 d使用[15]。通过测量各孔跨膜电阻来检测细胞单层膜的完整性,当teer值>500 Ω·cm2可用于β-胡萝卜素吸收实验。实验前,细胞单层膜先用PBS清洗两遍,向顶侧加入1 mL体外消化后形成的混合胶束,底侧加入2 mL 无血清培养基,于5% CO2浓度,37 ℃恒温培养箱培养24 h。培养时间结束,收集两侧培养液。β-胡萝卜素的吸收量为底侧和刮取的细胞总量。细胞吸收以每毫克蛋白中皮摩尔(pmol/mg prot)β-胡萝卜素量表达,采用BCA试剂盒法检测蛋白浓度。
1.3 数据处理
所有实验重复3次。用SPSS 17.0数据分析软件,对实验结果进行单因素试验统计分析及组间差异的Duncan’s多重比较。
2 结果与分析
2.1 胆盐存在下4种柑橘黄烷酮对β-胡萝卜素胶束化率的影响
2.1.1 不同胆盐浓度下4种柑橘黄烷酮对β-胡萝卜素胶束化率的影响 胆盐是影响类胡萝卜素胶束化率的主要因素之一。人体在禁食、进食状态下由胆汁分泌的胆盐浓度分别为4~6、10~15 mmol/L[22-23]。本实验研究4种柑橘黄烷酮在胆盐浓度为5、10、15 mmol/L条件下对β-胡萝卜素胶束化率的影响,研究结果如图1所示。β-胡萝卜素的胶束化率随胆盐浓度升高而增加,由β-胡萝卜素标准曲线方程式:y=410.68x-409.34(R2=0.9996)计算,当胆盐浓度达到15 mmol/L 时,β-胡萝卜素的胶束化率为16.23%,分别是胆盐浓度为5、10 mmol/L的2.50、1.70倍,这是因为,胆盐的乳化特性加快溶解了处于颗粒内及界面的β-胡萝卜素,从而提高其胶束化率[24]。当胆盐浓度为5、10 mmol/L时,4种柑橘黄烷酮对β-胡萝卜素胶束化率无显著影响(p>0.05)。当胆盐浓度达到15 mmol/L 时,胶束中4种柑橘黄烷酮的加入使β-胡萝卜素胶束化率显著升高(p<0.05),其中橙皮素、橙皮苷、柚皮素加入后β-胡萝卜素胶束化率比单一β-胡萝卜素胶束化率分别显著提高了25.00%、48.55%、18.97%(p<0.05),而柚皮苷对β-胡萝卜素的胶束化率促进作用不显著(p>0.05)。
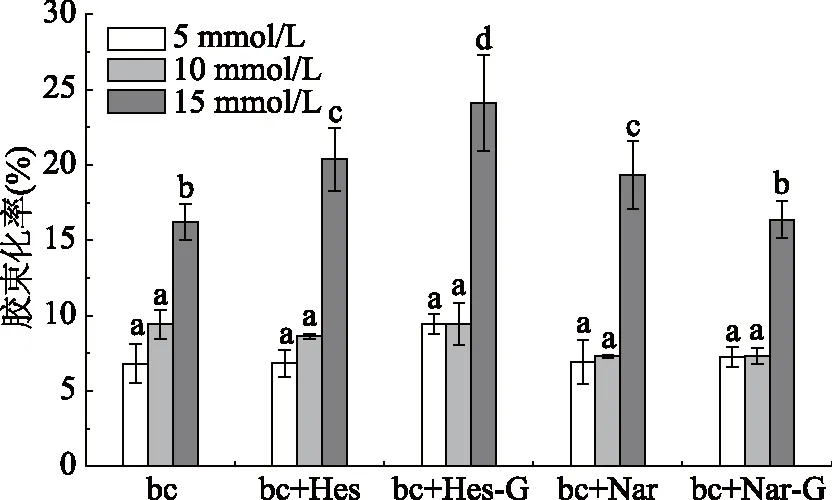
图1 不同胆盐浓度下4种柑橘黄烷酮对β-胡萝卜素胶束化率的影响Fig.1 Effect of 4 citrus flavanones on the micellization rate of β-carotene under different bile salts concentrations注:不同小写字母表示差异显著(p<0.05);bc:β-胡萝卜素;Hes:橙皮素;Hes-G:橙皮苷;Nar:柚皮素;Nar-G:柚皮苷;图3~图4同。
2.1.2 不同胆盐浓度下4种柑橘黄烷酮的溶解度 4种柑橘黄烷酮在不同浓度胆盐溶液中溶解度的研究结果如图2所示。结果表明,橙皮素、橙皮苷、柚皮素在不同浓度胆盐溶液中的溶解度变化不明显,而柚皮苷的溶解度与胆盐浓度呈线性关系(R2=0.9935),在胆盐浓度5 mmol/L时,胶束中的柚皮苷的溶解度为56.42%,15 mmol/L时达到68.45%,30 mmol/L时达到75.56%。对比图1的研究结果表明,柚皮苷溶解到胶束中可能竞争性地消耗了胆盐,从而抑制了β-胡萝卜素的胶束化率。这与Marie等的研究观点一致[10]。同时发现,橙皮苷在胆盐胶束中几乎不溶,而图1研究发现,橙皮苷对β-胡萝卜素胶束化率促进作用最显著(p<0.05),这表明,橙皮苷的加入可能改变了β-胡萝卜素胆盐胶束的理化性质,从而促进了β-胡萝卜素胶束化率。
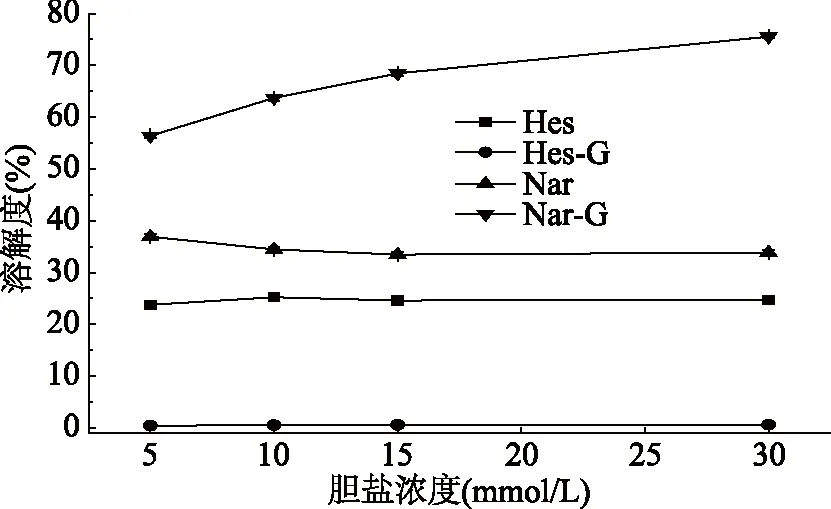
图2 不同胆盐浓度溶液中4种柑橘黄烷酮的溶解度Fig.2 Solubilization of 4 citrus flavanones in different bile salt concentration solutions
2.2 脂类存在下4种柑橘黄烷酮对β-胡萝卜素胶束化率的影响
类胡萝卜素在被人体吸收前,其混合胶束的形成取决于肠内脂类的含量和性质。不同研究得出的类胡萝卜素生物利用率差别很大,很有可能是模拟消化过程中所用脂类的种类和含量不同引起的[9]。
本实验根据人体正常生理状态下的情况,选择油酸甘油酯(1.5 mmol/L)和卵磷脂(3 mmol/L),研究添加不同脂类条件下4种柑橘黄烷酮对β-胡萝卜素胶束化率的影响,研究结果如图3所示。在胆盐浓度选用15 mmol/L时,在β-胡萝卜素对照组加入卵磷脂比不加卵磷脂(图1)增加了β-胡萝卜素的胶束化率,此时β-胡萝卜素的胶束化率达到20.18%,比不加卵磷脂增加了24%。在添加卵磷脂条件下,4种柑橘黄烷酮均促进了β-胡萝卜素胶束化,其中橙皮苷促进作用显著(p<0.05),β-胡萝卜素胶束化率可达25.17%,与单一β-胡萝卜素胶束相比,增加了25%。当胶束相中添加油酸甘油酯时,β-胡萝卜素对照组的胶束化率仅为9.23%,但4种柑橘黄烷酮均促进β-胡萝卜素胶束化率,其中橙皮苷、柚皮素、柚皮苷显著促进其胶束化率(p<0.05)。类胡萝卜素生物利用度与胶束溶解能力及胶束膨胀能力有关,高浓度胆盐的作用是增加胶束的溶解性,而脂类的作用是影响胶束的膨胀能力。本实验中添加的油酸甘油酯可能在水解过程中仅引起较小的程度的胶束溶胀,从而导致β-胡萝卜素胶束化率增加不明显。
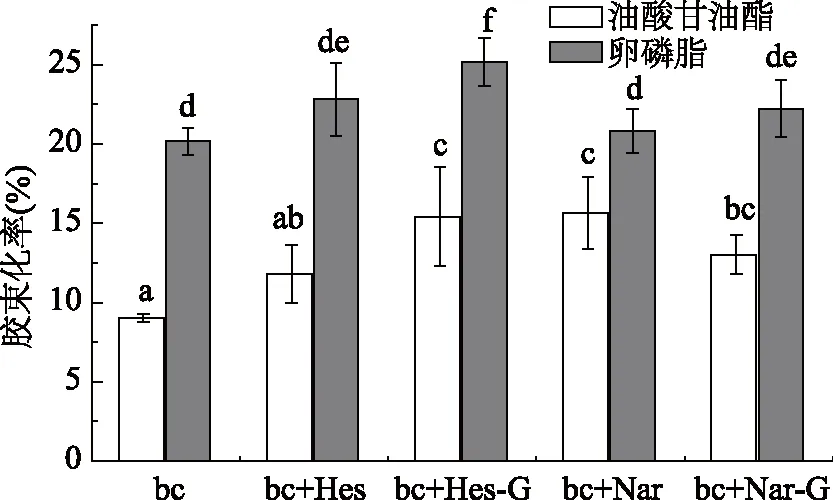
图3 脂类存在下4种柑橘黄烷酮对β-胡萝卜素胶束化率的影响Fig.3 Effect of 4 citrus flavanones on the micellization rate of β-carotene in the presence of lipids
2.3 4种柑橘黄烷酮对β-胡萝卜素胶束物化性质的影响
胶束的物化性质包括溶液极性(反应亲/疏水性)、粒径(反应颗粒大小)、电位(ζ-电位、反应粒子表面的电荷)等。本实验探究了4种柑橘黄烷酮对β-胡萝卜素胶束溶液物化性质的影响,结果如表1所示。芘是荧光探针中最常用的一种,根据芘的发射光谱中第1、3个发射峰的强度之比 I1/I3 的相对变化可以判断环境极性的变化,极性越大则比值越大,反之则比值越小[25]。研究发现,与单一β-胡萝卜素胶束溶液相比,胶束体系中加入柑橘黄烷酮后溶液的I1/I3比值均增大,即4种黄烷酮显著增加了胶束溶液的极性(p<0.05),其中橙皮苷加入的β-胡萝卜素胶束溶液I1/I3比值最大,表明橙皮苷最显著增加了β-胡萝卜素胶束溶液的极性(p<0.05),而且4种柑橘黄烷酮的加入均使β-胡萝卜素胶束溶液的粒径减小,橙皮素没有显著降低胶束粒径(p>0.05),而橙皮苷、柚皮素、柚皮苷显著降低胶束粒子的直径(p<0.05)。这可能是因为,柑橘黄烷酮吸附于油水表面,使β-胡萝卜素脂滴之间产生排斥力,这就避免了β-胡萝卜素脂滴的聚集,从而使胶束粒径减小[26]。此外,4种柑橘黄烷酮的加入均使β-胡萝卜素胶束溶液ζ-电位的绝对值显著增大(p<0.05)。ζ-电位的绝对值较高,表明液滴表面的同种电荷含量较高,彼此间的静电斥力保证溶液在储存期间发生液滴扰动,因此稳定性较强[27],表明4种柑橘黄烷酮的加入提高了β-胡萝卜素胶束溶液的稳定性[28]。
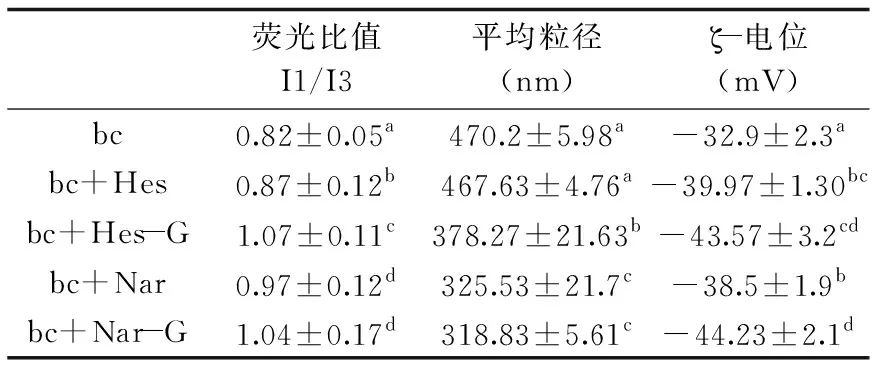
表1 4种柑橘黄烷酮对β-胡萝卜素胶束物化性质的影响Table 1 Effect of 4 citrus flavanones on β-carotene micellar properties
2.4 4种柑橘黄烷酮对β-胡萝卜素生物可利用率的影响
本实验通过体外消化法研究4种柑橘黄烷酮对β-胡萝卜素生物可利用率的影响,结果如图4显示。4种柑橘黄烷酮对β-胡萝卜素的生物可利用率均起促进作用,其中橙皮苷显著促进β-胡萝卜素的生物可利用率(p<0.05),达11.39%,对β-胡萝卜素的生物可利用率提高了42%。本研究在胶束体系中加入的黄烷酮,可能竞争了β-胡萝卜素在胶束的核心区域,但4种柑橘黄烷酮的加入使得β-胡萝卜素胶束溶液极性增大,粒子极性越大,越有利于进入消化液体系[29],从而提高了β-胡萝卜素的生物可利用率。此外,4种柑橘黄烷酮的加入使得体系中颗粒直径减小,从而导致颗粒表面积增大,颗粒表面积越大,越有利于胰脂肪酶的结合,从而有利于脂酶高效水解脂类,促进β-胡萝卜素转移进水相,提高生物可利用率[30]。
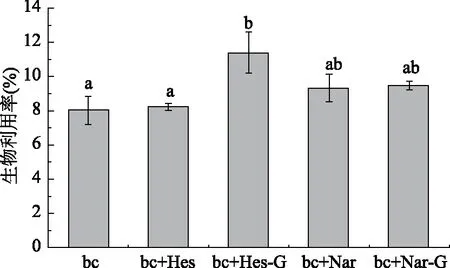
图4 4种柑橘黄烷酮对β-胡萝卜素的生物可利用率的影响Fig.4 Effect of 4 citrus flavanones on the bioaccessibility of β-carotene
2.5 4种柑橘黄烷酮对β-胡萝卜素体外肠道吸收的影响
将消化过程形成的胶束加入到分化的Caco-2细胞单层膜,研究4种柑橘黄烷酮对β-胡萝卜素肠道吸收的影响,研究结果如表2所示。4种柑橘黄烷酮均促进了β-胡萝卜素的细胞吸收。对照组β-胡萝卜素的细胞吸收为1420.00 pmol/mg prot,加入橙皮苷的胶束中β-胡萝卜素细胞吸收为2629.27 pmol/mg prot,比对照组显著提高了85%(p<0.05),而橙皮素显著提高了16%(p<0.05),柚皮苷对β-胡萝卜素的细胞吸收促进作用不显著(p>0.05)。这可能由于橙皮苷的糖苷基(7号位芸香糖苷),使橙皮苷结合于脂质膜的极性头部区域[31],橙皮苷强的膜亲和力改变了膜双分子层的屏障功能,促进β-胡萝卜素的细胞吸收,此外柑橘黄烷酮的加入使β-胡萝卜素胶束粒径变小,粒径越小,越有利于颗粒的乳化[32]、包裹及吸收[21,33],使β-胡萝卜素胶束更容易被细胞吸收。而柚皮苷由于包埋到胶束中,抑制了脂肪酸的水解及β-胡萝卜素从胶束中向外转移,所以对β-胡萝卜素细胞吸收促进作用不显著。
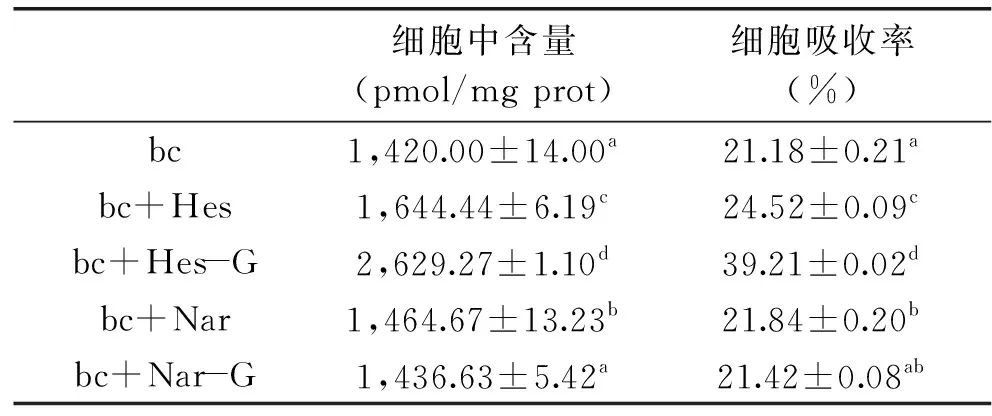
表2 4种柑橘黄烷酮对β-胡萝卜素肠道吸收的影响Table 2 Effect of 4 citrus flavanones on the cellular uptake of β-carotene
3 结论
在模拟人体生理状态下,随胆盐浓度升高,4种柑橘黄烷酮显著增加β-胡萝卜素的胶束化(p<0.05);其中橙皮苷对β-胡萝卜素胶束化的促进作用显著(p<0.05),橙皮素、柚皮素次之,柚皮苷作用不显著(p>0.05)。4种柑橘黄烷酮通过增加胶束溶液的极性、降低颗粒直径、调节胶束表面的电荷促进了β-胡萝卜素生物可利用率,进而促进β-胡萝卜素肠道吸收,其中橙皮苷显著促进β-胡萝卜素生物可利用率(p<0.05),相比于对照组提高了42%,并且显著促进肠道吸收(p<0.05)。由此可见,膳食中类黄酮的摄入一定程度上会促进β-胡萝卜素生物利用率。柑橘黄烷酮对β-胡萝卜素生物利用率及细胞吸收的影响受多种因素控制,因此具体的调控机制还需要进一步研究。
