高压静电场法制备壳聚糖-L-苯丙氨酸微囊
2018-12-10郝栋李咏歌刘欣
郝栋,李咏歌,刘欣,*
(1.唐山师范学院化学系,河北唐山063000;2.唐山师范学院生命科学系,河北唐山063000)
微囊技术已经广泛应用于农业、医药、石油、食品、印刷、印染以及生活日用品等方面,目前,国内外已经有数十种药物被包裹成微囊制成各种制剂[1]。对药物进行微囊化可以达到缓释、靶向的目的[2-3],同时掩盖药物不良气味及口味、提高药物稳定性、防止药物在胃内失活以及减少对胃的刺激性。
壳聚糖是由蟹、虾外壳中的甲壳素脱乙酰基后得到的一种带正电荷的直链多糖,也是唯一的碱性多糖[4]。由于具有良好的生物相容性、易降解性,以及无毒、抑菌、生物黏着性好等特点[5-6],这一性质常用于壳聚糖微球的制备[7-8]。壳聚糖在药物载体方面有着广阔的应用前景。
苯丙氨酸(L-phenylalanine)为无色至白色片状晶体或白色结晶性粉末,是一种营养增补剂,是必需氨基酸之一。在医药行业主要用于生产氨基酸输液和合成氨基酸类药物,在食品行业主要用于合成甜味剂阿斯巴甜[9]。
采用高压静电场法制备微囊,可显著改善微囊外形,提高微囊包封率和载药量,提高生产效率[10],在电场力的作用下溶液被破碎成更小的雾滴,雾滴的直径分布更加均匀[11],是一种实用可行、适于工业化生产微囊的方法。本文采用高压静电场法,以壳聚糖为囊材、L-苯丙氨酸作为芯材制备了壳聚糖-L-苯丙氨酸微囊。
1 材料与方法
1.1 仪器与试剂
CZGF-120 kV/2 mV直流高压发生器:扬州宝测电气有限公司;Sigma 300场发射扫描电镜:德国卡尔蔡司公司;UV-2550紫外可见分光光度计:日本岛津公司;85-2A数显恒温磁力搅拌器:常州澳华仪器有限公司;KQ-400KED高功率数控超声波清洗器:昆山市超声仪器有限公司;30、40、60目的标准筛:浙江上虞市五四建材仪器厂;AR1140电子分析天平:上海奥豪斯国际贸易有限公司。
L-苯丙氨酸(分析纯):天津市光复精细化工研究所;壳聚糖(DAC>90%):济南海德贝海洋生物工程有限公司;试验用水为去离子水;其他试剂为分析纯。
1.2 溶液的配制
壳聚糖溶液的配制:称取壳聚糖5.000 g于100 mL小烧杯中,先加入100 mL水搅拌均匀,再加入6 mL左右的冰乙酸搅拌均匀,配成5%的壳聚糖溶液,超声波仪中分散30 min,放置24 h备用。
微囊用L-苯丙氨酸溶液的配制:分别称量一定量的L-苯丙氨酸固体,加入适量水加热溶解,定容,摇匀,配制成质量分数分别为0.5%、1.0%、1.5%、2.0%的L-苯丙氨酸溶液,备用。
L-苯丙氨酸标准溶液的配制:称取一定量的L-苯丙氨酸固体粉末,加热溶解,冷却到室温后,定容,摇匀,配制质量分数为分别为0.10%、0.30%、0.50%、0.70%、0.90%的L-苯丙氨酸标准溶液。
分别配制浓度为 0.50、0.75、1.0、1.5、2.0 mol/L 的氢氧化钠溶液,备用。
1.3 试验方法
壳聚糖在强碱氢氧化钠中会固化成小球,并且所成的小球大小均匀,表面光滑圆润。试验过程中将不同浓度的壳聚糖溶液与不同浓度的L-苯丙氨酸混合,加入到注射器中在高压静电的作用下,溶液克服表面张力和粘滞力[12],进而被击碎成雾滴,下落到注射器底部的盛有氢氧化钠的烧杯中凝固成球。
1)L-苯丙氨酸微囊包封率的测定

式中:ψ1为微囊中 L-苯丙氨酸的质量,g;ψ2为投加料中L-苯丙氨酸的质量,g。
2)药物含量的计算

式中:з1为微囊中 L-苯丙氨酸的质量,g;з2为所称得的微囊样品的质量,g。
3)微囊粒径分布计算

式中:x1为某一粒径范围的L-苯丙氨酸微囊的总质量,g;x2为L-苯丙氨酸微囊的总质量,g。
2 结果与分析
2.1 单因素试验确定最佳制备条件
2.1.1 L-苯丙氨酸标准曲线的绘制
绘制L-苯丙氨酸标准曲线,如图1所示。利用此曲线计算微囊中L-苯丙氨酸的含量。

图1 标准曲线Fig.1 Standard curve
2.1.2 氢氧化钠浓度对高压静电场法制备微囊的影响
在温度30℃、壳聚糖浓度5%、L-苯丙氨酸浓度1.00%、转速450 r/min、电压15 kV、下滴高度11 cm的条件下,改变氢氧化钠浓度依次为 0.50、0.75、1.0、1.5、2.0 mol/L,制备L-苯丙氨酸微囊,试验结果如图2所示。
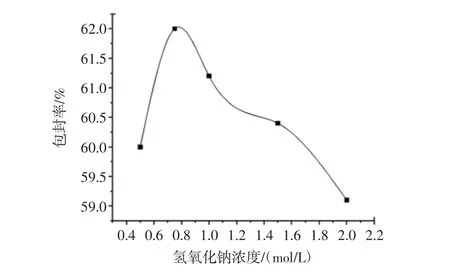
图2 氢氧化钠浓度对制备微囊的影响Fig.2 Effect of sodium hydroxide concentration on preparation of microcapsules
试验结果表明:当氢氧化钠浓度为0.75 mol/L时,L-苯丙氨酸微囊的包封率最高,所以制备微囊时选择氢氧化钠浓度为0.75 mol/L。
2.1.3 壳聚糖浓度对高压静电场法制备微囊的影响
在温度30℃,氢氧化钠浓度0.75 mol/L,L-苯丙氨酸浓度1.0%,转速450 r/min,电压15 kV,下滴高度11 cm的条件下,改变壳聚糖浓度依次为1.0%、2.0%、3.0%、4.0%、5.0%,制备L-苯丙氨酸微囊,试验结果如表1所示。

表1 壳聚糖浓度对制备微囊的影响Table 1 Effect of chitosan concentration on preparation of microcapsules
试验结果表明:在制备微囊的过程中,当壳聚糖浓度为1.0%、2.0%、3.0%时,微囊均难以成型,呈细丝或者片状。随着壳聚糖浓度的增加,微囊成型良好,但壳聚糖浓度大于5%时黏度太大,造粒困难,因此,制备微囊的较佳壳聚糖浓度为5.0%。
2.1.4 L-苯丙氨酸浓度对高压静电场法制备微囊的影响
在温度30℃,氢氧化钠浓度0.75 mol/L,壳聚糖浓度5.0%,转速450 r/min,电压15 kV,下滴高度11 cm的条件下,改变L-苯丙氨酸浓度依次为0.5%、1.0%、1.5%、2.0%,制备L-苯丙氨酸微囊,试验结果如图3所示。

图3 L-苯丙氨酸浓度对制备微囊的影响Fig.3 Effect of L-phenylalanine concentration on preparation of microcapsules
试验结果表明:微囊的包封率随着L-苯丙氨酸浓度的增加呈正态分布趋势,当L-苯丙氨酸浓度为1.0%时,微囊的包封率最高,此时制得的微囊最圆整,因此制备微囊的较佳L-苯丙氨酸浓度为1.0%。
2.1.5 电压强弱对高压静电场法制备微囊的影响
在温度30℃,氢氧化钠浓度0.75 mol/L,壳聚糖浓度5.0%,转速450 r/min,L-苯丙氨酸浓度1.0%,下滴高度11 cm的条件下,改变电压大小依次为5、10、15、20、25 kV,制备L-苯丙氨酸微囊,试验结果表2所示。

表2 电压对制备微囊的影响Table 2 Effect of voltage on preparation of microcapsules
试验结果表明:电压对微囊包封率影响不大,但是随电压的升高制备微囊的速度越快、微囊颗粒越小,因此选择电压最佳条件为25 kV。
2.1.6 温度对高压静电场法制备微囊的影响
在氢氧化钠浓度0.75 mol/L,壳聚糖浓度5.0%,转速450 r/min,电压25 kV,L-苯丙氨酸浓度1.0%,下滴高度11 cm的条件下,改变温度大小依次为20、30、40、50、60℃,制备L-苯丙氨酸微囊,试验结果如图4所示。

图4 温度对制备微囊的影响Fig.4 Effect of temperature on preparation of microcapsules
试验结果表明:当温度为30℃时微囊的包封率最高,因此选择制备微囊的温度为30℃。
2.1.7 转速对高压静电场法制备微囊的影响
在上述最佳条件下,改变转速依次为250、350、450、550、650 r/min,制备 L-苯丙氨酸微囊,试验结果如图5所示。
试验结果表明:当转速为450 r/min时,微囊的包封率最高,且制得的微囊大小均一,因此制备微囊的最佳转速为450 r/min。

图5 转速对制备微囊的影响Fig.5 Effect of rotation rate on preparation of microcapsules
2.1.8 下滴高度对高压静电场法制备微囊的影响
在上述最佳条件下,改变下滴高度依次为5、8、11、14 cm,制备L-苯丙氨酸微囊,试验结果如表3所示。

表3 下滴高度对制备微囊的影响Table 3 Effect of dropping height on preparation of microcapsules
综合微囊的形态与包封率2个指标考虑,试验选择制备微囊的较佳下滴高度为11 cm。
2.2 正交试验确定最佳制备条件
根据单因素试验确定的较佳工艺条件,选择3个对L-苯丙氨酸微囊包封率影响较大的因素,分别为温度、L-苯丙氨酸浓度、壳聚糖浓度。配制浓度分别为3.0%(C1)、4.0%(C2)、5.0%(C3)的壳聚糖溶液,质量分数分别为 0.5%(B1)、1.0%(B2)、1.5%(C3) 的 L-苯丙氨酸溶液,温度分别为 20 ℃(A1)、30 ℃(A2)、40 ℃(A3)。在最佳的转速、电压、氢氧化钠浓度、下滴高度条件下,根据三因素三水平正交表进行正交试验,选择制备微囊的较佳条件,试验结果如表4所示。

表4 正交试验分析表Table 4 Orthogonal test analysis table
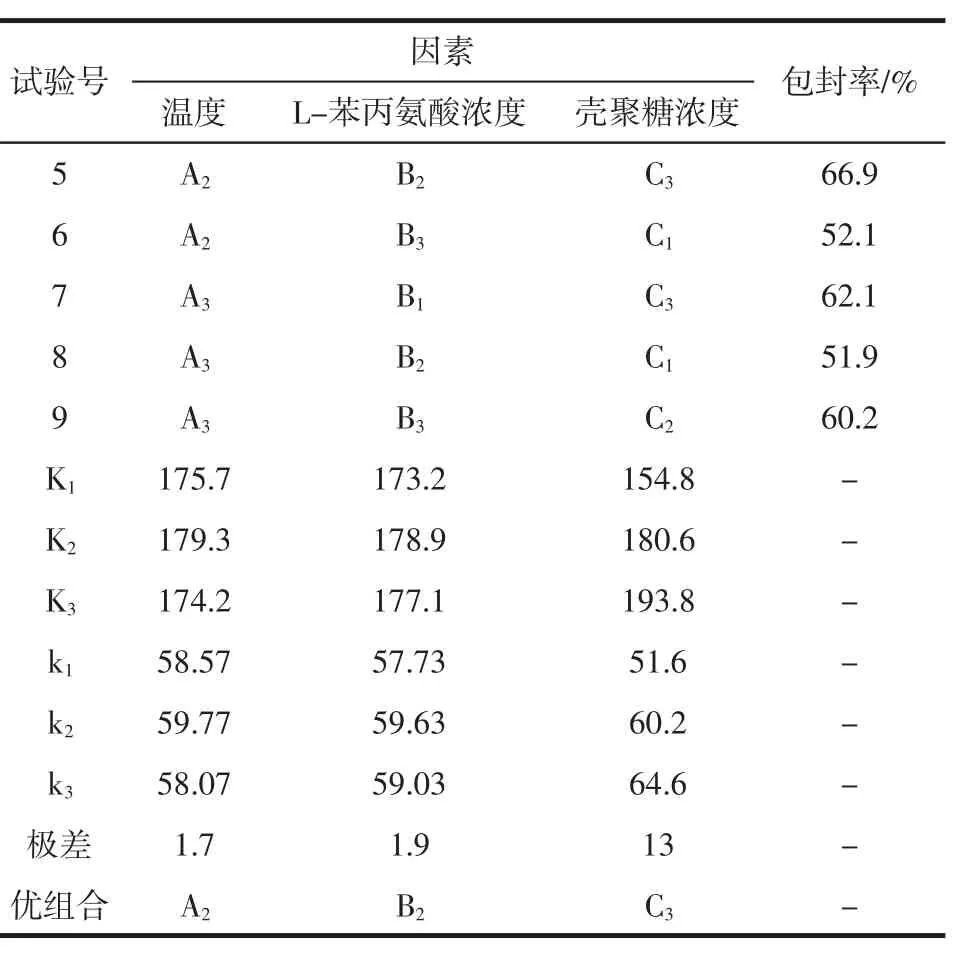
续表4 正交试验分析表Continue table 4 Orthogonal test analysis table
试验结果表明:选取的3个因素中对微囊包封率大小的影响的主次为:壳聚糖浓度>L-苯丙氨酸浓度>温度。正交试验的最优组合为A2B2C3,即温度30℃,L-苯丙氨酸浓度1.0%,壳聚糖浓度5.0%时制得的微囊的包封率最大,微囊化效果最好。
2.3 微囊的性能评价
2.3.1 L-苯丙氨酸微囊的包封率
微囊的包封率是评价微囊质量的重要指标之一[11],在最佳条件下制备L-苯丙氨酸微囊的包封率为66.9%。
2.3.2 L-苯丙氨酸微囊的药物含量测定
对L-苯丙氨酸微囊样品进行测定,根据公式2计算得出微囊中L-苯丙氨酸的药物含量为0.37%。
2.3.3 L-苯丙氨酸微囊的粒径分布
制得的微囊的粒径分布如图6所示。
从图6可以看出,在最佳试验条件下制得的微囊,微囊粒径范围集中在10 μm左右,少数粒径偏大,但形态比较圆整。
2.3.4 微囊稳定性测定试验
将L-苯丙氨酸微囊阴凉自然光下,分别在5、10、15、20、25 d 后称量 0.100 0 g微囊,研磨、溶解、真空抽滤,定容到50 mL容量瓶中,测其吸光度;在相同条件下测定未微囊化的L-苯丙氨酸的吸光度。试验结果如图7所示。
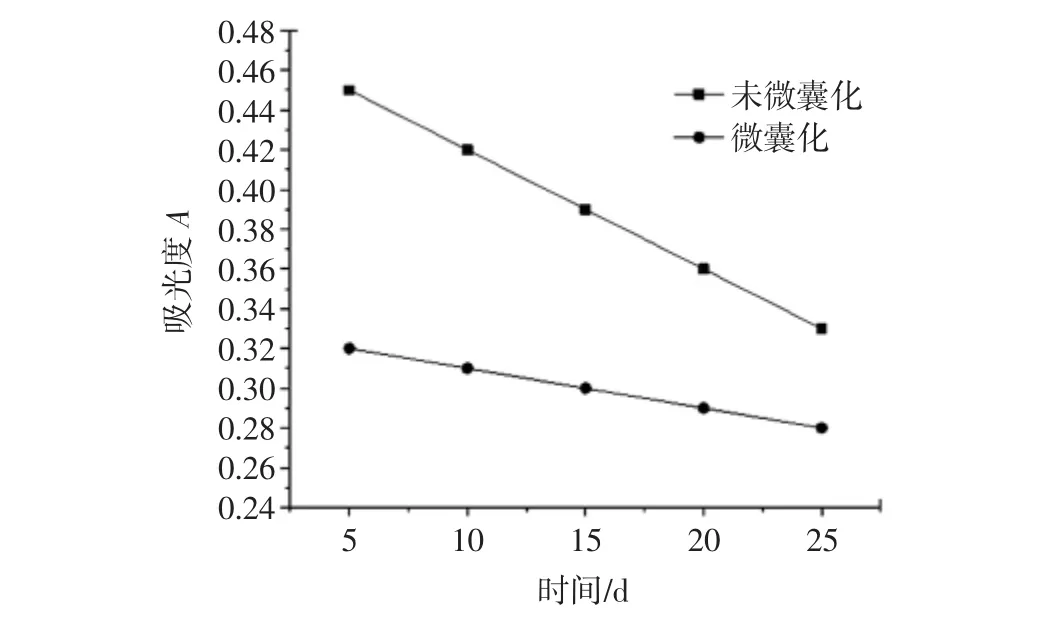
图7 L-苯丙氨酸微囊稳定性Fig.7 Stability of L-phenylalanine microcapsules
试验结果表明,未微囊化的苯丙氨酸含量25 d降低37.1%,微囊化的,L-苯丙氨酸含量25 d降低12.8%,说明在自然光照的情况下,微囊中的L-苯丙氨酸含量降低缓慢。微囊化对药物的稳定性有显著作用。
2.3.5 微囊的微观结构
微囊的微观结构见图8。

图8 Sigma 300扫描电子显微镜扫描图Fig.8 Sigma 300 scanning electron microscope scan
从扫描电镜照片a可以看出微囊粒径大小均匀,从照片b可以看出,微囊表面布满小孔,有利于L-苯丙氨酸的缓释。
3 结论
采用高压静电场法制备壳聚糖-L-苯丙氨酸微囊,确定了制备微囊的最佳工艺条件为:壳聚糖浓度为5.0%,氢氧化钠浓度为0.75 mol/L,温度为30℃,L-苯丙氨酸浓度为1.00%,电压为25 kV,转速为450 r/min,下滴高度为11 cm。在此条件下,制得的微囊的包封率为66.9%,粒径10 μm左右,但含药量较低,外形不够光滑,因此,后续试验需要进一步改善制备条件,提高微囊包封率,增加载药量。
