乳糖利用酵母菌的筛选及其特性初步研究
2018-12-10
(北方民族大学生物科学与工程学院/宁夏特殊生境微生物资源开发与利用重点实验室/国家民委发酵酿造工程生物技术重点实验室,宁夏银川750021)
乳糖是一种由一分子葡萄糖和一分子半乳糖经β-1,4-糖苷键缩合而成的双糖,它是哺乳动物乳汁中一种重要的碳水化合物。牛乳中乳糖平均含量为4.8%,约占牛乳总能量的30%,人乳中乳糖平均含量达7.0%,是新生儿主要的能量来源[1]。乳糖不能被人体直接吸收利用,必需在小肠内通过乳糖酶水解为葡萄糖和半乳糖而被吸收。然而,诸多因素,如种族、年龄、遗传、疾病等会导致相当一部分人体内乳糖酶活性下降,引起乳糖消化不良,饮用牛乳后出现胃肠道反应,如腹胀、肠痉挛、肠鸣及腹泻等[2-3]。乳糖不耐症是指与乳糖消化不良相关的胃肠道症状[1],其发生率在亚洲为 80%~100%,非洲为70%~75%,美国为15%~80%,欧洲总体为15%~70%[4]。中国人群乳糖酶缺乏发生率达75%~95.5%[5]。为适应该部分人的体质,很多企业将乳制品中的乳糖分解,制成低乳糖奶或无乳糖奶。根据《食品营养声称和营养成分功能声称准则》,乳糖含量≤2 g/100 g(mL)的可成为低乳糖,乳糖含量≤0.5 g/100 g(mL)的可称作无乳糖。
目前,生产低乳糖牛奶最安全、有效和实用的方法是向牛奶和乳制品中添加外源性半乳糖苷酶或葡萄糖苷酶,将乳糖水解成易于人体吸收的单糖[6-7]。目前广泛应用于工业化生产的乳糖酶来自于真菌,如曲霉属真菌(Aspergillus sp.)和酵母菌中的克鲁维酵母菌属(Kluyveromyces sp.),前者的最适活性pH值为酸性(pH 4.8),所以更适合于水解酸性食品如乳清中的乳糖,后者的最适pH值接近于中性(pH 6.0~7.0),故更多用于牛奶中乳糖的水解[8]。有些酵母菌在生长过程中能产生香味物质,这类酵母菌被称为生香酵母[9]。目前已报道的能产生香气的酵母菌主要包括毕赤酵母、球拟酵母、假丝酵母和汉逊酵母等[10-12]。因其独特的风味贡献,生香酵母已成功应用于白酒、酱油、食醋等行业[13-15]。具有乳糖利用能力或具有产香功能的酵母菌种类均较多,然而即能利用乳糖,又可产生香气的酵母种类并不多。本文拟通过富集、分离、纯化从水果外表皮和生牛奶中选出即可高效、稳定利用乳糖,又可产生香气的酵母菌,并对其利用特征进行初步研究,以期为生产低乳糖并具独特香味的纯牛奶提供酵母菌资源和初步的理论依据。
1 材料与方法
1.1 材料与试剂
试验所用水果(香蕉、苹果、山楂)及生牛奶:市售;葡萄糖、乳糖、酵母提取粉、蛋白胨、琼脂粉(均为生物试剂纯):北京奥博星生物技术有限责任公司;95%乙醇、(NH4)2SO4、NaOH、KH2PO4、MgSO4·7H2O、FeSO4·7H2O(均为分析纯):天津市永大化学试剂有限公司;KOH、Ba(OH)2、ZnSO4、NaHSO3、Na2HPO4(均为分析纯):天津市北联精细化学品开发有限公司;甲基蓝(分析纯):上海泰坦科技股份有限公司;苯酚、苦味酸(分析纯):西陇化工股份有限公司。
1.1.1 试剂配制
0.1%美蓝染液:甲基蓝0.3 g溶于30 mL 95%的乙醇,再与100 mL 0.01%的KOH溶液混合。
除蛋白试剂:4.5%Ba(OH)2和 5%ZnSO4溶液。
终止试剂:1.0%苯酚:5.0%NaOH:1.0%苦味酸(2,4,6-三硝基酚):1.0%NaHSO3=1∶2∶2∶1(体积比),贮存于棕色试剂瓶中,置于4℃冰箱中(一周内使用)[16]。
1.1.2 培养基配制
酵母富集培养基:0.1%(NH4)2SO4,0.25%KH2PO4,0.1%MgSO4·7H2O,0.1%FeSO4·7H2O,5%葡萄糖,0.05%酵母提取粉,0.05%Na2HPO4。
酵母浸出粉胨葡萄糖(yeast peptone dextrose,YPD)培养基:1%酵母提取粉,2%蛋白胨,2%葡萄糖,2%琼脂粉。
乳糖培养基:2%乳糖,1%酵母提取粉,2%蛋白胨,2%琼脂粉。
1.1.3 主要仪器与设备
UV 1000紫外可见分光光度计:上海天美科学仪器有限公司;TGL 18M台式高速冷冻离心机:湖南湘立科学仪器有限公司;LDZX-50KBS立式高压蒸汽灭菌器:上海申安医疗器械厂;LRH-150生化培养箱:上海一恒科技有限公司;THZ-9511K双层恒温振荡器:苏州培英实验设备有限公司;SN-CJ-2F超净化工作台:苏州安泰空气技术有限公司。
1.2 酵母菌的分离
1.2.1 生牛奶中酵母菌的分离
取1mL生牛奶于100mL酵母富集培养基中,30℃、100 r/min摇床培养48 h,将培养液用0.9%的NaCl溶液进行梯度稀释,取0.1 mL涂布至YPD平板,30℃培养2 d,挑取单菌落划线纯化5次。
1.2.2 水果表面酵母菌的分离
取新鲜香蕉、苹果、山楂的外表皮各2 g,加至100 mL酵母富集培养基中,30℃、100 r/min摇床培养48 h,取培养液进行稀释涂布,方法同1.2.1。
1.2.3 可利用乳糖酵母菌的筛选
采用划线法将已纯化好的酵母菌株接至乳糖培养基上,筛选出具有乳糖利用能力的菌株。
1.3 酵母菌株生长曲线的测定
将纯化好的代表菌株用液体YPD培养基活化16 h做成种子液,用移液枪吸取1 mL种子液于装有100 mL乳糖液体培养基的三角瓶里,30℃,100 r/min摇床培养,每隔2小时取样测定OD600nm,以空白液体培养基为对照。每个样测定3次取平均值,共测36 h。以时间为横坐标,OD600nm值为纵坐标作出生长曲线。
1.4 酵母菌对乳糖利用能力分析
取适量斜面活化的酵母菌种接种于液体YPD培养基中,于30℃、100 r/min振荡培养12 h。按10%的接种量将培养液接种到100 mL已灭菌的牛奶中,30℃、100 r/min振荡培养48 h,测定牛奶中乳糖含量。
1.5 不同菌株最佳处理时间分析
按照1.4中的方法准备酵母菌培养液,按10%的接种量将培养液接种到100 mL已灭菌的牛奶中,30℃,100 r/min振荡培养,于不同时间取样分析牛奶中乳糖含量,以确定不同菌株对乳糖处理的最佳时间。
1.6 酵母菌不同接种量对乳糖利用效果的影响
按照1.4中的方法准备酵母菌培养液,分别按4%、6%和8%的接种量将培养液接种到100 mL已灭菌的牛奶中,30℃,100 r/min振荡培养,培养时间根据1.5中所确定的最佳处理时间来确定,培养结束后分析酵母菌不同接种量对乳糖利用效果的影响。
1.7 乳糖含量的测定
1.7.1 乳糖含量标准曲线的测定
分别吸取乳糖标准溶液 0、25、50、75、100、150、200 μL(相当于 0、0.25、0.5、0.75、1.0、1.5、2.0 mg的乳糖)于15 mL离心管中,分别加入0.2 mL 5.0%的ZnSO4溶液和 0.2 mL 4.5%Ba(OH)2溶液,定容至 5 mL,混合均匀后于1 200 r/min离心1 min,吸取1.0 mL上清液加入比色管中,然后加入2.5 mL的终止试剂,盖紧塞子,将此管浸入沸水中4 cm~6 cm,加热煮沸6分钟后立即于冰水中冷却,加蒸馏水定容至10 mL,上下颠倒几次混匀,测定OD520nm。以乳糖含量为横坐标,OD520nm值为纵坐标制作标准曲线。
1.7.2 样品中乳糖含量的测定
取2.0 mL用酵母菌处理过的牛奶于100 mL容量瓶中,用蒸馏水定容。混匀后,取2.5 mL于15 mL离心管中,再依次加入0.2 mL 5%的ZnSO4溶液和0.2 mL 4.5%的Ba(OH)2溶液,晃动使其反应,用蒸馏水定容至5 mL,摇匀,以1 200 r/min离心1 min。将1.0 mL透明上清液转移至新的15 mL离心管中,加入2.5 mL终止试剂,拧紧盖子。浸泡离心管的底部4 cm~6 cm,置于沸水浴中6分钟后立即在冷水中冷却2 min~3 min。用蒸馏水定容至10 mL,上下颠倒5次后测定OD520nm,带入标准曲线,计算乳糖含量。
1.8 酵母菌处理后对牛奶风味的影响
取适量斜面活化的酵母菌种接种于液体YPD培养基中,于30℃,100 r/min振荡培养12 h。根据1.6中所确定的接种量将培养液接种到100 mL已灭菌的牛奶中,30℃、100 r/min振荡培养,培养时间根据1.5中所确定的最佳处理时间来确定。处理结束后,根据感官评定不同菌株处理后牛奶的风味。本次试验共邀请10位食品专业师生进行评价,其中6位学生,4位老师。感官评定采用5分制,分值越高,表明该特征指标越好。品评人员须对牛奶的香味、腥味以及整体风味分别进行打分,各项特征描述见表1[16-17]。
1.9 酵母菌的鉴定
参照《酵母菌的特征与鉴定手册》[18]对所筛选酵母菌株进行初步鉴定,结合18S rRNA序列测定,将序列信息输入美国国家生物技术信息中心(National Center of Biotechnology Information,NCBI)(www.ncbi.nlm.nih.gov)数据库进行比对分析,根据同源性比对结果鉴定到属。构建系统发育树分析其进化地位,发育树根据邻位法建立,所取bootstraps值为1 000,Kodamaea ohmeri CBS 1950T为外源菌株,括号中的数字为微生物菌株在基因库中的登录号。

表1 酵母菌处理后牛奶感官评定分值表Table 1 Sensory evaluation score table of milk after treatment of yeast strains
2 结果与分析
2.1 酵母菌的筛选及其对乳糖的利用能力
经分离、纯化共得到10株酵母菌。其中,从牛奶中分离纯化得到的4株酵母菌,编号为M1~M4;从苹果表皮分离纯化得到的2株酵母菌,编号为A1、A2;从香蕉表皮分离纯化得到的2株酵母菌,编号为B1、B2;从山楂表皮分离纯化得到的2株酵母菌,编号为H1、H2。各酵母菌株对牛奶中乳糖的利用能力如图1所示。

图1 酵母菌对乳糖的利用能力Fig.1 The lactose use ability of different yeast strains
加入10%的酵母菌液,经过48 h的降解,10株酵母菌所处理的牛奶中乳糖含量均有明显的下降趋势。相比较而言,菌株B1、B2、H1和H2对乳糖的利用效果最为明显,使牛奶中乳糖含量从5%左右降至2.5%左右,故后续试验选用这4株酵母菌作为试验菌株。
2.2 酵母菌生长曲线
对酵母菌株B1、B2、H1和H2的生长曲线进行了测定,如图2所示。
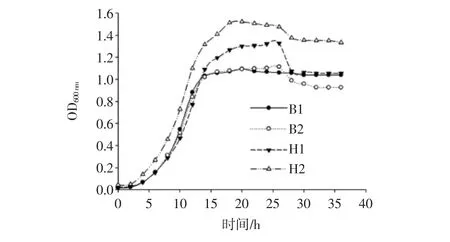
图2 酵母菌株生长曲线Fig.2 The growth curves of yeast strains
可以看出,在30℃的条件下,36 h之内,4株酵母菌基本体现出细胞生长的4个阶段:调整期、对数期、稳定期和衰亡期,4株菌大体在20 h~26 h生长量达到最大。
2.3 酵母菌株最佳处理时间分析
根据酵母菌株B1、B2、H1和H2的生长曲线,分别测定了其在20、26、36 h对牛奶中乳糖的利用效果,如图3所示。
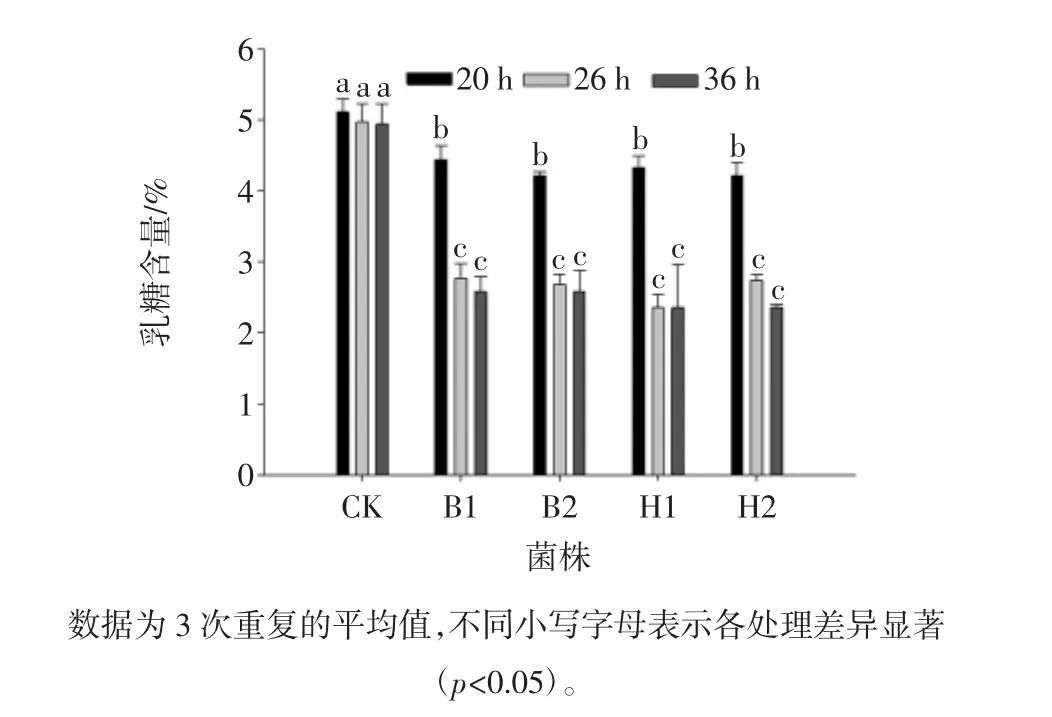
图3 不同酵母菌处理过程中乳糖含量随时间变化Fig.3 Changes of lactose content with time during the treatment of different yeast strains
在接种量相同(10%)的情况下,4株酵母菌26 h后可将牛奶中的乳糖将至2.5%左右,接近于低乳糖牛奶中乳糖含量标准。36 h的处理效果与26 h没有显著性差异,故后续试验选用的处理时间为26 h。
2.4 酵母菌不同接种量对乳糖利用效果的影响
在相同时间(26 h)下,酵母菌不同接种量对牛奶中乳糖处理效果的影响如图4所示。

图4 酵母菌不同接种量对乳糖利用效果的影响Fig.4 Effects of different inoculum size on the efficiency of lactose use
可以看出,对于B1,接种量为4%时,26小时后可将乳糖含量降至3.1%,当接种量提高到6%时,乳糖含量明显下降,26 h后降至2.8%,但当继续提高接种量时,其对乳糖利用能力没有显著提升。对于B2、H1和H2,当接种量提高到8%时,26小时后可将乳糖含量分别降至2.7%、2.5%和2.8%,明显高于4%和6%的接种量,但与10%的接种量没有显著性差异。因此,菌株B1的最佳接种量为6%,B2、H1和H2的最佳接种量均为8%。
2.5 酵母菌处理后纯牛奶的气味评价
对酵母菌B1、B2、H1和H2处理后的纯牛奶气味进行了初步的感官评定,结果如图5所示。

图5 酵母菌处理后牛奶感官特征评分结果Fig.5 Sensory evaluation on the odor of milk after treatment of yeast strains
与不经酵母菌处理的纯牛奶相比,各菌株处理后的牛奶均增添了不同程度的香味,无腥味、无异味,整体风味均有不同程度的改善。
2.6 菌株鉴定
采用形态观察法结合18S rRNA基因序列比对的方法对菌株B1、B2、H1和H2进行了鉴定。4株菌在YPD固体培养基上培养时,菌落颜色、形态,细胞形态、大小,以及液体培养形态特征各不相同,如表3和图6所示。

表3 酵母菌形态特征(3天)Table 3 Physiological characteristics of yeast strains(3 days)

图5 4株酵母菌的菌落形态和细胞形态(10×40倍)Fig.5 Colonyand cell morphology(10×40 times)of 4 yeast strains
在YPD固体培养基上培养3天后,B1菌落为乳白色,圆形,直径10 mm~15 mm,中间突起,质地粗糙,边缘全缘;B2菌落为纯白色,椭圆形,直径10 mm~15 mm,中间突起,质地光滑,边缘全缘;H1菌落为乳白色,圆形,直径4 mm~9 mm,中间突起,质地光滑,边缘全缘;H2菌落为奶油色,圆形,直径4 mm~9 mm,中间突起,质地光滑,边缘齿轮。在40倍光学显微镜下观察各菌株细胞形态,B1和B2为圆形,H1和H2为椭圆形,都有出芽,B1和H1有假菌丝。液体培养3天后B1和B2培养液均匀浑浊,H1和H2稍有浑浊,静置后底部均有沉淀。
将B1、B2、H1和H2的18S rRNA基因序列在基因库中进行同源性对比,结果见表4。
结果发现,B1与梅奇酵母菌属(Metschnikowia sp.)多个菌种基因序列同源性达99%B2与威克汉姆酵母菌属(Wickerhamomyces sp.)多个菌种基因序列同源性达99%,H1与假丝酵母菌属(Candida sp.)和毕赤酵母菌属(Meyerozyma sp.)多个菌种基因序列同源性达99%,H2与毕赤酵母菌属(Meyerozyma sp.)多个菌种基因序列同源性达100%以上,与假丝酵母菌属(Candida sp.)多个菌种基因序列同源性达99%。通过与基因库中典型模式菌株序列构建系统发育树,分析了各菌株的进化地位,如图5所示。

表4 18S rRNA基因序列对比结果Table 4 Alignment results of 18S rRNA sequences

图5 基于18S rRNA基因序列的系统发育树Fig.5 Phylogenetic tree of 18S rRNA sequences
结果表明,B1与Metschnikowia bicuspidata strain NRRL YB-4993(JQ698902.1)在同一分支,B2 与 Wick erhamomycesanomalusstrainNRRLY-366(EF552565.1)在同一分支,可以确定酵母菌B1为梅奇酵母菌属(Metschnikowia sp.),B2为威克汉姆酵母菌属(Wickerhamomyces sp.)。H1 和 H2 与 Meyerozyma caribbica CBS 2022 (KY 104217.1)、Meyerozyma caribbica CBS 9966 (KY 104222.1)、Meyerozyma caribbica CBS 9966(NR 149348.1)在同一分支,所以确定H1和H2均为毕赤酵母菌属(Meyerozyma sp.)。
3 讨论
根据《酵母菌的特征与鉴定手册》[18],二尖梅奇酵母(Metschnikowia bicuspidata)、异常威克汉姆酵母(Wickerhamomyces anomalus)和奥默毕赤酵母(Pichia ohmeri)均能在乳糖环境下生长。除此之外,白吉利丝孢酵母(Triehosporonbei geli)、赭色掷孢酵母(Sporobolomyces salomonicolor)、异酒香酵母(Brettanomyces anomalus)、海泥克鲁维酵母(Kluyveromyces aestuarii)、间型假丝酵母(Candida intermedia)、汉逊德巴利酵母(Debaryomyces hansenii)、尼泊尔德巴利酵母(Debaryomyces nepalensis)、水生丝孢酵母(Aquatic Hyphomycetes)、土生假丝酵母(Candida humicola)、白地霉(Geotrichum candidum)、地生隐球酵母(Cryptococcus terreus)等都能在乳糖环境下生长。
毕赤酵母(Pichia sp./Meyerozyma sp.)、威克酵母(Wickerhamomyces sp.)为典型的产香酵母菌,在许多研究中都有报道。刘阳等[19]从柑橘中筛选得到4株生香酵母,其中两株分别为毕赤酵母(Pichia sp.1 TMS-2011)和异常威克汉姆酵母(Wickerhamomyces anomalus),其最主要的香气成分均为苯乙醇。而苯乙醇是一种比较典型的芳香醇,具有淡雅细腻的玫瑰香气,在食品、白酒、果酒、药品及化妆品等行业中都有着广泛的应用[20]。刘英丽等[21]从传统发酵食品中分离筛选到5株产香酵母菌,其中3株为异常威克汉姆酵母菌,经分析它们的麦芽汁发酵液中主要挥发性成分为3-甲基-1-丁醇、2-呋喃甲醇、2-苯基乙醇、2-甲基-1-丙醇和醋酸乙酯。高健等[22]从茎用莴苣中分离出一株异常威克汉姆酵母菌,其在培养时发出淡淡的清香味,经检测其产生的挥发性成分大多为烯类和醇类两大类,主要包括柠檬烯、月桂烯、香桧烯、α-蒎烯、罗勒烯、3-甲基-1-丁醇、苯乙醇和2-辛醇等。王益姝等[9]从酒醅中分离筛选出两株产独特香气的酵母菌,经鉴定为异常威克汉姆酵母菌,分析表明,酯类和醇类是该生香酵母菌发酵液中主体香气成分,其中乙酸乙酯、乙酸异戊酯、异戊醇和乙醇是其中相对含量较高的4种风味物质。付俊淑等[23]检测了12株食品来源酵母菌的挥发性成分,其中1株为喜仙人掌毕赤酵母(Pichia cactophil)、1 株膜噗毕赤酵母(Pichia membranifaciens)、2株Kudriavzevii毕赤酵母,结果表明,酵母发酵后的香气组分主要为酯类,包括乙酸乙酯、辛酸乙酯、乙酸苯乙酯、癸酸乙酯等。吴群等[24]研究了一株产风味的异常威克汉姆酵母菌,其在发酵过程过程中具有产多种酯类物质的特点。关于梅奇酵母菌也有少量关于其产香方面的报道,古其会等[25]从番木瓜酒中分离出一株产香的梅奇酵母菌(Metschnikowia sp.),由该菌株发酵制成的番木瓜酒香气浓郁、独特。
能在乳糖环境下生长的酵母种类较多,产香酵母种类也较多。然而,即能利用降解乳糖,又可产生香气的酵母种类并不多。本研究所分离出的4株酵母菌分属于梅奇酵母菌属(Metschnikowia sp.)、威克汉姆酵母菌属(Wickerhamomyces sp.)和毕赤酵母菌属(Meyerozyma sp.),它们即可有效降低牛奶中乳糖含量,又可产生独特的香气从而改善牛奶风味,因而在低乳糖牛奶生产中具有较大的应用前景,但其具体挥发性成分还需进一步研究。
4 结论
从水果表皮和生牛奶中筛选出4株对牛奶中乳糖具有良好利用效果的酵母菌,26小时后可将牛奶中的乳糖含量从5%左右降至2.5%左右,接近于国家低乳糖牛奶的标准;4株酵母菌分属于3个属,分别为梅奇酵母菌属(Metschnikowia sp.)、威克汉姆酵母菌属(Wickerhamomyces sp.)和毕赤酵母菌属(Meyerozyma sp.),经处理后的牛奶具有不同香气。研究结果可为生产低乳糖并具独特香气的纯牛奶提供一定的酵母菌资源和初步的理论依据。
