肝豆灵抑制Notch信号通路干预铜负荷致肝纤维化大鼠肝脏上皮-间质转化
2018-12-10王亚东李茂涛蒋怀周鲍远程
吴 鹏,王亚东,方 颖,李茂涛,蒋怀周,鲍远程
(1.安徽中医药大学,安徽 合肥 230012;2.安徽中医药大学第一附属医院,安徽 合肥 230031)
肝豆状核变性(hepatolenticular degeneration,HLD)是一种铜代谢障碍性疾病,铜蓄积所致的肝细胞脂肪变性、活动性肝炎、肝纤维化是HLD患者的主要肝脏病理变化,肝纤维化在几乎每个确诊的患者肝脏均有发现[1-2]。中医认为铜毒内聚,湿热、痰浊、瘀血相互蕴结是HLD肝纤维化的主要病机,临床上以通腑利湿、化瘀散结中药专方肝豆灵为主的综合治疗可有效促进HLD患者肝硬化及肝功能的恢复[3]。实验研究发现,肝豆灵可促进肝星状细胞(hepatic stellate cells, HSC)凋亡,抑制肝细胞凋亡,从而发挥抗肝纤维化、减轻肝损伤的作用[4-5]。
前期研究发现,在铜负荷大鼠纤维化肝组织,Notch信号通路配体Jagged1、受体Notch3被激活,下游Hes1蛋白与肌成纤维细胞标志物α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)表达区域大部分重合,并随着肝纤维化的加重而同步表达增加,这说明铜沉积可通过Notch信号通路介导肝星状细胞转化为肌成纤维细胞(myofibroblast,MFB)并促其活化增殖[6]。
有研究表明,Notch信号通路参与调控上皮-间质转化(epithelial-mesenchymal transition, EMT)而在肝纤维化过程中发挥重要作用[7-8]。在HLD肝纤维化形成过程中,铜沉积可能通过Notch通路介导EMT而参与肝纤维化的形成,肝豆灵可能通过Notch信号通路,干预EMT环节而发挥抗肝纤维化作用。本研究旨在观察肝豆灵对Notch信号通路关键信号分子的影响。
1 材料
1.1 动物 雄性SPF级SD大鼠40只,购自安徽医科大学实验动物中心[动物生产许可证号:SCXK(皖)2013-01],12~13周龄,平均体质量(200±20)g。
1.2 主要仪器 全自动生化仪(AU2700):OLYMPUS;γ放射免疫计数器(FJ-2003):华粤集团;石蜡切片机(RM2135)、图像采集系统(Q550CW):Leica;荧光定量PCR仪(ABI 7500);化学发光检测系统(3400):Clinx科学仪器有限公司。
1.3 药物及主要试剂 肝豆灵片:安徽中医药大学第一附属医院制剂室,院药制字Z20050071);丙氨酸氨基转移酶(alanine aminotransferase,ALT)、天冬氨酸氨基转移酶(aspartate aminotransferase, AST)、碱性磷酸酶(alkaline phosphatase,ALP)、羟脯氨酸(hydroxyproline,Hyp)、透明质酸(hyaluronic acid,HA)试剂盒:建成生物工程研究所,货号依次为C009-3、C010-3、A059-2、A030-1、H141;Masson试剂盒(G1340):索莱宝科技有限公司;RT-PCR试剂(货号12574030):Thermo Fish公司;β-actin(货号SC47778):Santa Cruz公司;Hes1一抗(货号ab71559)、α-SMA一抗(货号ab32575):Abcam公司;E-cadherin一抗(货号14472):CST公司;山羊抗小鼠二抗(货号sc2005):Santa公司;山羊抗兔二抗(货号CW0103):康为世纪生物科技有限公司;即用型SABC试剂盒(货号SA1022)、DAB显色试剂盒(货号AR1025):博士德公司。
2 方法
2.1 分组及模型复制 随机将40只SD大鼠分为正常组,模型组,肝豆灵小剂量、中剂量、大剂量组,每组8只。正常组给予普通饲料喂养,模型组和肝豆灵组喂饲含硫酸铜1.5 g/kg的粉状饲料和0.185%硫酸铜去离子水,共24周,以复制铜负荷大鼠模型[6]。从第12周开始,肝豆灵小剂量组大鼠每日给予0.243 g/kg(相当于成人剂量的3.15倍,为人体药物等效折算剂量的1/2)肝豆灵片溶液(碾碎后溶于2 mL生理盐水配制成混悬液)灌胃,肝豆灵中剂量组、大剂量组大鼠每日分别给予肝豆灵片0.486、0.729 g/kg肝豆灵溶液灌胃,正常组及模型组大鼠给予等容积生理盐水灌胃,共12周。实验过程中,模型组、肝豆灵中剂量组和大剂量组各有2只大鼠死亡,剩下34只大鼠在第24周实验结束后,禁食12 h,10%水合氯醛4.0 mL/kg腹腔注射麻醉,心脏采血,3 000 r/min离心10 min,取血清;取部分肝组织,用4%中性甲醛固定,行病理及免疫组织化学法检测;取部分肝组织,迅速采用液氮冻存后,于-80 ℃冰箱保存。
2.2 指标测定
2.2.1 血清生化指标及肝组织Hyp含量测定 采用全自动生化分析仪检测血清ALT、AST、ALP含量;采用放射免疫法检测血清HA含量;采用比色法检测肝组织Hyp含量。
2.2.2 肝脏组织形态学检查 采用苏木精-伊红(hematoxylin-eosin, HE)及Masson染色观察肝组织病理损伤及胶原沉积状况。在10×20倍光学显微镜下随机选取5个视野,观察并测量胶原纤维含量(胶原纤维面积/肝组织面积×100%,取平均值)。
2.2.3 实时荧光定量PCR检测转化生长因子β1(transforming growth factor beta 1,TGF-β1)、Jagged1、Notch1、Notch3、Snail mRNA表达水平 由上海生工生物工程有限公司设计并合成引物(见表1),依据以下步骤测定各基因mRNA的表达水平。①RNA提取:裂解组织,按5∶1的标准加入氯仿,离心后上清液加入等容积异丙醇,加入1 mL 75%乙醇,弃上清,加入20 μL DEPC水保存。②cDNA合成:反应体系为RNA 8.0 μL、Oligo(dT)1.0 μL、Buffer 4.0 μL、dNTP 2.0 μL、RNasin 1.0 μL、M-MLV 1.0 μL,PCR仪器上42 ℃ 60 min,70 ℃ 5 min,取出反应液即为cDNA;③实时PCR:反应体系为2×SYBR Green Real-time PCR mixture 10 μL,10 μmol正向引物及反向引物各0.4 μL,2×ROX Ⅱ 0.4 μL,cDNA 2.0 μL,双蒸水6.8 μL,95 ℃ 30 s预变性,95 ℃ 5 s,60 ℃ 34 s扩增40个循环后,95 ℃ 15 s,60 ℃ 60 s,95 ℃ 15 s。用2-ΔΔC(t)法计算待测基因mRNA的相对表达水平。

表1 实时荧光定量PCR引物
2.2.4 Western Blot法检测Hes1、E-cadherin表达水平 将肝组织加入蛋白裂解液(1.0 mL RIPA 50 mg)后,取上清,采用BCA法对蛋白进行定量检测后,配制10% SDS-PAGE凝胶后,加入蛋白样品30 μg,电泳,转膜,封闭,加一抗(β-actin 1∶1 000,Hes1 1∶400,E-cadherin 1∶400)后室温孵育3 h,TBST洗脱3次,加入相应的二抗(山羊抗小鼠1∶10 000,山羊抗兔1∶5 000),室温孵育1 h,采用ECL发光试剂盒检测目的蛋白。采用Quantity one软件分析灰度值。
2.2.5 免疫组织化学染色法检测α-SMA 采用链霉亲合素生物素过氧化物酶复合物(strept avidin-biotin complex,SABC)法检测α-SMA,经脱蜡、修复后,封闭液孵育25 min,滴加一抗(α-SMA 1∶200稀释),PBS冲洗后滴加生物素标记的山羊抗兔IgG二抗(1∶100)及试剂SABC,DAB显色。IPP 6.0图像分析系统测量平均光密度(mean optical density,MOD),即积分吸光度与目标区域面积比值,用以代表阳性部位蛋白表达水平。

3 结果
3.1 各组血清ALT、AST、ALP、HA及肝组织Hyp水平比较 模型组大鼠血清ALT、AST、ALP、HA水平及肝组织Hyp和胶原纤维含量较正常组明显升高(P<0.05);与模型组比较,肝豆灵各剂量组ALT、AST水平显著降低(P<0.05),肝豆灵中、高剂量组大鼠血清ALP、HA水平及肝组织Hyp和胶原纤维含量明显降低(P<0.05)。见表1。各组肝组织胶原纤维沉积情况见图1。

表1 各组大鼠血清ALT、AST、ALP、HA水平及肝组织Hyp和胶原纤维含量比较
注:与正常组比较,*P<0.05;与模型组比较,#P<0.05
3.2 肝脏组织形态学观察 HE及Masson染色结果显示,正常组肝小叶结构完整,肝细胞排列整齐,未见脂肪变性、炎性反应及纤维条索;模型组、肝豆灵小剂量组均可见粗大纤维条索,多个假小叶形成,肝细胞大片溶解坏死,合并脂肪变性,散在炎性细胞浸润;肝豆灵中剂量组与模型组比较,假小叶由于肝细胞增殖而变大,纤维条索变细,肝细胞坏死减少,可见气球样变性、脂肪变性;肝豆灵大剂量组纤维化改善明显,坏死、脂肪变性程度减轻,未见假小叶。见图1、图2。

注:A.正常组;B.模型组;C.肝豆灵低剂量组;D.肝豆灵中剂量组;E. 肝豆灵高剂量组
图1各组大鼠肝脏组织形态学变化(HE染色,10×20倍)

注:A.正常组;B.模型组;C.肝豆灵低剂量组;D.肝豆灵中剂量组;E. 肝豆灵高剂量组
图2各组大鼠肝脏组织形态学变化(Masson染色,10×20倍)
3.3 各组大鼠肝组织TGF-β1、Jagged1、Notch1、Notch3、Snail mRNA表达水平比较 与正常组比较,模型组TGF-β1、Jagged1、Notch1、Notch3、Snail mRNA表达水平明显升高(P<0.05);与模型组比较,肝豆灵小剂量组Notch3 mRNA表达降低(P<0.05),中剂量组、大剂量组所有指标均显著降低,差异有统计学意义(P<0.05)。见表2。
3.4 各组大鼠肝组织E-cadherin和Hes1表达水平比较 与正常组比较,模型组大鼠E-cadherin蛋白表达水平显著降低,Hes1蛋白表达水平显著升高,差异均有统计学意义(P<0.05);与模型组比较,肝豆灵中剂量组、大剂量组E-cadherin蛋白表达水平显著升高,Hes1蛋白表达水平显著降低,差异有统计学意义(P<0.05)。见图3。

表2 各组大鼠肝组织TGF-β1、Jagged1、Notch1、Notch3、Snail mRNA表达水平比较
注:与正常组比较,*P<0.05;与模型组比较,#P<0.05

注:A.正常组;B.模型组;C.肝豆灵低剂量组;D.肝豆灵中剂量组;E. 肝豆灵高剂量组;与正常组比较,*P<0.05;与模型组比较,#P<0.05
图3各组大鼠肝组织E-cadherin和Hes1表达水平比较(Western blot法,n=6)
3.5 各组大鼠肝组织α-SMA表达水平比较 免疫组织化学染色显示,正常组大鼠肝组织α-SMA无明显阳性表达;模型组及肝豆灵各治疗组均可见α-SMA阳性细胞,胞浆呈棕黄或棕褐色,主要表达于靠近纤维条索的梭形肌成纤维细胞,在纤维增生的汇管区、血管旁及靠近纤维条索的肝窦周围细胞亦有表达。蛋白平均吸光度检测结果显示,与模型组比较,肝豆灵中、大剂量组α-SMA表达水平显著减少(P<0.05)。见表3和图4。
4 讨论
HLD作为铜代谢障碍性疾病,肝脏是铜中毒的原发靶器官和主要蓄积部位,过量铜在肝细胞聚集可产生大量氧自由基,诱导生物膜脂质过氧化,引起蛋白质、核酸等生物大分子的损害,导致肝细胞坏死、再生,肝星状细胞增殖活化为肌成纤维细胞,后者分泌大量细胞外基质(extracellular matrix, ECM),形成肝纤维化[3-4]。有研究证实,在肝纤维化发生发展过程中,肝源细胞,包括肝细胞、肝星状细胞、胆管上皮细胞、肝窦内皮细胞等也能通过发生EMT而转变为肌成纤维细胞[9-10],抑制EMT可使肌成纤维细胞的转化生成减少,表现为特异性标志物α-SMA和Ⅰ型胶原蛋白的含量降低,从而阻止肝纤维化的发展,因此针对EMT的干预成为逆转纤维化疾病的一种可行的方式[8,11-12]。

表3 各组大鼠肝组织α-SMA表达水平比较
注:与正常组比较,*P<0.05;与模型组比较,#P<0.05
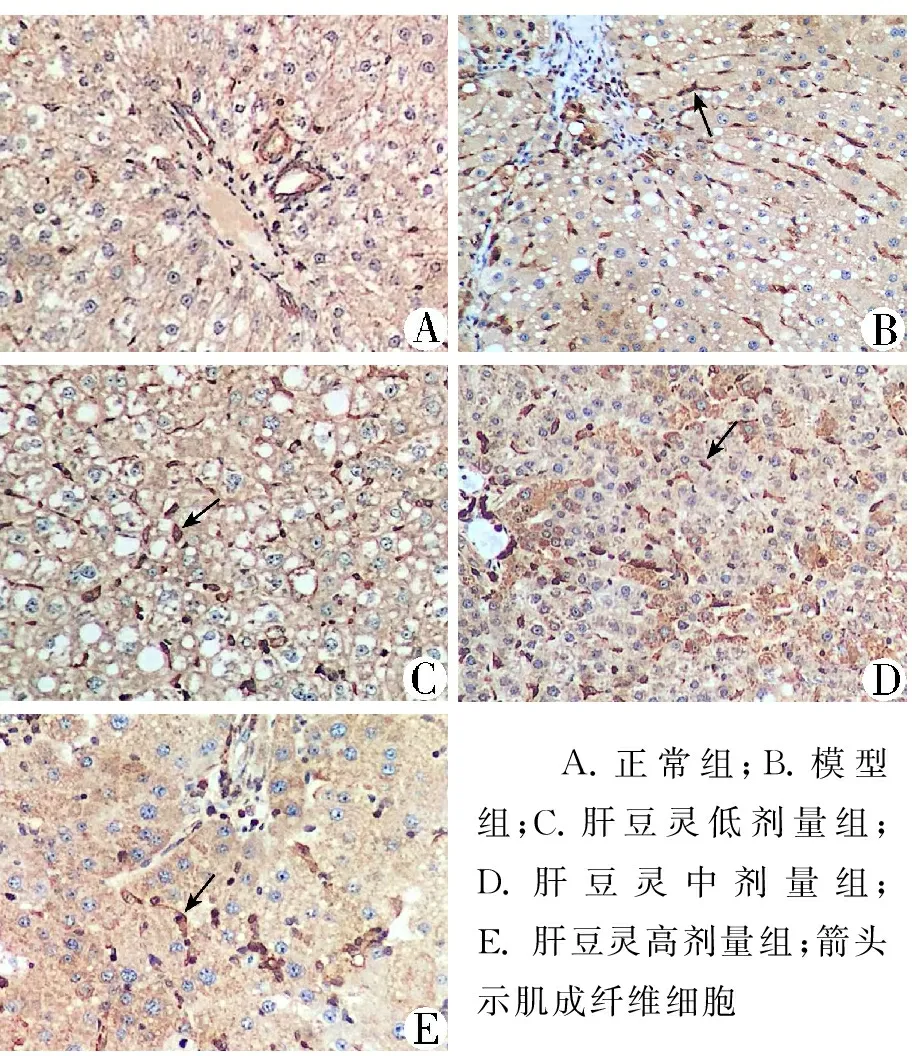
A.正常组;B.模型组;C.肝豆灵低剂量组;D.肝豆灵中剂量组;E. 肝豆灵高剂量组;箭头示肌成纤维细胞
图4各组大鼠肝脏α-SMA表达水平(免疫组织化学染色,10×20倍)
Notch信号通路高度保守,通过介导生物细胞间信息交流而决定细胞的增殖、凋亡与分化,在纤维化EMT过程中有着重要的作用。Notch作为跨膜蛋白激活后,其活化形式胞内区Notch(Notch intracellular domain,NICD)可作用于EMT关键因子Snail的启动子,进而下调间质标志物E-cadherin的合成,启动EMT环节[9]。Notch通路中Jagged1、Notch1等是致纤维化重要诱导因子TGF-β1的效应靶点,TGF-β1通过上调Jagged1、Notch1及下游Hes1的表达促进EMT环节参与组织纤维化。特异性沉默Jagged1基因可抑制TGF-β1诱导的上皮细胞EMT转化。阻断Notch信号通路可抑制上皮细胞Snail及α-SMA的表达,促进E-cadherin的合成,从而抑制上皮细胞发生EMT而转型为肌成纤维细胞[11,13-14]。本研究发现,在铜负荷大鼠肝纤维化组织,Notch信号通路Jagged1/Notch1、Notch3/Hes1及α-SMA表达增加,EMT的核内目的基因Snail升高,E-cadherin表达下降,说明铜沉积可以通过Notch通路介导EMT,诱导肌成纤维细胞转化生成及活化增殖而参与HLD肝纤维化的形成。
现代医学已证实,HLD为常染色体隐性遗传病,患者肝组织普遍存在不同程度的慢性活动性肝炎,且较早出现中晚期的肝纤维化表现[2]。中医学认为,HLD肝纤维化根本原因是先天禀赋不足,肾的开合失司引起铜毒内聚、湿热内蕴,从而阻碍气机,导致瘀血与痰浊互结于胁下,形成“积聚”;胆汁外溢于肌肤、眼轮而表现身目发黄。毒邪日久不去,损伤络脉,癥积不愈,加之脉络壅塞,水湿不化而成“鼓胀”。因此铜毒内蕴、痰瘀阻络是HLD肝纤维化的主要病机[3]。
针对以上病机研发的通腑化瘀专方肝豆灵已在临床应用30余年,临床疗效确切。方中黄连、大黄、金钱草清热燥湿、泻热通腑、利水通淋,共奏解毒通腑化浊之功。丹参、姜黄、莪术活血祛瘀、行气破瘀、破血祛瘀,三药协同增强活血化瘀散结之力。临床研究证实,联合肝豆灵进行中西医结合驱铜治疗可有效促进HLD患者肝纤维化指标、肝功能的恢复,作用优于单纯西药治疗[3]。实验研究发现,肝豆灵具有诱导肝星状细胞凋亡,干预p38MAPK信号通路蛋白的表达而发挥抗纤维化作用;能抑制肝细胞凋亡,上调肝组织miRNA-122的表达而修复肝损伤[15]。应用代谢组学技术亦发现,肝豆灵对铜负荷大鼠小分子代谢物有明显的调节效应,从代谢网络的多节点对HLD肝纤维化有干预作用[16-17]。
实验发现,随着肝豆灵剂量增加,铜负荷大鼠肝功能及肝纤维化血清学指标降低,肝组织坏死、脂肪变性程度减轻,胶原纤维含量减少,TGF-β1及Notch信号通路Jagged1/Notch1、Notch3/Hes1及α-SMA表达减少,EMT指标Snail降低,E-cadherin表达升高。因此推断肝豆灵通过下调TGF-β1及Jagged1/Notch1、Notch3/Hes1信号通路而发挥抗铜负荷大鼠肝纤维化的作用,机制可能是抑制EMT环节而减少肌成纤维细胞的转型生成及活化增殖。当然多组分的复方肝豆灵作用于哪些肝源细胞从而调控EMT环节?具体机制如何?尚需深入研究。
