气相色谱三重四级杆串联质谱同时测定香精中22种邻苯二甲酸酯
2018-12-07,,2,*,,,,,,
,,2,*,, , ,, ,
(1.浙江方圆检测集团股份有限公司,浙江杭州 310018;2.浙江省产品质量安全检测研究院,浙江杭州 310018;3.浙江大学生物系统工程与食品科学学院,智能食品加工技术与装备国家地方联合工程实验室,浙江杭州 310058)
邻苯二甲酸酯(PAEs)是通常被称为塑化剂的一类物质,从上世纪30年代开始,它就作为增塑剂并使用在工业产品中,从而增加塑料制品的透明度,耐久性,弹性和寿命[1-2],其中包括个人护理品、药物、食品包装、营养补充剂等[3]。但是研究发现邻苯二甲酸酯具有生物毒性,它会干扰内分泌系统、免疫和神经的正常调节,并具有致突变、致畸性和致癌的特性[4]。由于它的作用与激素相似,并且可以模拟雌激素效应,因此又被称作环境激素。
目前,邻苯二甲酸酯前处理方法主要有固相萃取法[5],固相微萃取法[6],磁固相萃取法[7]和液液(微)固相萃取法[8]等。其中固相萃取法因其成本低,净化效果好和操作简便等特点,成为较为常用的萃取方法。气相色谱[9-10]、气相色谱-串联质谱法[11-12]、液相色谱[13]和液相色谱-串联质谱法[14-15]是邻苯二甲酸酯主要的测定方法。但是由于液相色谱的管路本底较高,准确定量较为困难,气相色谱-质谱技术成为主要的邻苯二甲酸酯检测方法[16]。香精由多种香料混合而成,常添加于饮料、果冻和饼干等食品当中。2011年爆发的台湾饮料塑化剂事件中,就涉及到香精,使得香精的塑化剂问题得到社会关注。香精内部成分复杂,并且部分香精由油溶性组分组成,致使结果存在着假阳性风险。单四级杆质谱选择性较差,定量限较高,难以满足香精中邻苯二甲酸酯的检测要求。本实验采用固相萃取方式对香精样品进行前处理,使用气相色谱-三重四级杆串联质谱对其进行测定,以期降低背景干扰,减小假阳性风险,提高检测灵敏度,为实现香精中22种邻苯二甲酸酯的快速、准确分析提供参考。
1 材料与方法
1.1 材料与仪器
22种邻苯二甲酸酯类混合标准品:邻苯二甲酸二甲酯(DMP)、邻苯二甲酸二乙酯(DEP)、邻苯二甲酸二异丙酯(DIPrP)、邻苯二甲酸二烯丙酯(DAP)、邻苯二甲酸二丙酯(DPrP)、邻苯二甲酸二异丁酯(DIBP)、邻苯二甲酸二丁酯(DBP)、邻苯二甲酸二(2-甲氧基)乙酯(DMEP)、邻苯二甲酸二异戊酯(DIPP)、邻苯二甲酸二(4-甲基-2-戊基)酯(BMPP)、邻苯二甲酸二(2-乙氧基)乙酯(DEEP)、邻苯二甲酸二戊酯(DPP)、邻苯二甲酸二己酯(DHXP)、邻苯二甲酸丁基苄基酯(BBP)、邻苯二甲酸二(2-丁氧基)乙酯(DBEP)、邻苯二甲酸二环己酯(DCHP)、邻苯二甲酸二(2-乙基)己酯(DEHP)、邻苯二甲酸二正庚酯(DHP)、邻苯二甲酸二苯酯(DPhP)、邻苯二甲酸二正辛酯(DNOP)、邻苯二甲酸二癸酯(DIDP)、邻苯二甲酸二壬酯(DNP) 原始浓度均为1000 μg/mL,上海安谱实验科技股份有限公司;16种邻苯二酸甲酸酯类内标物:邻苯二甲酸二甲酯-D4(DMP-D4)、邻苯二甲酸二乙酯-D4(DEP-D4)、邻苯二甲酸二异丁酯-D4(DIBP-D4)、邻苯二甲酸二丁酯-D4(DBP-D4)、邻苯二甲酸二(2-甲氧基)乙酯-D4(DMEP-D4)、邻苯二甲酸二(4-甲基-2-戊基)酯-D4(BMPP-D4)、邻苯二甲酸二(2-乙氧基)乙酯-D4(DEEP-D4)、邻苯二甲酸丁基苄基酯-D4(BBP-D4)、邻苯二甲酸二己酯-D4(DHXP-D4)、邻苯二甲酸二戊酯-D4(DPP-D4)、邻苯二甲酸二(2-丁氧基)乙酯-D4(DBEP-D4)、邻苯二甲酸二环己酯-D4(DCHP-D4)、邻苯二甲酸二(2-乙基)己酯-D4(DEHP-D4)、邻苯二甲酸二苯酯-D4(DPhP-D4)、邻苯二甲酸二正辛酯-D4(DNOP-D4)、邻苯二甲酸二壬酯-D4(DNP-D4) 德国Dr. Ehrenstorfer GmbH公司;正己烷、丙酮、乙腈 色谱纯,美国TEDIA公司;40种香精样品 均来自浙江省香精生产和销售公司。
ProElut PSA GLASS固相萃取小柱(1 g,6 mL) 迪马科技有限公司;硅藻土(Diatomite)、C18、石墨化炭黑(GCB)填料 北京振翔科技有限公司;TSQ Quantum GC 三重四级杆气质联用仪、ST-16R型冷冻高速离心机 美国Thermo Fisher Scientific公司。
1.2 实验方法
1.2.1 样品前处理 取1.0 g香精于玻璃离心管中,添加适当浓度的内标物,随后加入0.5 mL正己烷溶液和5 mL乙腈溶液,涡旋超声30 min,然后以4000 r/min,4 ℃温度下,离心5 min,收集上层溶液。再加入5 mL乙腈溶液,按上述操作重复提取一次,合并上清液加入玻璃试管中,40 ℃下氮吹至2 mL,待净化。固相萃取小柱依次加入5 mL二氯甲烷和5 mL乙腈,加入待净化液,随后用2 mL乙腈润洗玻璃试管并加入到萃取柱中,然后加入5 mL乙腈洗脱样品,收集全部流出液,40 ℃下氮气吹至近干,加入1 mL正己烷溶解,以备气相色谱-质谱/质谱分析测定。
1.2.2 气相色谱-三重四级杆串联质谱条件 色谱条件:色谱柱为DB-17 石英毛细管色谱柱(30 m×0.25 mm×0.25 μm);载气为高纯氦气(99.999%),氦气流速为1.0 mL/min;进样口温度为280 ℃;升温程序:100 ℃为起始温度,以15 ℃/min升至200 ℃,保持2 min,再以5 ℃/min升至250 ℃,保持2 min,然后以2 ℃/min升至280 ℃,保持2 min。
质谱条件:电子轰击(EI)离子源,电离能量为70 eV,离子源温度为250 ℃;GC-MS传输线温度为280 ℃;扫描模式为选择反应监测(SRM)和子离子模式(product);Q2碰撞气为纯度是99.999%的氩气(1.5 mTorr);灯丝电流为50 μA。
1.2.3 定性、定量方法 以正己烷为溶剂配制浓度范围在3~1000 μg/L之间的标准溶液,根据保留时间以及碎片离子定性目标物。本研究采用内标定量,参考溶剂提取率和吸附剂加标回收率,根据保留时间,DIPrP、DAP和DPrP以D4-DEP为内标,DIPP以D4-BMPP为内标,DHP以D4-DCHP为内标,DIDP以D4-DNOP为内标。
1.3 数据处理
平均值、回收率和相对标准偏差的计算采用Microsoft Excel 2007版软件。
2 结果与分析
2.1 色谱和质谱条件的优化
邻苯二甲酸酯为弱极性化合物,利用DB-17色谱柱(中等极性柱)的分离性能,通过优化进样口、色谱柱程序升温和传输线的温度,实现有效分离目标化合物(总离子流图如图1所示)。而对保留时间相近而不能完全分离的某一些组分,如DAPHE DPrP(保留时间分别为9.58 min和9.62 min),采用SRM技术可以实现未完全分离的邻苯组分的定性和定量分析。采用三重四级杆质谱检测时,条件的优化一般包括母离子、子离子以及碰撞能量等。

图1 22种邻苯二甲酸酯的总离子流图Fig.1 TIC of 22 phthalate esters
在优化SRM参数时,先通过全扫描方式找出每一组份的保留时间,选取质荷比较大且相对丰度比较高的特征碎片作为母离子。然后将母离子进一步裂解,选取两个离子作为子离子,同时优化碰撞能量,以最佳的子离子响应值进行定性和定量。优化后的保留时间、定性定量离子以及碰撞能量信息如表1所示。
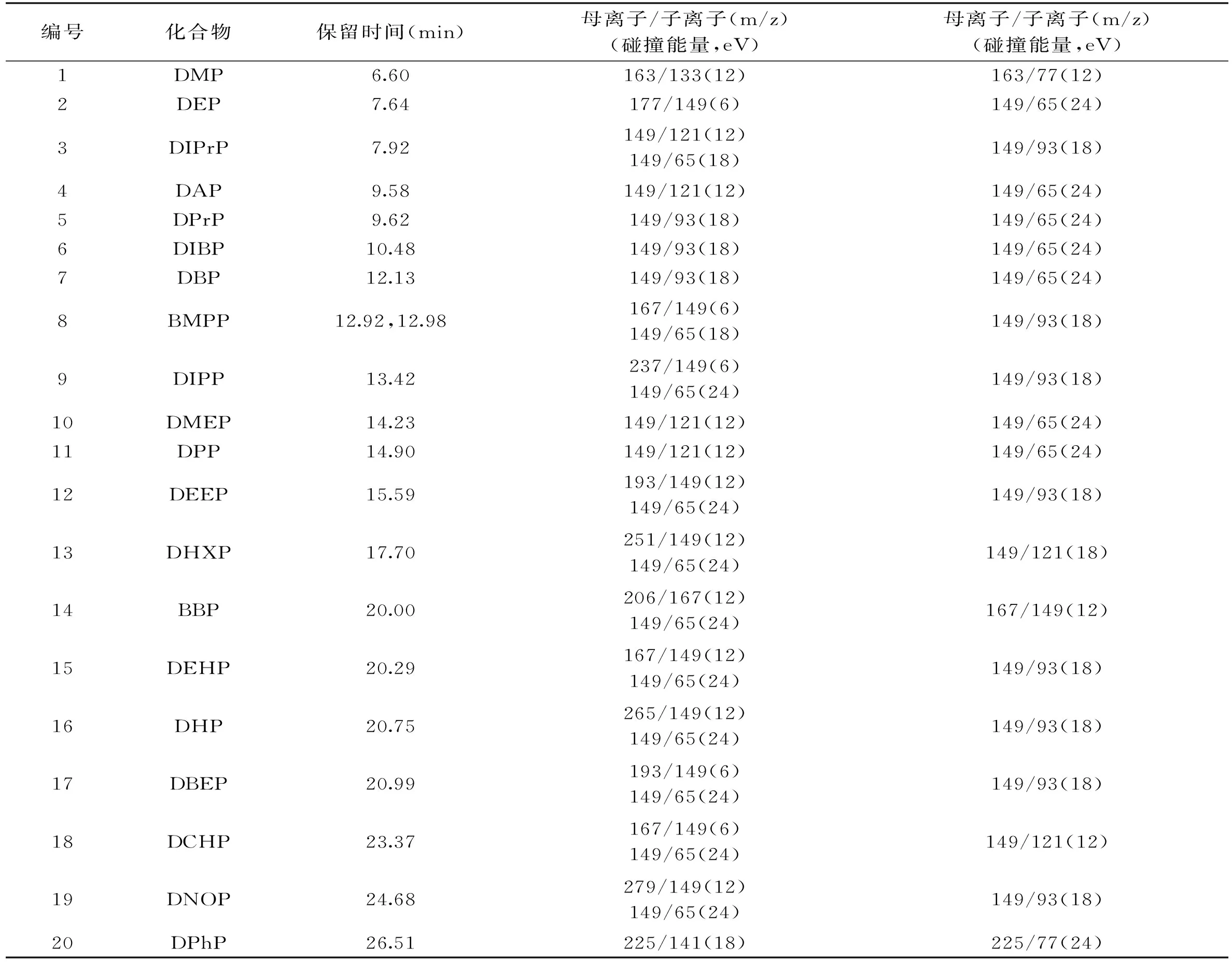
表1 22种邻苯二甲酸酯类和16种内标物的保留时间、定性定量离子和碰撞能量Table 1 Retention time,qualitative and quantitative ion pairs and collision energy of 22 phthalate esters and 16 internal standards

续表
2.2 线性范围、方法检出限和定量限
将邻苯二甲酸酯混合标准溶液分别配制成质量浓度为3、10、50、100、1000 μg/L的系列标准溶液,分别进行测试,以每种邻苯二甲酸酯的定量离子峰面积(y)对其质量浓度(x)绘制标准曲线。测定PAEs最低加标水平时的响应,以3倍信噪比(S/N=3)计算方法的检出限(LOD),以10倍信噪比(S/N=10)确定定量下限(LOQ),结果见表2。
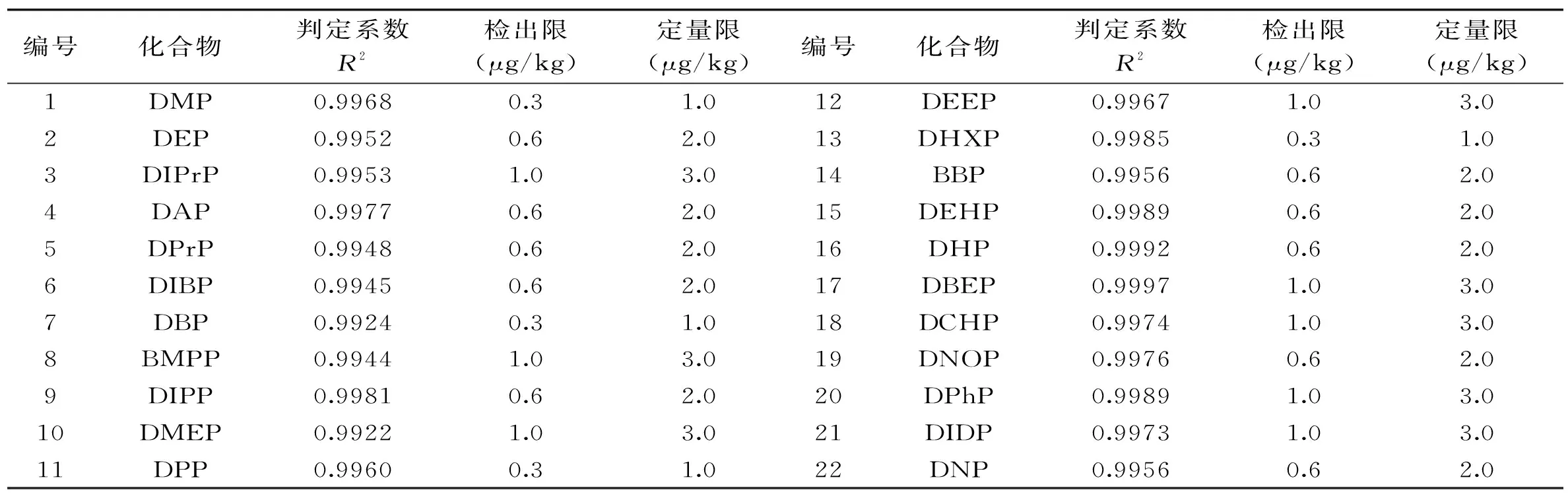
表2 22种邻苯二甲酸酯的判定系数、检出限和定量限Table 2 Linear equations,correlation coefficients,LOD and LOQ of 22 phthalate esters
从表2可以看出22种邻苯二甲酸酯在3.0~1000 μg/L范围内线性良好(判定系数R2为0.9922~0.9997),检出限为0.3~1.0 μg/kg,定量限为1.0~3.0 μg/kg。
2.3 提取溶剂的优化
分别选择二氯甲烷、乙酸乙酯、正己烷、乙腈和甲醇作为提取溶剂,因很高比例的香精为油溶性物质,当使用二氯甲烷、乙酸乙酯和正己烷为溶剂时,因其具有非极性,会有大量油溶性成分提出,很难进行进一步处理。比较甲醇和乙腈这两种极性提取溶剂时,发现甲醇的提取效率明显弱于乙腈(图2),因此采用乙腈作为主提取溶剂,同时为了减少油溶性杂质被乙腈提取出,故本试验采用正己烷作为辅助提取溶剂。
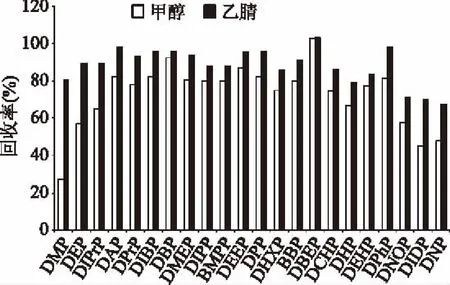
图2 提取剂对邻苯二甲酸酯类化合物回收率的影响Fig.2 Effect of extraction solvents on the extraction efficiencies of the phthalate esters
2.4 吸附剂的选择
香精基质复杂,可能包含色素、脂肪、糖类和蛋白质等杂质从而污染色谱柱和干扰定量。因此需要选取合适的吸附材料来净化样品。目前常用吸附剂有硅藻土(Diatomite)、乙二胺-N-丙基硅烷(PSA)、C18、石墨化炭黑(GCB)和磁碳纳米管等。磁碳纳米管因为制作工艺较为复杂[17],并且市面上没有现成的固相萃取柱可供购买,因此不作为本实验的研究对象。本实验研究发现,C18、GCB和硅藻土对于部分邻苯二甲酸酯回收率偏低,C18对DCHP的回收率为59.1%;硅藻土对BMPP和DHP的回收率分别为59.2%和59.3%;GCB对DIPrP、DPrP、DBP、DHXP、DEHP、DHP和DCHP的回收率均低于60%,而ProElut PSA GLASS固相萃取小柱对于这22种邻苯二甲酸酯回收率为67.1%~96.1%,满足实验需求,因此最终确定采用ProElut PSA GLASS固相萃取小柱。
2.5 方法的回收率和标准偏差
本实验在空白香精中添加邻苯混合标准物质进行准确度和精密度试验。各被测组分分别进行20、40和200 μg/kg 3个加标水平的回收试验,按1.2.2实验方法进行前处理,对每个加标水平进行6次平行测定,计算回收率和相对标准偏差,结果如表3所示。从表3可以看出:香精中22种邻苯二甲酸酯的回收率为82.4%~107.1%,相对标准偏差为≤9.1%,表明该方法的回收率较高,精密度较好。
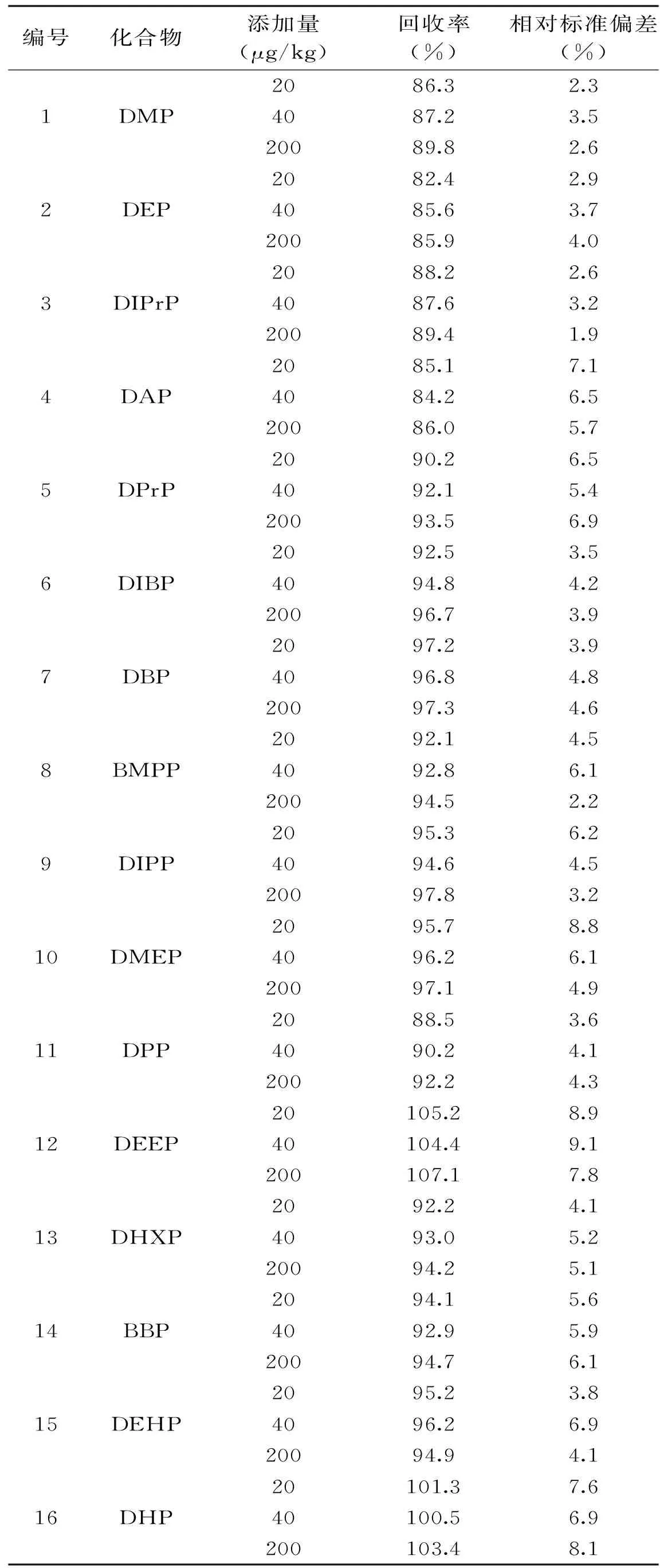
表3 22种邻苯二甲酸酯在三个水平下的加回收率和相对标准偏差(n=6)Table 3 The recoveries and RSD of 22 phthalate esters at three levels(n=6)

续表
2.6 实际样品分析
采用本文优化后的方法,对40批香精样品进行了测试,在其中18批香精样品中检出邻苯二甲酸酯,检出率为45.0%,结果如表4所示。所有样品中,只检测出3种邻苯二甲酸酯,分别为DBP,DIBP和DEHP。在18种检出的样品中,主要污染物为DBP和DIBP,而DEHP的含量较低或者为未检出。根据《卫生部办公厅关于通报食品用香精香料适用邻苯二甲酸酯类物质最大残留量有关问题的函》(卫办监督函[2011]773号)中的规定,香精香料的限量标准为60 mg/kg。因此这18个样品均未达到限量标准,并不构成严重的塑化剂污染风险,但是香精作为食品添加剂,普遍添加于各种食品中,而塑化剂被称为环境激素,对人体健康产生不利影响,特别是幼儿以及儿童,因此香精中邻苯二甲酸酯较高的检出率,应受到足够的关注。
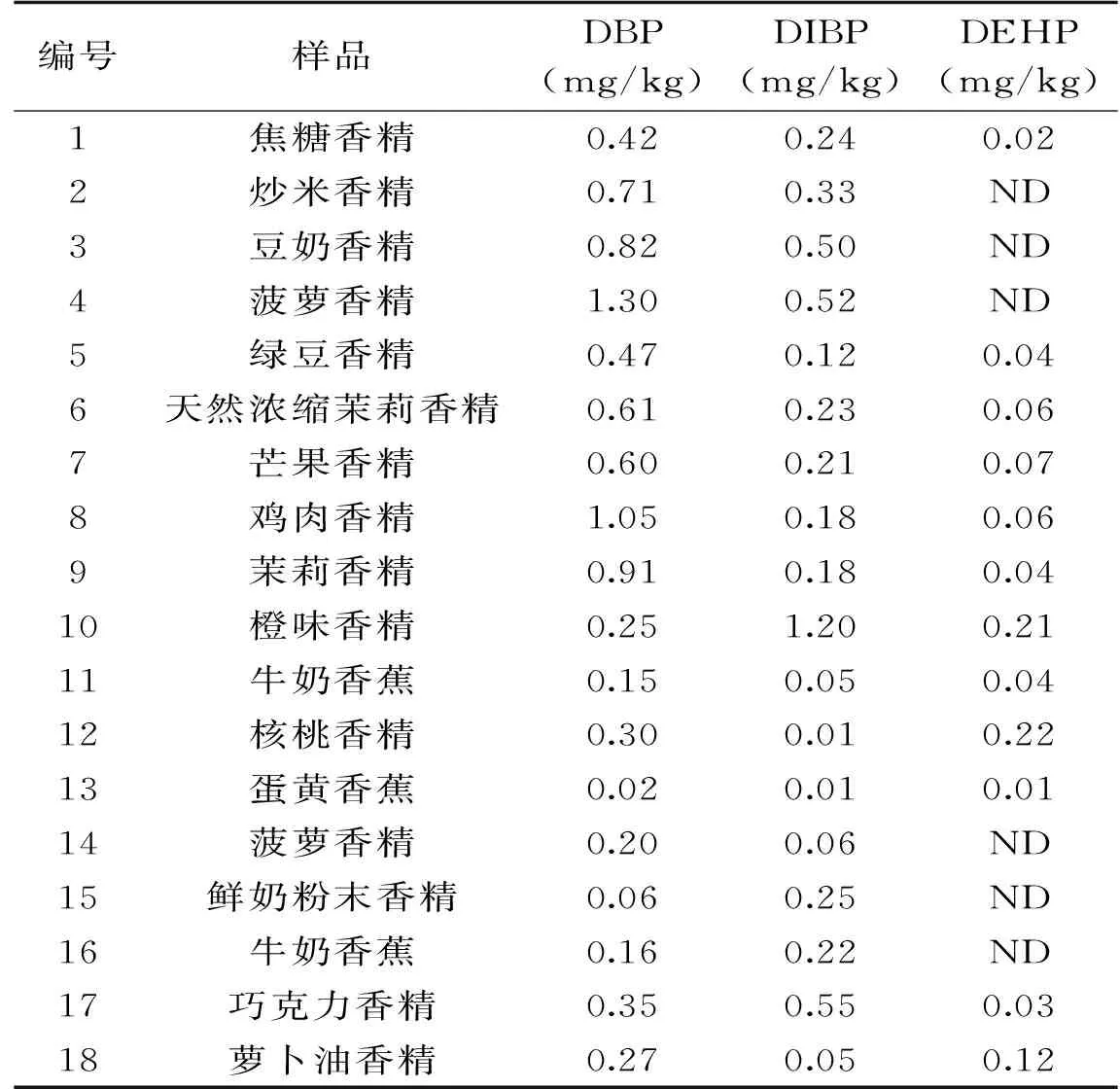
表4 香精中22种邻苯二甲酸酯的检测结果Table 4 The results of 22 phthalate esters
3 结论
本研究建立了气相色谱-三重四级杆串联质谱同时测定香精中22种邻苯二甲酸酯,采用内标法定量。该方法拥有良好的样品净化效果且前处理方法简单,精密度、准确度均能满足日常检测需求,适合大批量检测香精中的22种邻苯二甲酸酯。由于本方法采用了串联三重四级杆质谱,有较高的选择性和灵敏度,可以有效的避免假阳性的产生。在实际样品检测中发现,虽然邻苯二甲酸酯含量不高,低于卫办监督函[2011]773号中的规定,但是检出率较高(45.0%),由于邻苯二甲酸酯的生物危害性,所以应该得到足够的关注。
