丁香非油类成分对LDL的氧化修饰抑制作用
2018-12-07,,,3,4,*,,,,,,,,,
,,,3,4,*,,, ,,,,,,
(1.九江学院药学与生命科学学院,江西九江 332000;2.九江安德和生物科技有限公司,江西九江 332000;3.江苏大学食品与生物工程学院,江苏省农产品物理加工重点实验室,江苏镇江 212013;4.江西农业大学食品科学与工程学院,江西省天然产物与功能食品重点实验室,江西南昌 330045)
低密度脂蛋白(Low density lipoprotein,LDL)属于极低密度脂蛋白的代谢产物,在体内的主要功能是在肝脏和外周组织之间运输甘油三酯和胆固醇[1]。LDL主要由脂质(74%~79%)及蛋白apoB100(21%~26%)组成[2]。LDL富含大量不饱和脂肪酸(Polyunsaturated fatty acids,PUFAs),极易发生氧化修饰,其氧化修饰是形成动脉粥样硬化(Atherosclerosis,AS)的关键,另外,过渡金属离子铜会启动脂质过氧化链式反应,加剧低密度脂蛋白氧化[3-4]。
丁香,为桃金娘科植物丁香(EugeniacaryophyllataThunb)的干燥花蕾,又称公丁香,丁香在国家公布的药食两用原料中抗氧化能力名列第一[5],主要含多酚、鞣质、黄酮及精油等[6]。丁香具有抗癌、抗氧化、抗衰老、抗菌、消炎和促进透皮吸收等作用,也是常用的调味料[2]。根据极性及溶解性特征,本实验将丁香小分子有效成分划分为丁香油和丁香非油类成分(The non-oil components of clove,NCC),其中,丁香油含量约占15%~20%,其内较多的功能活性已被开发研究[7-9],而对丁香除油类成分之外非油类成分的相关功能性活性也相继被发现。沈勇根等[6]发现丁香非油类成分具有很强的抗氧化活性。Hemalatha等[10]采用丙酮、氯仿或甲醇等不同溶剂提取丁香非油类成分,发现甲醇提取物抑制DPPH自由基清除活性最强。Jin等[11]发现,丁香水提物(10 μg/mL)对LDL氧化具有较强抑制作用。目前,对NCC的研究仅限于一级有机溶剂的萃取分离,采用按照极性依次增强的有机溶剂萃取分级制备NCC的研究却尚未见报道。
荧光光谱分析法具有操作简单、灵敏度高、选择性及功能性多等优点[12],被广泛运用于各种蛋白荧光特性的表征[13]。LDL在氧化过程中其所含脂类及蛋白均会产生修饰而改变其结构及荧光光谱性质[14-15]。实验室前期研究发现,丁香乙酸乙酯相对LDL所含蛋白及脂类在氧化修饰过程中的荧光强度淬灭有减缓作用。但是,NCC各极性相对LDL所含蛋白及脂类在氧化修饰过程中荧光特性的影响、相互之间抑制能力的差异还尚不清楚。
因此,本文根据极性从小到大将NCC划分为乙酸乙酯相(Ethyl acetate fraction,EAF)、正丁醇相(N-butyl alcohol fraction,NAF)和水相(Water fraction,WF),建立LDL-CuSO4氧化孵育体系,通过对Lys游离氨基活性、硫代巴妥酸反应物(Thiobarbituric acid reactive substances,TBARS)含量、荧光光谱及三维荧光的测定,确定NCC中抑制LDL氧化修饰能力最强的极性成分,并考察其量效关系,以便确定NCC中抑制LDL氧化修饰的功能活性所对应的有效成分,以利于后续分离、纯化、结构鉴定等研究,促进丁香抗LDL氧化及抗AS功能食品的研发进程。
1 材料与方法
1.1 材料与仪器
丁香 生产日期:2015年10月25号,批号:1510007,购自江西黄庆仁栈华氏大药房,由江西樟树天齐堂中药饮片有限公司分装,产地广西,材料买回后用高速粉碎机粉碎,过40目筛后放置冰箱中备用;低密度脂蛋白(Low density lipoprotein,LDL) 从血站取回健康人的血清,血清通过肝素钠沉淀法[1-2]制备得到LDL,放冰箱备用;肝素钠(185 U/mg) 上海阿拉丁生化科技股份有限公司;2-硫代巴比妥酸(2-Thiobarbituric acid,TBA) 国药集团化学试剂有限公司;2,4,6-三硝基苯磺酸(2,4,6-TrinitrobenzenesuLfonic acid solution,TNBS) 成都格雷西亚化学技术有限公司;其余试剂 均为国产分析纯或优级纯。
LS-55型荧光/磷光/发光分光光度计 美国Perkin Elmer公司;TU-1901型双光束紫外可见分光光度计 北京谱析通用仪器有限责任公司;DFY-C型高速粉碎机 温岭林大机械公司;PB-10型pH计 Sartorius仪器设备有限公司;CT15RT型高速冷冻离心机 上海天美生化仪器设备工程有限公司;RE-52型旋转蒸发仪 上海亚荣生化仪器厂。
1.2 实验方法
1.2.1 低密度脂蛋白的制备 采用文献[1]方法,略有修改。取血浆300 mL,按体积比1∶10倒入沉淀液3000 mL(50000 U/L肝素钠,0.064 mol/L柠檬酸三钠,5 mol/L盐酸调pH至5.04)中混合均匀,磁力搅拌30 s,37 ℃水浴15 min后于4 ℃,3000×g离心10 min,弃上清液。用1500 mL洗涤液(0.064 mol/L柠檬酸钠,pH为5.11)洗涤沉淀,于4 ℃,3000×g再次离心10 min,弃上清液,沉淀物用高盐磷酸盐缓冲液PBS(酸液:160 g/L NaCl、10 mmol/L KH2PO4、2.7 mmol/L KCl;碱液:160 g/L NaCl、10 mmol/L Na2HPO4·12H2O,2.7 mmol/L KCl;用酸液调碱液pH为7.40,即得PBS。)重新溶解,溶解液用再生纤维素透析袋(透析截留分子量50 kDa)于4 ℃、避光透析24 h,每6 h更换一次透析液,后即得LDL溶液,待测。以牛血清白蛋白(Bovine serum albumin,BSA)为标品,采用Lowry’s法[1]测蛋白浓度以计算和配制LDL成相应浓度供测定。
1.2.2 有机溶剂萃取法分离制备NCC NCC各极性部位采用江慎华等[16]方法,略有修改。称取粉碎过40目筛的丁香粉100.00 g,按料液比1∶7 (g/mL)加入甲醇,水浴振荡提取3次,温度25 ℃,每次120 min,提取液合并、浓缩后,加入适量去离子水混悬后,首先采用正己烷充分萃取10次以除去丁香油。剩余部分采用极性依次增大的乙酸乙酯和正丁醇依次萃取10次,最后剩余为水相,这3个萃取相真空浓缩、冷冻干燥后依次得到EAF、NAF和WF粉末,放置在真空干燥器中保存、备用。按以下公式[5]计算得率:
得率(%)=[提取物质量(g)/提取所用丁香的质量(g)]×100
1.2.3 NCC抑制LDL的氧化修饰 以下实验中,空白组:分别以相同体积去离子水和甲醇代替CuSO4和NCC各极性相样液;促氧组:以相同体积甲醇代替NCC各极性相样液;样品组:添加CuSO4和NCC各极性相样液;对照组:添加CuSO4和BHT,其它操作均相同。本文各溶液浓度均指其在混合体系中终浓度。
1.2.3.1 NCC抑制LDL中脂类成分的氧化修饰 采用江慎华等[16]方法,稍作修改。取LDL溶液(3.2 mg/mL)400 μL,加入50 μL 3 mmol/L的CuSO4,加50 μL 30 μg/mL的NCC各相样液及二丁基羟基甲苯(BHT),37 ℃孵育24 h后,加25 μL、1%的EDTA-Na2终止其氧化,再加入15%三氯乙酸(沉淀蛋白质)和0.67%硫代巴比妥酸(TBA)(显色)各1 mL,充分混匀、沸水浴35 min后快速冷却至室温,5000×g离心10 min,取上清液于532 nm测TBARS(TBA反应产物)的OD值,确定LDL脂质氧化程度。
1.2.3.2 NCC抑制LDL中蛋白组分的氧化修饰 荧光定量比较抑制色氨酸(Trp)荧光淬灭效果:运用Chen等[17]方法,稍作修改。取4.9 mL LDL溶液(500 μg/mL),加50 μL甲醇,空白组和促氧组再加入50 μL去离子水或CuSO4(1.25 μmol/L),实验组加入NCC各极性相样液(EAF、NAF、WF),对照组添加BHT(浓度均为5 μg/mL,体积为50 μL),于37 ℃孵育48 h,每次取适量于Ex295/Em330 nm检测荧光强度。
荧光扫描比较抑制色氨酸(Trp)荧光淬灭效果:运用余丹丹等[18]方法,稍作修改。参照以上方法孵育,固定Ex 280 nm、扫描Em 300~450 nm。
保护Lys游离氨基活性的研究:运用Yang等[1]方法,略作修改。取4.9 mL LDL溶液(750 μg/mL),加50 μL CuSO4(5 μmol/L)或去离子水,加50 μL NCC各相样液或BHT(25 μg/mL),37 ℃恒温孵育氧化48 h后,取1 mL该体系混合液与1 mL 4% NaHCO3(pH8.40)混匀后加50 mL、0.1% TNBS,37 ℃孵育1 h后在340 nm处测定吸光度值。
抑制活性醛修饰Lys的比较:运用Picard等[19]方法,稍作修改。参照1.2.3.2荧光定量比较抑制色氨酸(Trp)荧光淬灭效果方法孵育,固定Ex 350 nm,扫描Em 400~550 nm。
1.2.3.3 NCC对总荧光产物产生的抑制效果 采用Cominacini等[20]方法,稍作修改。参照1.2.3.2荧光定量比较抑制色氨酸(Trp)荧光淬灭效果方法孵育,在Ex 360/Em430 nm处检测荧光强度。
1.2.3.4 NCC对脂褐素生成的抑制效果 采用Itakura等[15]和王丽丽等[21]方法,稍作修改。参照1.2.3.2荧光定量比较抑制色氨酸(Trp)荧光淬灭效果方法孵育,在Ex350/Em460 nm处检测荧光强度。
1.2.4 NCC中有效部位——EAF抑制LDL氧化修饰的量效关系测定
1.2.4.1 采用荧光光谱分析EAF对LDL的氧化修饰 采用1.2.3.2和1.2.3.3方法对EAF(5、10和15 μg/mL)抑制Trp荧光淬灭、活性醛修饰Lys和总荧光产物生成的量效关系进行分析和测定。
1.2.4.2 采用三维荧光光谱分析EAF对LDL的氧化修饰 采用Koller等[14]方法,略有修改。参照1.2.4.1方法孵育反应体系,采用Ex 200~420 nm、Em 260~500 nm对体系进行三维荧光光谱扫描以反映EAF抑制LDL氧化修饰效果。
1.3 数据处理
所有实验均为3次重复后求平均值,采用DPS 7.05软件进行显著性差异分析。
2 结果与分析
2.1 有机溶剂萃取法分离制备NCC
采用有机溶剂萃取法分离制备丁香中的NCC,各成分得率如表1所示。随有机溶剂极性的增强,依次萃取得到EAF、NAF和WF,得率EAF>NAF>WF。可见丁香中NCC主要集中在EAF部分,属弱极性成分。

表1 有机溶剂萃取法分离制备NCC的得率(%)Table 1 Extraction yield of NCC based on the organic solvent extraction and separation method(%)
2.2 NCC对LDL的氧化修饰
2.2.1 NCC抑制LDL中脂类成分的氧化修饰 LDL中脂类含量最高,达76%~79%[2],LDL氧化修饰的延迟和增殖阶段主要是脂质中的PUFA发生氧化[1]。因此,本文首先对NCC作用于LDL脂质氧化的抑制效果进行比较。
LDL中PUFA在脂质氢过氧化反应中被氧化修饰生成次级代谢产物(主要是MDA)[22],MDA等再与TBA共价结合生成红色产物(即TBARS),其在532 nm波长处有最大吸收峰[23]。通过测定TBARS的OD值可评价NCC抑制LDL脂质氧化效果,结果如图1所示:空白组的TBARS的OD值高度显著低于促氧组(p<0.01),添加30 μg/mL NCC各极性相后,TBARS的OD值较促氧组高度显著降低(p<0.01),NCC抑制能力强弱顺序为:EAF>NAF>WF。Fu等[24]也发现乌桕树叶EAF对LDL脂质氧化抑制效果强于NAF和WF,与本文结论相似。

图1 NCC对LDL氧化修饰过程中TBARS产生的抑制效果Fig.1 Inhibition efficiency of NCC on TBARS producing during the oxidation modification process of LDL注:不同大写字母表示差异高度显著(p<0.01)。
2.2.2 NCC对LDL中蛋白组分的氧化修饰 LDL在氧化过程中除了脂类被氧化之外,其蛋白部分(21%~24%)也容易发生氧化修饰[1],这种蛋白氧化主要表现为Trp及Lys残基氧化修饰[1-2]。
2.2.2.1 NCC对LDL所含Trp的氧化修饰 在上述2.2.1中测定发现NCC对LDL脂类氧化修饰具有较好抑制效果的基础上,本文继续对NCC抑制LDL所含蛋白apoB100氧化进行测定。
蛋白质分子中,Trp能够发射荧光[25],但Trp易受氧化修饰(特别是Cu2+氧化),在氧化延迟阶段末期,apoB100被氧化、Trp残基减少,导致其在Ex295/Em 330 nm处荧光发生淬灭[26]。荧光强度越高,说明淬灭越少,抑制效果越好[1-2]。
测定NCC抑制Trp荧光淬灭的结果如图2A所示。在NCC(5 μg/mL)中,对Trp荧光淬灭的抑制效果呈现出显著性差异(p<0.05),EAF荧光强度最大,抑制效果最强,相比于促氧组呈现出显著的抑制效果。而NAF及WF的荧光强度均较低,未呈现出明显的抑制效果。
在上述定量检测的基础上,在Ex 280 nm、Em 300~450 nm进行荧光扫描得到结果如图2B所示。该图显示,各样液荧光强度均在Em 340 nm左右达最高峰。NCC中EAF峰值最高,呈现出较NAF及WF更强的抑制效果,与上述定量结果一致、相互印证。Chen等[17]发现杏仁皮能够抑制Trp荧光淬灭的主要原因是富含大量多酚,能够清除自由基、螯合过渡金属离子。实验室前期工作也发现,EAF的多酚含量显著高于NAF和WF(p<0.05),可能是EAF中这些多酚对Trp荧光淬灭起主要抑制作用[22]。

图2 NCC对Trp荧光淬灭的抑制效果Fig.2 Inhibition efficiency of NCC on Trp fluorescence quenching注:A:Trp荧光淬灭定量比较;B:Trp荧光淬灭扫描比较;a:空白;b:BHT 5 μg/mL;c:EAF 5 μg/mL;d:WF 5 μg/mL;e:促氧;f:NAF 5 μg/mL;不同大写字母表示差异显著(p<0.05),图3同。
2.2.2.2 NCC对LDL所含Lys的氧化修饰 NCC对LDL所含Lys游离氨基活性有衰减作用,LDL蛋白中除了上述Trp容易氧化修饰以外,其中的Lys在LDL氧化修饰的降解阶段,脂类氧化产生的醛类终产物(如MDA等)会结合并修饰Lys残基,导致Lys游离氨基活性降低[27]。Lys游离氨基与TNBS反应形成的复合物在340 nm处有紫外吸收,可用Lys活性高低来表征LDL被氧化修饰程度。吸光度值越高,Lys游离氨基活性越高,被修饰程度越低[2]。
NCC对LDL所含Lys的氧化修饰的测定结果如图3所示。在NCC中,仍以EAF的OD值最大,WF的OD值最小,EAF对Lys活性衰减的抑制作用显著高于NAF及WF(p<0.05),且EAF与BHT无显著性差异,说明NCC中的EAF能有效抑制LDL在氧化过程中Lys游离氨基活性衰减,且其抑制效果甚至达到了同浓度BHT的水平,获得与2.2.1类似的结果。可能原因是,NCC能抑制LDL脂质氧化修饰,通过减少脂质过氧化物的生成来减少载脂蛋白apoB100中Lys游离氨基衰减。Sicchieri等[26]研究红酒抑制LDL氧化时也发现,Lys游离氨基衰减与脂质氧化正相关。

图3 NCC抑制Lys游离氨基氧化活性衰减结果Fig.3 Results of NCC inhibiting Lys free amino oxidation activity attenuation
对NCC抑制Lys游离氨基氧化过程中荧光光谱变化的比较发现,PUFA氧化产生的脂质氧化产物(如MDA)会与Lys残基上的游离氨基共价结合形成希夫碱,该产物在Ex350/Em 400~550 nm有荧光吸收。荧光强度越高,表示氧化修饰程度越强[19]。
为进一步验证Lys荧光淬灭扫描结果,如图4所示。各组荧光光谱走势基本相同,促氧组荧光强度最高,空白组最低。NCC的荧光强度位于促氧组与空白组之间,表明NCC对活性醛和MDA与Lys游离氨基结合具有抑制作用。其中,在NCC中EAF的抑制效果最强,NAF其次,WF最小。Picard等[19]也发现,氨基胍能抑制MDA等活性醛修饰LDL所含apoB100,NCC也可能通过捕获脂质过氧化产物分解形成的活性醛,以抑制这些活性醛与Lys结合产生荧光信号[19]。该结果与2.2.2.2中测定Lys游离氨基活性的结果相互印证。
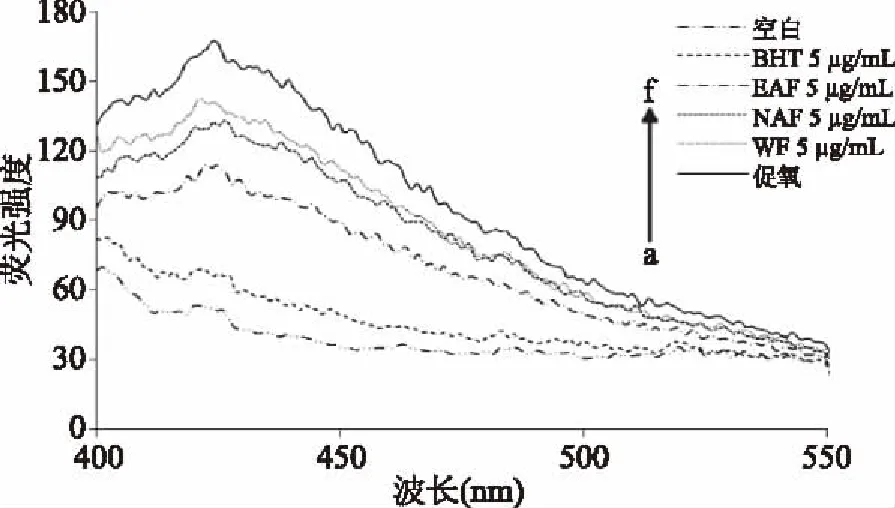
图4 NCC对活性醛修饰Lys残基的抑制效果Fig.4 Inhibition efficiency of NCC on reactive aldehyde modified Lys residue注:a:空白;b:BHT 5 μg/mL;c:EAF 5 μg/mL;d:NAF 5 μg/mL;e:WF 5 μg/mL;f:促氧。
2.2.3 NCC抑制总荧光产物及脂褐素产生 LDL氧化修饰不仅体现在上述2.2.1~2.2.2中表现出来的脂质或蛋白组分,还体现在其脂质代谢产物修饰本身所含的蛋白组分。于是,在1.2.3.1、1.2.3.2比较NCC对LDL所含单独脂类、单独蛋白氧化抑制的基础上,进一步对NCC抑制LDL氧化过程中所含脂质代谢产物修饰蛋白组分的抑制效果进行了比较。
总荧光产物和脂褐素是脂质代谢产物与蛋白质过氧化形成的复合产物,它在体内堆积是机体明显衰老的指标,它反映细胞被自由基损伤的程度[21,28]。按照1.2.3.3和1.2.3.4方法测定NCC抑制LDL氧化过程中总荧光及脂褐素产生效果,结果如图5所示。可看出,促氧组荧光强度极显著高于空白组(p<0.001),表明LDL氧化产生大量荧光产物和脂褐素。加入NCC样液后荧光强度极显著低于促氧组(p<0.001),表明NCC样液能有效抑制荧光产物和脂褐素形成。在NCC中,EAF相荧光强度最低,NAF荧光强度次之,WF荧光强度最高(p<0.001),说明EAF对LDL氧化过程中总荧光及脂褐素产生的抑制效果最强。沈勇根等[6]发现,NCC对清除自由基和脂质过氧化具有很强的抑制能力,且抑制效果排序为:EAF>NAF>WF,与本文对总荧光产物及脂褐素产生的抑制效果排序一致。因总荧光产物及脂褐素为LDL氧化过程中脂类氧化代谢物与蛋白相互作用的产物[21],所以EAF很可能通过有效抑制脂质过氧化产物生成而达到抑制总荧光产物及脂褐素产生的能力。

图5 NCC对LDL氧化修饰过程中总荧光及脂褐素产生的抑制效果Fig.5 Inhibition efficiency of NCC on the total fluorescenceand lipofuscin production during oxidative modification of LDL注:A. 对荧光产物生成的抑制效果;B.对脂褐素生成的抑制效果;不同大写字母表示差异极显著(p<0.001),图8同。
上述试验中,NCC中EAF有些指标抑制LDL氧化修饰功效不及同浓度的阳性对照BHT,主要原因可能是BHT为分析纯,而EAF为混合物,所含成分复杂,不具有氧化抑制效果的杂质较多,导致有效成分含量比同浓度BHT低的缘故。若进一步纯化各极性部位,提高有效成分含量,其抑制作用可能会等同、甚至高于同浓度BHT[1]。后续对EAF分离、纯化工作正在进行中。
多酚、黄酮被认为是植物抗氧化活性的主要物质基础[25]。本文发现,NCC中EAF对LDL氧化修饰抑制作用最强,为NCC中抗氧化的有效部位[5]。且实验室前期研究发现,在NCC中EAF总多酚、总黄酮含量最高,可能正是EAF这些高含量、同时具有强抗氧化活性的多酚、黄酮对LDL氧化修饰的抑制起主要作用[1,6]。王昌禄等[28]通过生物活性追踪后也发现,香椿老叶EAF中总多酚及总黄酮含量比NAF和WF高、抗氧化活性最强,为抗氧化有效部位,与本文的结论相似。
2.3 EAF抑制LDL氧化修饰的量效关系
在上述2.2发现EAF为NCC抑制LDL氧化修饰有效部位的基础上,本文进一步对EAF抑制LDL氧化修饰的量效关系进行了相关分析。
2.3.1 EAF抑制Trp荧光淬灭的量效关系 对EAF抑制Trp荧光淬灭的扫描结果如图6。各组Trp荧光光谱走势相近,各样品均在Em350.27 nm处有最大荧光强度。由金属离子Cu2+氧化修饰的促氧组的Trp波峰明显低于空白组,原因可能是金属离子Cu2+易攻击apoB100上的游离氨基酸残基[17,26]。5 μg/mL EAF波峰与促氧组相近,添加10、15 μg/mL EAF在Em 350.27 nm处波峰依次增大,与浓度正相关,具有良好的量效关系(p<0.001)。Saoudi等[29]也发现,云芝中的漆酶成分的Trp荧光猝灭与醋酸的浓度有良好的量效关系,与本文研究有相似的结果。
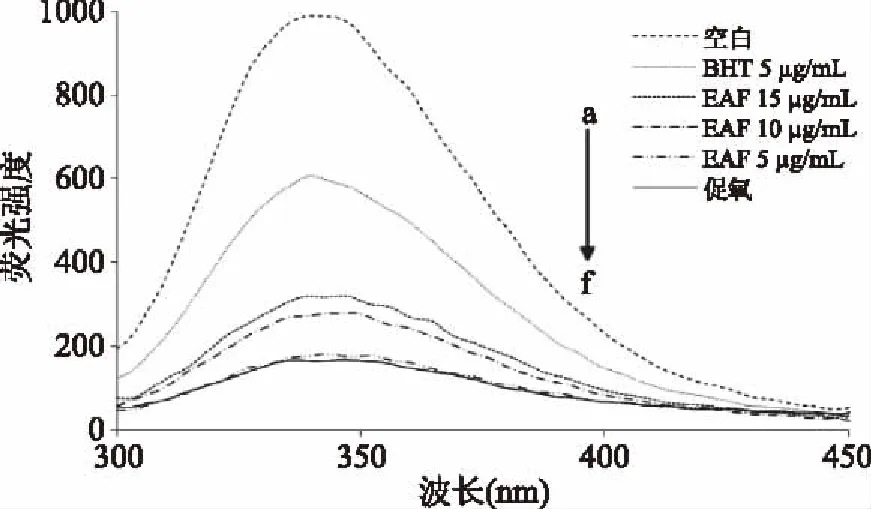
图6 EAF对Trp荧光扫描淬灭的量效关系Fig.6 Dose-effect relationship of EAF on Trp fluorescence quenching by fluorescence scanning注:a:空白;b:BHT 5 μg/mL;c:EAF 15 μg/mL; d:EAF 10 μg/mL;e:EAF 5 μg/mL;f:促氧。
2.3.2 EAF抑制活性醛修饰Lys残基的量效关系 上述结果发现,EAF抑制Trp荧光淬灭呈现较好的量效关系,继续对EAF抑制活性醛氧化apoB100中Lys游离氨基的效果进行了分析,结果如图7所示。各组荧光光谱呈现出相近的走势,且促氧组荧光强度最高,表明脂质氧化产物与Lys游离氨基结合形成Schiff碱,荧光强度明显增加[19]。不同浓度EAF荧光强度位于促氧组与空白样之间,15 μg/mL EAF的峰值甚至比5 μg/mL BHT更低,表明其抑制效果比5 μg/mL BHT更强。高浓度(10、15 μg/mL)EAF显示出对活性醛修饰Lys良好的抑制效果,可能是因为EAF的成分能够抑制活性醛产生,以保护Lys残基不受氧化修饰。Picard等[19]得到了与本文类似的结果。
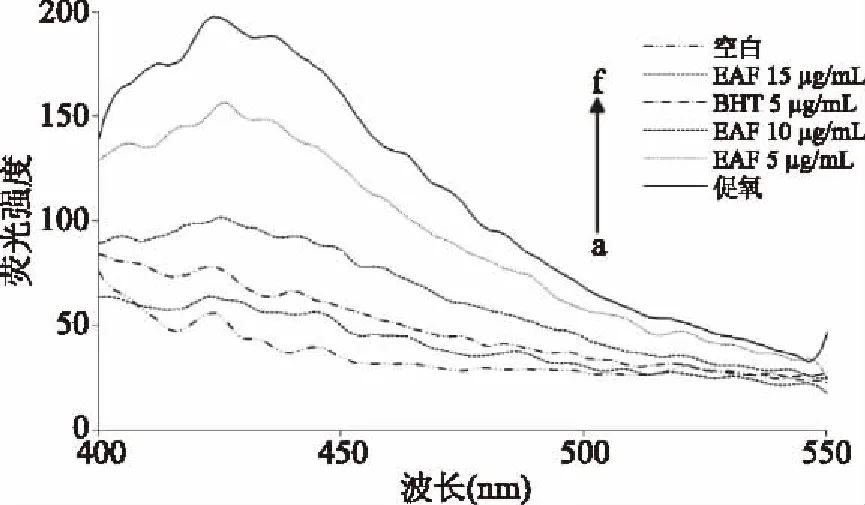
图7 EAF对活性醛修饰Lys的量效关系Fig.7 Dose-effect relationship of EAF on active aldehyde modified Lys注:a:空白;b:EAF 15 μg/mL;c:BHT 5 μg/mL; d:EAF 10 μg/mL;e:EAF 5 μg/mL;f:促氧。
2.3.3 EAF抑制总荧光产物产生的量效关系 为进一步测量EAF抑制总荧光产物生成,按照1.2.4.1方法测量结果如图8所示。其中5 μg/mL EAF的荧光强度低于促氧组,表明在此低浓度的EAF对总荧光产物的产生已显示出抑制作用。随着浓度增加到10、15 μg/mL时,抑制作用极显著增强(p<0.001),呈现出良好的剂量依赖关系。其中,与EAF对Lys氧化抑制效果一样,15 μg/mL的EAF对总荧光产生的抑制效果也强于5 μg/mL的BHT。王丽丽等[21]也发现,紫丁香叶提取物对LDL氧化抑制随浓度增加而增强,与本文结果相似。
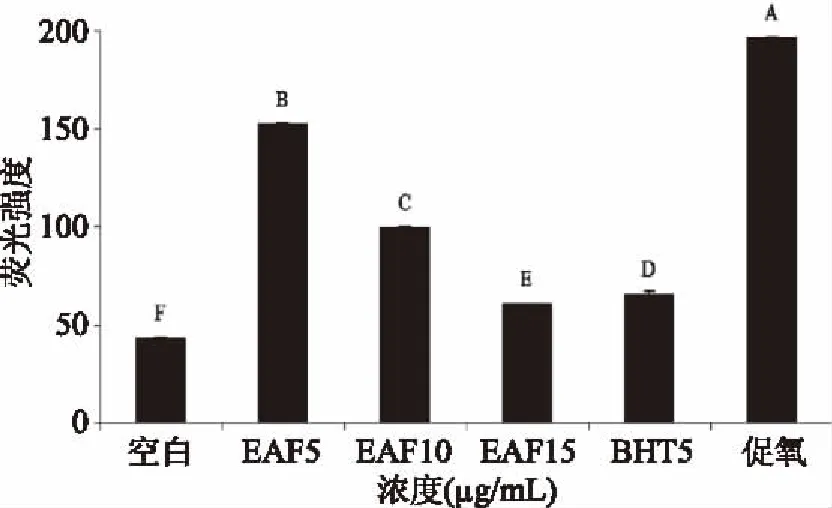
图8 EAF抑制总荧光产物生成的量效关系Fig.8 Dose-effect relationship of EAF inhibiting the total fluorescent products generated
2.3.4 采用三维荧光光谱解析EAF对LDL氧化修饰的抑制效果 为更全面、深入检测EAF对LDL氧化修饰效果,本文进而采用三维荧光扫描获得等高线图来反映其对LDL氧化期间的抑制效果[15],结果如图9所示。

图9 三维荧光高线表征EAF抑制LDL氧化修饰的量效关系Fig.9 Dose-effect relationship of EAF on LDL oxidation modification by three-dimensional flourescence contour spectroscopy注:(a)空白组;(b)5 μg/mL EAF;(c)10 μg/mL EAF;(d)15 μg/mL EAF;(e)BHT;(f)促氧组。
图9(a)为空白组,在Peak A处(Ex280/Em 330 nm)含有一个明显的荧光发色团(荧光强度为800),为Trp内源荧光[15]。其荧光信号保持完整,表明LDL受到氧化修饰程度低。图9(f)为促氧组,在Peak A的荧光强度(190.62)明显降低,在Peak B(Ex360/Em 430 nm)处出现新的荧光发色团,荧光强度高达190.62,其荧光信号有明显发散且发射波长出现红移,显示出LDL氧化修饰产生的脂质氧化产物与Lys残基发生共价结合,形成在该处具有荧光吸收的希夫碱增加了该处的荧光强度[30]。从图9(b)~图9(e)可看出,添加不同浓度的EAF和BHT后,LDL氧化修饰产生在Ex280/Em 330 nm(Peak A)处的荧光信号逐渐增大,但均低于空白组;在Peak B处的荧光信号都比促氧组低,表明LDL氧化过程中Trp发生了不同程度的荧光淬灭,且抑制效果与EAF浓度正相关[17-18]。并且随浓度增大,EAF对LDL氧化过程中形成希夫碱的抑制作用也增大,从而降低了在Peak B处的荧光强度[30]。
以上结果表明,NCC中EAF能有效抑制Trp荧光淬灭、荧光信号红移及Lys残基被修饰,其抑制功效呈现出较好的量效关系。丁香能有效抑制脂质氧化、降低脂质氧化产物含量,间接减少荧光物质产生,本文与Mclean等[31]结果类似。
3 结论
NCC各极性相能不同程度抑制LDL氧化过程中脂质、蛋白及脂质氧化产物修饰蛋白的变化,抑制LDL荧光光谱特性变化,且EAF的抑制效果明显强于NAF和WF,EAF为NCC抑制LDL氧化修饰的有效部位。不同浓度的EAF对LDL氧化修饰的抑制作用不同,且抑制效果与浓度成正比,呈现出良好的量效关系。本文为后续重点对NCC中EAF分离、纯化及结构分析、阐明丁香抑制LDL氧化修饰物质基础及功能食品研发提供参考。
