红树莓多糖降血脂作用
2018-12-07,,
, ,
(哈尔滨商业大学,食品工程学院省高校食品科学与工程重点实验室,黑龙江哈尔滨 150076)
随着人们生活质量的上升,高血压、高血脂症等这些营养性疾病的发生率也在呈上升趋势[1-2],成为威胁人类生命健康的主要疾病[3]。调节方法有很多,例如运动锻炼、控制饮食和服用贝特类、烟酸类药物等,但是药物都有毒副作用[4],因此,找到更为健康的治疗高血脂症的物质成为研究的新热点。
近些年对于植物多糖的研究较多,研究表明多糖具有调节机体免疫力、抗氧化、抗肿瘤、抗疲劳、抗癌、抗菌、防辐射以及降糖脂等生理活性[5-8],于美汇、赵鑫等[9]采用碱法提取黑木耳多糖,并且研究了其体内外降血脂作用,结果表明黑木耳多糖具有降血脂作用。毛贵元[10]采用水提醇沉法提取红雪茶多糖,研究表明红雪茶粗多糖剂量在0.3 g·kg-1·d-1具有明显的降脂保肝作用[11]。
红树莓(RubusidaevslL.)属于蔷薇科悬钩子属,又俗称托盘、悬钩子等[12],红树莓其果汁丰富,富含多种维生素和矿物质,含有多糖、黄酮类、SOD、鞣花酸等活性物质[13-14],广泛分布在温带地区的欧洲[15],树莓因其丰富的营养价值而受人们喜爱[16]。目前,国内外对于红树莓的研究为多酚、鞣花酸和花色苷等,而对于红树莓多糖的研究相对较少,Yu等[17]采用复合酶法提取红树莓多糖研究了生物活性。杨永晶等[18]采用气相色谱-质谱联用的方法测定树莓多糖中单糖组成成分,确定树莓多糖由鼠李糖、阿拉伯糖、木糖、甘露糖、葡萄糖和半乳糖组成。目前,红树莓多糖对降血脂作用的研究未见报道,因此本文以红树莓为原料,提取并纯化多糖,研究其降血脂作用,为红树莓多糖的降血脂功效提供理论依据。
1 材料与方法
1.1 材料与仪器
6月份新鲜采摘的红树莓鲜果 尚志市帽儿山果园;清洁级Wistar雄性大鼠(200±5) g、生产许可编号:Scxk(Ji)-2011-000、合格证编号:201500010264) 长春亿斯动物中心;浓硫酸 天津渤海化工股份有限公司,分析纯;苯酚 天津渤海化工股份有限公司,分析纯;果胶酶(8911±145.93) U/g 北京博奥拓达科技有限公司,分析纯;纤维素酶(9692±101.13) U/g 北京博奥拓达科技有限公司,分析纯;葡萄糖 天津石英钟厂霸州市化工分厂,分析纯;DEAE-Sepharose Fast Flow、Sephadex G-100 Whatman公司;胆固醇 上海惠世生试剂有限公司,分析纯;猪胆盐 北京奥博星生物试剂有限责任公司,分析纯;猪油 自制;基础饲料 长春亿斯动物中心。
TU-1900型紫外可见分光亮度计 北京普析通用仪器有限责任公司;MC型精密电子天平 北京赛多利斯仪器系统有限公司;FW177型中草药粉碎机 上海思尔达科学仪器有限公司;ZDF-6090型真空干燥箱 上海恒一科学仪器有限公司;SR-A10N-50冷冻干燥机 上海舍岩仪器有限公司;色谱柱 沃特世科技(上海)有限公司。
1.2 实验方法
1.2.1 红树莓多糖制备 准确称取一定量的红树莓,洗净后摆放在干净的托盘中,在55 ℃低温条件下进行烘干处理,粉碎,过80目筛。采用复合酶法提取红树莓多糖[19]。按料液比1∶30 g/mL、添加复合酶(果胶酶∶纤维素酶=1∶2)1.5%和pH4.0条件下,30 ℃水浴锅中酶解25 min,灭酶并过滤(100 ℃,10 min),滤液为红树莓多糖粗提液[20],旋转蒸发至原体积1/4后冷冻干燥(最低冷却温度-60 ℃、压力为0.001 mBar),分别过DEAE-Sepharose Fast Flow离子交换柱层析和葡聚糖凝胶柱层析,收集主峰,蒸发浓缩,冷冻干燥,得到分离纯化后的红树莓多糖,进行分子量测定和单糖组成分析[21]。
1.2.2 多糖含量测定
1.2.2.1 葡萄糖标准曲线的制作 配制浓度为0.1 mg/mL的葡萄糖溶液,分别吸取0.2、0.4、0.6、0.8、1.0 mL于比色管中,加入蒸馏水至2.0 mL,各加入6%苯酚溶液1.0 mL,摇匀,迅速加入5.0 mL浓硫酸,静置10 min后摇匀于室温下放置20 min,于490 nm测定吸光度A[22]。将葡萄糖的质量浓度作为横坐标,吸光度A为纵坐标绘制标准曲线[23]。
1.2.2.2 红树莓多糖含量的测定 准确移取1.0 mL红树莓多糖提取液,按照葡萄糖标准曲线制作的方法测定其多糖含量,计算多糖得率。
式(1)
式中:X为多糖得率,%;c为测量浓度,μg/mL;n为稀释倍数;V为提取液体积,mL;m为原料干重,g;0.934为红树莓总糖换算成多糖系数。
1.2.3 红树莓多糖分子量测定 采用高效液相凝胶色谱法测定红树莓多糖分子量。色谱条件如下:色谱柱为水溶性凝胶柱 120+水溶性凝胶柱 250+水溶性凝胶柱 2000;流动相为超纯水;流速为0.6 mL/min;柱温为40 ℃;进样量为20 μL;检测器为Waters 2414示差折光检测器,将红树莓多糖配制成3 mg/mL的溶液,8000 r/min离心10 min,取上清液过0.45 μm微滤膜,进样20 μL[24]。取不同相对分子质量的葡聚糖配成2%的溶液,绘制标准曲线,纵坐标和横坐标分别是标准多糖分子量的对数值(Lg)、保留时间,计算样品分子量[25]。
1.2.4 红树莓多糖单糖组成分析 采用气相色谱法对红树莓多糖的单糖组成进行分析。色谱条件如下:检测器为FID;载气和流速为N2、流速为2 mL/min、空气流速为550 mL/min;流速为0.6 mL/min;气化室柱温250 ℃、检测器柱温250 ℃;程序升温:180 ℃(5 min)-240 ℃(25 min),3 ℃/min;进样量0.8 μL[25]。标准品顺序为鼠李糖、岩藻糖、阿拉伯糖、木糖、甘露糖、葡萄糖、半乳糖。取多糖样品10 mg,2 mol/L三氟乙酸加1 mL,120 ℃水解3 h,水解液4000 r/min离心10 min,加2 mL甲醇,反复蒸干。再加入2 mL双蒸水、30 mg硼氢化钠,还原3 h,用冰醋酸中和,减压蒸干,多次加甲醇5 mL,110 ℃烘干,然后各加入乙酸酐、吡啶0.5 mL,100 ℃下保温1 h,冷却后,加入甲苯3 mL,重复多次蒸干,再加入3 mL三氯甲烷,双蒸水反复洗涤3此后,倒掉上层水溶液,加入无水硫酸钠,过0.22 μm微滤膜,进行气相色谱分析[24-25]。
1.2.5 红树莓多糖降血脂作用研究
1.2.5.1 高脂饲料配方 大鼠的高脂饲料配方:78.8%基础饲料,10%蛋黄粉,10%猪油,0.2%猪胆盐,1%胆固醇[26]。
1.2.5.2 动物模型建立与分组 Wista雄性大鼠,进行适应性饲养一周后,禁食12 h并按照每组10只随机分成5组,分别为正常对照组(Normal control,NC)、阳性对照组(Positive control,PC)、红树莓多糖低剂量组(Low control,LC)、红树莓多糖中剂量组(Mid control,MC)、红树莓多糖高剂量组(High control,HC)[27]。正常组喂食基础饲料,其他四组均喂食高脂饲料。成功建立高脂模型后,对大鼠的饮水和禁食不加限制,21 d后禁食过夜(12 h),次日采血[28]。
1.2.5.3 高血脂症大鼠的降血脂实验 选取建模成功的大鼠,设定合适的剂量,给大鼠进行灌胃[29]。具体灌胃剂量如表1。

表1 高血脂症模型大鼠分组Table 1 The group of hyperlipidemia rats
1.2.5.4 动物模型体质量的测定 分别于0、7、14、21 d对大鼠体重进行跟踪测定,观察红树莓多糖对降血脂模型大鼠体质量的影响[30]。
1.2.5.5 高血脂症大鼠血脂指标的测定 大鼠连续灌胃21 d后,禁食过夜12 h,眼眶取血10 mL,用3000 r/min离心10 min,将分离出的血清,-20 ℃冰箱冷冻保存。用全自动生化分析仪,分别来测定血清中四项指标TC(总胆固醇)、TG(甘油三酯)、LDL-C(低密度脂蛋白)和HDL-C(高密度脂蛋白)的含量[27,31]。
1.3 数据处理与统计分析
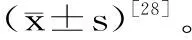
2 结果与分析
2.1 葡萄糖标准曲线绘制结果与分析
如图1可知,在490 nm下测得葡萄糖标准曲线,葡萄糖标准溶液浓度与吸光值之间的回归方程为:y=0.0146x+0.0021,R2=0.9997。
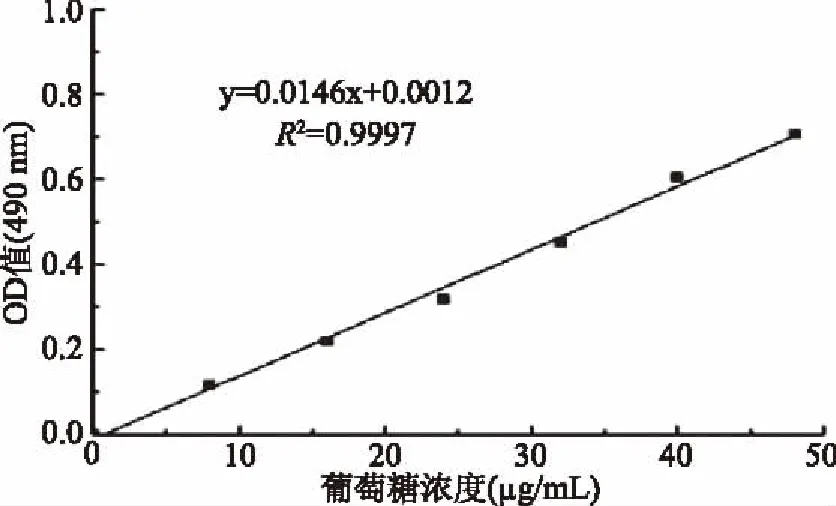
图1 葡萄糖标准曲线Fig.1 The standard curve of glucose
2.2 RRP-I分子量测定结果与分析
根据图3可知,RRP-I的出峰时间为7.829 min,将其带入回归方程(图2)中,计算得出RRP-I的分子量为11220.1845 Da。
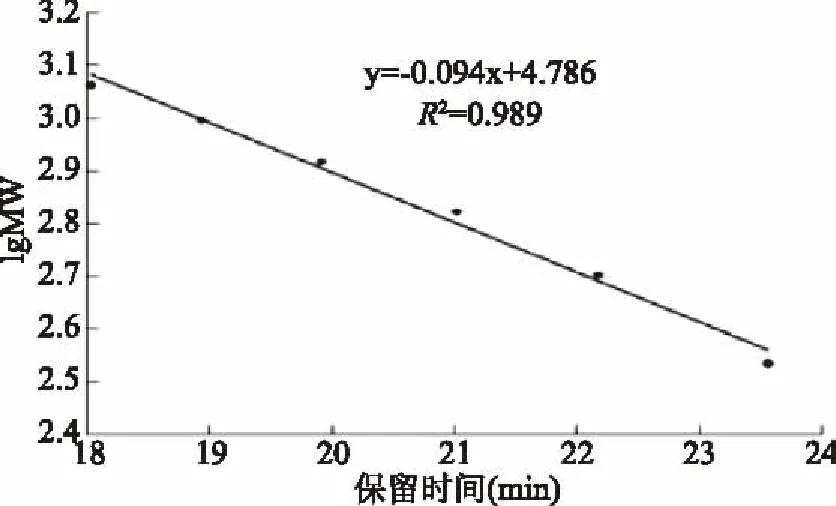
图2 葡聚糖标准曲线Fig.2 Dextran standard curve
图3 RRP-I的高效液相凝胶色谱图Fig.3 RRP-I high performance gel liquid chromatography
2.3 RRP-I单糖组成结果与分析
标准品顺序依次为鼠李糖、岩藻糖、阿拉伯糖、木糖、甘露糖、葡萄糖、半乳糖。由实验结果对比可知,RRP-I组成为葡萄糖。
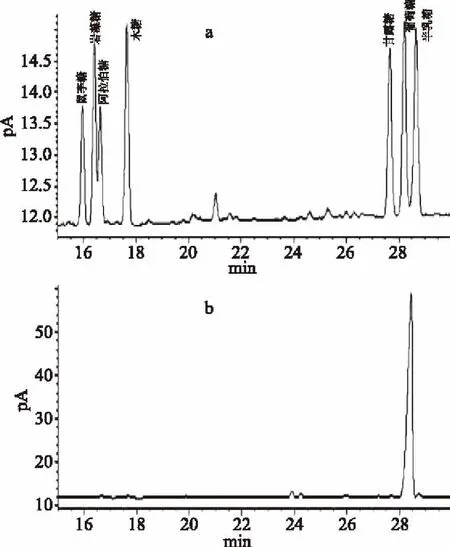
图4 标准单糖和RRP-I GC图谱Fig.4 Standard monosaccharide and RRP-I gas chromatography注:a:标准葡聚糖;b:RRP-I。
2.4 红树莓多糖降血脂作用的结果与分析
2.4.1 大鼠体质量测定结果与分析 如表2可知,在第0 d各组之间的体重趋于平衡,无明显涨幅。经口灌胃7 d,各组体重呈现上升趋势,其中NC组和DC组显示持续生长且高于相同时间段治疗组的体重。DC组的大鼠体重与NC组相比具有显著性(p<0.05)。HD、MD、LD组的大鼠体重与NC组相比具有显著性(p<0.0001);HD、MD、LD组的大鼠体重与DC组相比显著(p<0.05),DC体质量高于其它组,并且在21 d后与NC组体质量极显著(p<0.0001)。RRP-I剂量组对大鼠体重增加有一定的改善作用,且呈现剂量性依赖。
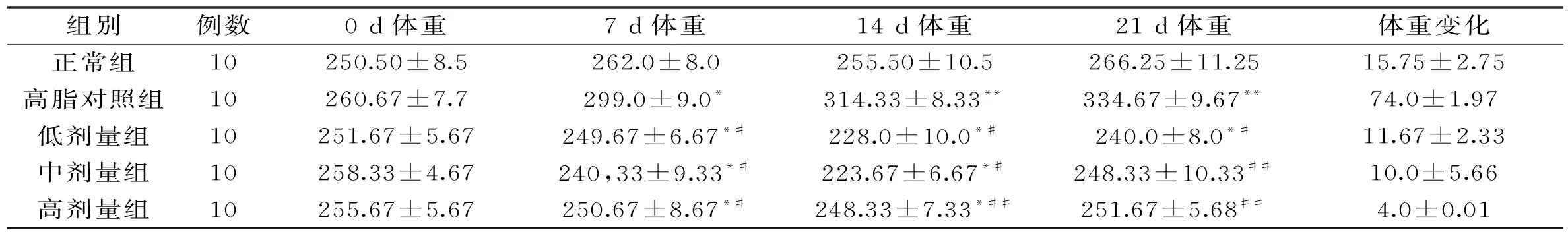
表2 RRP-I对大鼠体重的影响(g)Table2 Effects of RRP-I on body weight in rats(g)
2.4.2 红树莓多糖对高血脂症大鼠血脂水平影响的结果与分析
2.4.2.1 红树莓多糖对高血脂症大鼠TC水平影响的结果与分析 由图5可见,DC组大鼠血清中的TC水平与NC组相比极显著(p<0.0001)升高,证明高血脂症大鼠造模成功。HD、MD和LD组大鼠血清中的TC水平与NC组相比显著升高,HD、MD和LD组大鼠血清中的TC水平显著低于DC组,张海华[27]、付莹[28]、宁娜[29]等已经证实这个变化水平,血清TC水平增高,可使高血脂的发病率明显升高,RRP-I高、中、低剂量可以显著降低血清TC水平,实验期间内可以起到改善高血脂症的作用。
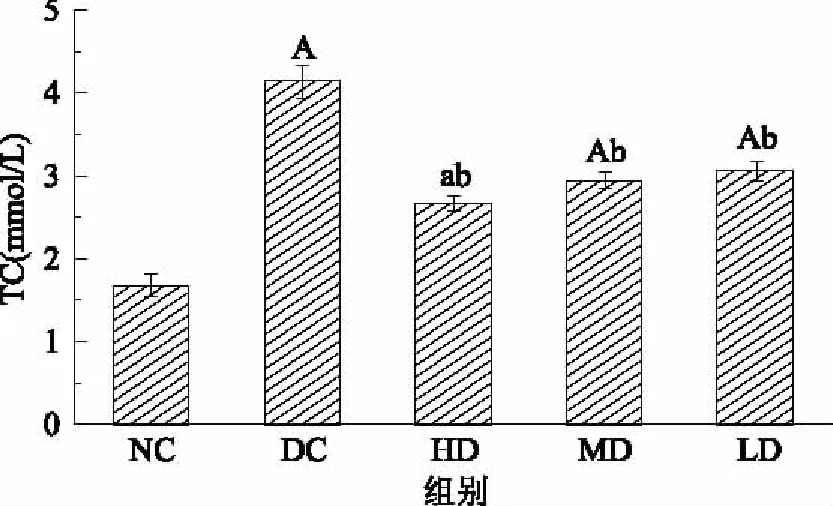
图5 RRP-I对大鼠TC水平的影响Fig.5 Effects of RRP-I on TC level in rats注:a:p<0.05,A:p<0.0001与NC组比较; b:p<0.05,B:p<0.0001与DC组比较;图6~图8同。
2.4.2.2 红树莓多糖对高血脂症大鼠TG水平影响的结果与分析 由图6可见,DC组大鼠血清中的TG水平显著高于NC组,证明高血脂症大鼠造模成功。HD、MD和LD组大鼠血清中的TG水平与NC组相比显著升高,HD、MD和LD组大鼠血清中的TG水平显著低于DC组(p<0.05),表明高脂血症的TG水平可以被RRP-I高、中、低剂量降低,实验期间内可以起到改善高血脂症的作用。
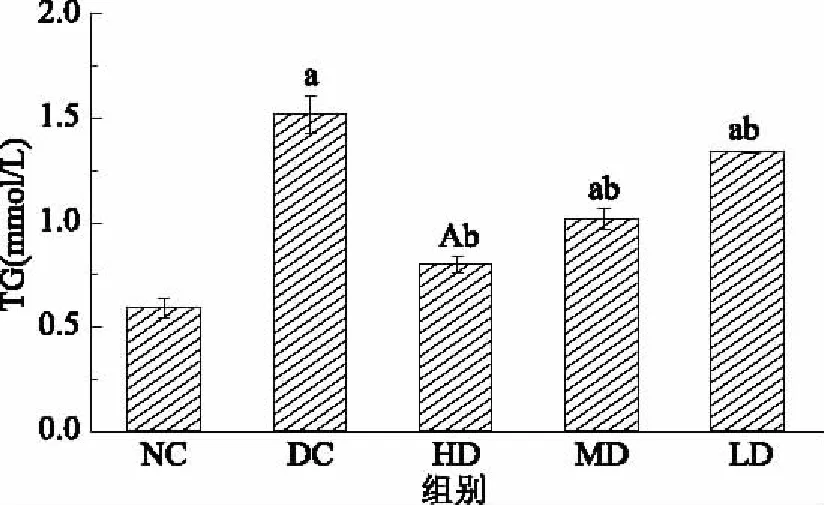
图6 RRP-I对大鼠TG水平的影响Fig.6 Effects of RRP-I on TG level in rats
2.4.2.3 红树莓多糖对高血脂症大鼠LDL-C水平影响的结果与分析 由图7可见,DC组大鼠血清中的LDL-C水平与NC组相比显著升高(p<0.05),证明高血脂症大鼠造模成功。HD、MD和LD组大鼠血清中的LDL-C水平与NC组相比显著升高(p<0.0001),HD、MD和LD组与DC组相比大鼠血清中的LDL-C水平显著降低,表明RRP-I高、中、低剂量可以显著降低高脂血症的LDL-C水平,实验期间内可以起到改善高血脂症的作用。
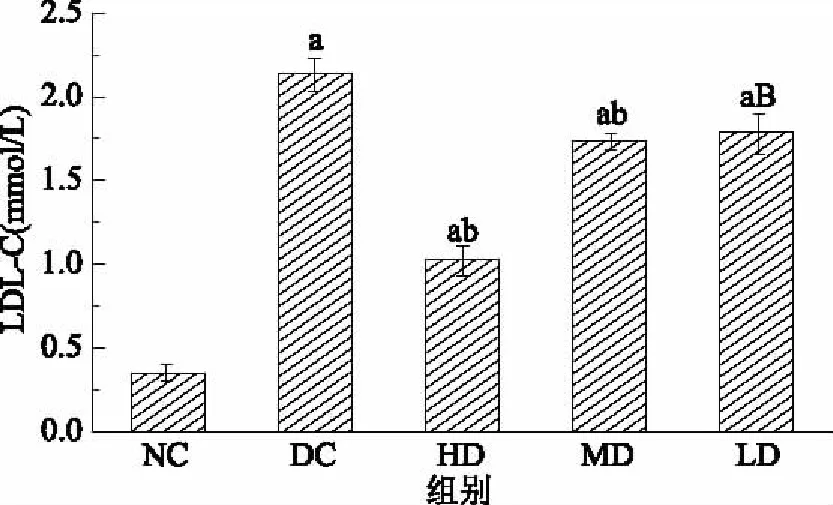
图7 RRP-I对大鼠LDL-C水平的影响Fig.7 Effects of RRP-I on LDL-C level in rats
2.4.2.4 红树莓多糖对高血脂症大鼠HDL-C水平影响的结果与分析 由图8可见,DC组大鼠血清中的HDL-C水平显著低于NC组(p<0.05),证明高血脂症大鼠造模成功。HD、MD和LD组大鼠血清中的HDL-C水平与NC组相比显著升高,HD、MD和LD组大鼠血清中的HDL-C水平显著比DC组高,HDL-C可以抗动脉粥样硬化,RRP-I高、中、低剂量可以显著升高高脂血症的HDL-C水平,实验期间内可以起到改善高血脂症的作用。
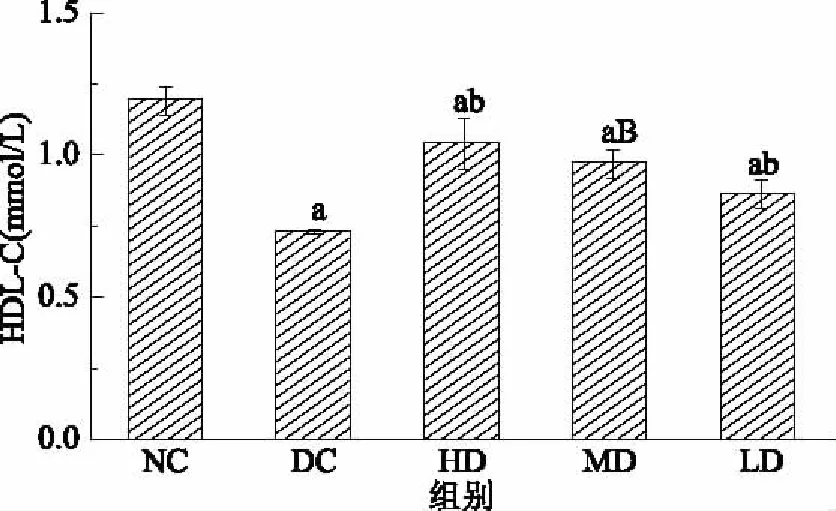
图8 RRP-I对大鼠HDL-C水平的影响Fig.8 Effects of RRP-I on HDL-C level in rats
3 结论
采用复合酶法提取红树莓多糖,并将纯化后得到的红树莓多糖,通过动物实验的方法对红树莓多糖进行降血脂作用的研究。结果显示RRP-I分子量为11220.1845 Da,单糖组成为由葡萄糖组成的均一多糖。模型在灌胃RRP-I 21d时,高中低剂量组对高脂大鼠的体重增加均有一定的改善作用,且呈现剂量性依赖。对患有高血脂症的大鼠有一定的治疗效果,血脂四项的检测结果按照正常的变化趋势变化,TC、TG和LDL-C水平降低,HDL-C水平升高,HD组表现出最好的效果,说明RRP-I可以改善高血脂症大鼠的血脂水平。本文为将研究红树莓多糖降血脂药物提供理论依据。
