静态超高压处理对抗菌复合蛋白薄膜的改性研究
2018-12-07,,2,3,*,
, ,2,3,*,
(1.上海海洋大学食品学院,上海 201306;2.上海水产品加工及贮藏工程技术研究中心,上海 201306;3.农业部水产品贮藏保鲜质量安全风险评估实验室(上海),上海 201306)
现今,食品包装在食品从农田到餐桌的整个过程中起着越来越重要的作用。传统食品包装材料如塑料及其衍生物等高分子合成材料的不可生物降解性和卫生安全方面的问题,使人们逐渐对其失去了信心。绿色复合抗菌薄膜是以天然食用材料如多糖、蛋白质或脂类为原料,通过添加不同的抗菌剂,形成覆盖在食品表面的薄膜或涂层,具有抗菌保鲜作用[1]。
乳清分离蛋白(WPI:Whey Protein Isolate)是由牛奶中的成分分离而成的膳食补充剂和食物成分。乳清分离物含有较高比例的纯蛋白质,可以纯到几乎无脂,无乳糖,无糖,无胆固醇。乳清蛋白具有很高的生物利用度,可以很快被人体吸收利用[2]。Manusawee等[3]已研究出乳清分离蛋白与其他物质共混的成膜工艺和薄膜性能。
酪蛋白酸钠(NaCas:Sodium Caseinate),是牛乳中主要蛋白质——酪蛋白的钠盐,是一种安全放心的增稠剂和乳化剂。同时,酪蛋白酸钠中含有人体所需的各种氨基酸,其营养价值很高。Imane等[4]研究出酪蛋白酸钠的成膜特性和薄膜水溶性的影响因素。寻倩男等[5]研究出酪蛋白酸钠含量的增加会引起薄膜的雾度、透光率和阻气性能的增强。
但是,Md[6]指出以蛋白质为基材的复合抗菌薄膜存在自身的缺陷,如机械性能差、气体透过性和水蒸气透过性强等,所以多采用物理、化学、生物等方法对其进行改性处理。一般认为压强超过100 MPa就是超高压,而超高压技术是目前食品科学与工程技术领域研究的热点之一。它主要是指在室温或者较为温和加热条件下,利用100~1000 MPa的压力处理食品或者食品包装材料等,使生物体高分子立体结构中的氢键结合、疏水结合、离子结合等非共有结合发生变化,使蛋白质变性,以达到杀菌、钝酶和加工食品或改性包装材料的目的。Jingyi Wei等[7]指出超高压能够使混合体系中的蛋白质大分子物质在升解压过程中发生相互作用而改变其凝胶性质和成膜特性。Essam等[8]研究表明,超高压对于蛋白质的三级结构、乳化性、表面疏水性等均有不同程度的影响。
在前期预试验和回归方程模拟设计[9-10]中得到,由6%乳清分离蛋白、4%酪蛋白酸钠、35%甘油和0.25%山梨酸钾复合制备的蛋白质薄膜的各包装性能可达到最好。所以,本实验以此复合蛋白质溶液为基础,控制超高压处理强度和时间,旨在找到一种理想的方法使复合抗菌薄膜的各项性能达到理想状态。
1 材料与方法
1.1 材料与仪器
乳清分离蛋白 食品级,美国希尔玛乳酪公司,蛋白>90.0%,脂肪<7.0%,乳糖<1.0%,灰分<3%;酪蛋白酸钠 食品级,Shanghai Macklin Biochemical Co.,Ltd.;丙三醇 分析纯,上海凌峰化学试剂有限公司;山梨酸钾 GB13736-2008食品添加剂,宁波王龙科技股份有限公司;真空袋 25 cm×36 cm,武汉市喜之龙塑业有限公司。
JA5003电子天平 上海越平科学仪器有限公司;WGT-S透光率/雾度测试仪 上海精科有限公司;DF-101S型集热式恒温加热磁力搅拌器 河南省巩义市科瑞仪器有限公司;SHZ-DⅢ型循环水式多用真空泵 巩义市予华仪器有限责任公司;DHG-9023A型恒温鼓风干燥箱 BPS-250CB型恒温恒湿箱 上海一恒科学仪器有限公司;XLW(EC)型智能电子拉力试验机 济南蓝光机电技术有限公司;PERMATRAN-W Model 1/50G水蒸气透过率测试仪 美国MECON有限公司;0~25 mm电子数显螺旋测微仪 桂林广陆数字测控有限责任公司;GBB-B型热封测试仪 广州标际包装设备有限公司;S3400N型扫描电镜 Hitachi(日立)公司;差示扫描量热仪 Mettler公司;FTIR-650 型傅里叶红外光谱测定仪 天津港东科技发展有限公司。
1.2 实验方法
1.2.1 绿色复合抗菌薄膜的制备 将96 g乳清分离蛋白、64 g酪蛋白酸钠分别加入到1600 mL去离子水中,常温磁力搅拌2 h。并分别85 ℃水浴加热30 min后冷却到25 ℃,将两溶液混合。将混合后的复合蛋白溶液加入57.4 g甘油和4 g山梨酸钾,常温磁力搅拌1 h后平均分成13组,并真空装袋密封。将复合蛋白溶液进行静态超高压处理,设置不同的加压温度、压力、时间。将超高压处理后的复合蛋白溶液进行真空脱气,并将等量的溶液倒入塑料平皿中,放入60 ℃鼓风干燥箱干燥5 h,用镊子将蛋白薄膜从平皿中揭下,放入25 ℃/50% RH的恒温恒湿箱中平衡48 h待用[11]。超高压处理的具体条件见表1。
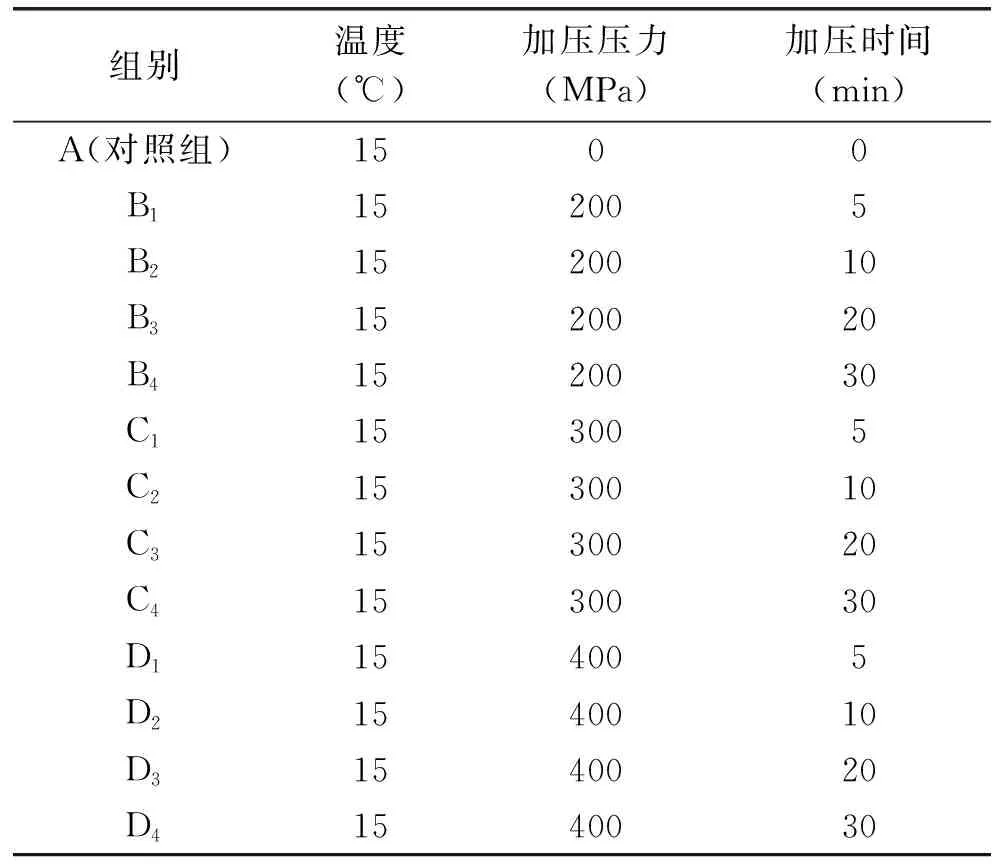
表1 实验分组Table 1 The experimental groups
1.2.2 薄膜性能测试
1.2.2.1 薄膜厚度的测定 取一张待测试薄膜,选取较均匀的五个点,利用电子数显螺旋测微仪分别测量各点厚度,取其平均值,得到平均厚度。测得的平均厚度值用于气体透过率、抗张强度等性能测试结果的计算。
1.2.2.2 傅里叶红外光谱分析 由于红外光谱测定仪对样品湿度和环境湿度有较高要求,所以试验前需先将薄膜放在60 ℃的烘箱中进行干燥处理12 h,同时试验进行中保持环境湿度在35%以下。将样品制成适当圆形,放在样品架上扫描,扫描频率为4 cm-1,扫描次数16,范围为400~4000 cm-1,采集谱图[12]。
1.2.2.3 薄膜的扫描电子显微镜分析 试验前先将薄膜放入30 ℃烘箱里进行干燥处理12 h,避免水分对试验的影响。将样品剪切成细条状,使宽度尽可能窄;将样品固定在试验盘上,断裂面朝上,并进行喷金处理10 min,将处理好的试样固定在样品台上,调节加速电压为10 kV进行扫描电镜观察[13]。
1.2.2.4 薄膜抗拉强度的测定 将薄膜裁切成15 mm×20 mm的长条状,运用电脑测控抗张试验机,输入相应参数(设定夹距50 mm,速度500 mm/min,厚度为所测平均厚度),测试该薄膜的抗拉强度TS和断裂伸长率E,每个样品测定次数6次,取其平均值[14]。
抗拉强度计算公式:
TS(MPa)=F/S
式中:TS为抗拉强度,MPa;F为样品断裂时的最大张力,N;S为样品的横截面积,m2。
1.2.2.5 光学性能测试 采用透光率/雾度测试仪测量所制备的复合抗菌薄膜的透光率和雾度[15]。根据夹样器尺寸大小将所制备好的薄膜裁切成半径为2.5 cm的圆,然后把薄膜夹在两个磁性夹具之间并且将之尽量拉平,使光线正好能垂直于薄膜通过。每个样重复测量三次,取其平均值。
1.2.2.6 热封性能测试 将样品分别裁切成120 mm×10 mm的长条,每个样品5份。运用热封测试仪,测试复合抗菌薄膜的热封性。设置不同的温度,压力以及时间。最后通过观察封口处的热封质量情况来确定不同样品的最佳热封温度范围以及热封时间范围。
1.2.2.7 透氧性测试 采用压差法进行氧气透过率测试,测试标准为塑料薄膜和片材透气性测试方法[16],将测试薄膜利用裁切磨具裁切成直径为85 mm的圆形,测试平均厚度,放入测试腔中,测试温度为23 ℃,输入参数:高压腔吹洗30 s,低压腔脱气30 s,高低压腔脱气2 h,系统保压101.00 kPa。
1.2.2.8 水蒸气透过系数测试 选择较平展均匀没有气泡的薄膜,利用模具将薄膜裁切成与测试盘相对应大小的测试样,放入测试盘里进行测试。调节气罐压力0.25 MPa,Line pressure30左右,输入测试样平均厚度、样品面积,测试两侧相对湿度10%/50%、温度37.8 ℃,调节测试模式为continuous,进行测试[17]。水蒸汽透过率(WVTR)计算公式为:
WVTR=G/(t×A)
其中:G是重量(g)的变化,t为时间(h),A是测试面积(m2)。
计算WVP:WVP=WVTR×T/ΔP
其中:T是测试样品的厚度(mm),ΔP是横跨薄膜的水蒸汽气体分压差。计算并记录每个样品三个试样的水蒸气透过系数WVP。
1.2.2.9 水溶性分析 将薄膜切成35 mm×35 mm大小的方块,分别放入培养皿中并放入90 ℃干燥箱中干燥24 h后进行称重,此为初始重量m0,然后将试样放入25 ℃、100 mL的蒸馏水中放置24 h,之后取出并擦干(注意避免薄膜损坏),然后再将薄膜放入90 ℃干燥箱中烘干至恒重得mt,重复三次试验,取平均值[18-19]。
水溶性(%)=(m0-mt)/mt×100
1.3 数据分析与处理方法
采用SPSS 20.0软件对抗拉强度、伸长率、透光率、雾度、透气率、水蒸气透过系数、水溶性进行统计处理和方差分析,数值采用平均值±标准偏差形式,采用最小显著差数法(LSD)(p<0.05)进行显著性分析。利用Origin Pro 8进行图形绘制。
2 结果与分析
2.1 超高压处理对薄膜红外光谱的影响
图1为样品A~D4的红外光谱图。有-OH存在,在波数2500~3300 cm-1区域内会有一个较宽的吸收峰[14,20],通过分析图1可以看到对照组A和实验组薄膜在3271.644 cm-1附近都有明显的吸收峰,但是羟基的吸收峰有不同程度的移动,这说明不同的超高压压力和时间使蛋白质分子空间结构发生了变化,分子内或者分子间氢键发生了不同程度的解聚和重组。
由图1可以看出,超高压处理可以使2926 cm-1附近吸收峰迁移0~4 cm-1,根据刘燕燕等[21]研究结果表明,在光谱范围2980~2850 cm-1内的吸收峰,主要为蛋白质结构中CH2和CH3等基团的C-H伸缩振动,这说明超高压处理可使蛋白质分子的空间结构发生不用程度的展开或者断裂[22],图1b 200 MPa超高压处理下的薄膜在2926 cm-1附近的吸收峰迁移明显较其他处理条件下小。
在光谱范围2400~2100 cm-1内的吸收峰,主要为C≡C、C≡N、C≡C-C≡C伸缩振动,由图1a可知,未经过超高压处理和超高压处理200 MPa下的蛋白质分子,未看到此吸收峰,而超高压处理300~400 MPa后的蛋白质分子有明显的吸收峰,但是随着加压时间的影响,吸收峰有不同程度的迁移,且在400 MPa,处理时间超过10 min此吸收峰消失。这可能是因为在超高压处理前期,破坏氢键等非共价键,使部分蛋白质分子结构变化成亚基单位,侧链的极性集团暴露,但是随着压力的升高和加压时间的增加,蛋白质分子进一步展开和结构重组,改变了蛋白质原本空间结构。
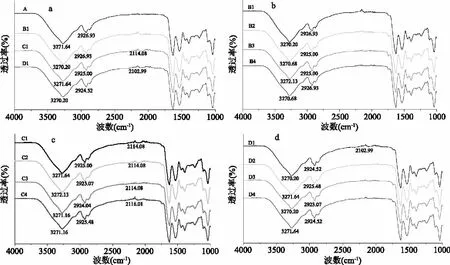
图1 超高压处理对薄膜FTIR光谱的影响Fig.1 Effect of different ultrahigh pressure processing on FTIR of films
2.2 超高压处理对薄膜微观结构的影响
通过实验可知,超高压处理压力对薄膜的微观结构影响明显大于加压时间,图2为超高压处理压力对薄膜扫描电镜的微观结构的影响。由图2可知,经过200~400 MPa超高压处理的薄膜断裂面较细腻,无气孔或气孔较小,薄膜的表面更加光滑均匀,看起来更加美观。而未经处理的抗菌薄膜,断裂面和表面均有颗粒感和孔洞,林素丽等[23]研究指出,超高压能使蛋白质胶粒直径急剧减小,使蛋白质结构展开,使侧链的亲水集团加强与水的作用,进而使蛋白质溶解度增大。由图可以看出超高压压力为300 MPa时,薄膜表面最细腻、光滑、美观,随着超高压压力从300 MPa进一步增加到400 MPa,此效果会有所下降。而未经过超高压处理的抗菌薄膜因为乳化作用小,颗粒分散不均匀,薄膜感官质量不理想。

图2 超高压处理对薄膜微观结构的影响Fig.2 Effect of different ultrahigh pressure processing on scanning electron microscopy(SEM)of films注:a~d分别为样品组A、B3、C3、D3。
2.3 超高压处理对薄膜机械性能和光学性能的影响
表2为不同超高压处理压力和时间对抗菌薄膜机械性能和光学性能的影响。王章存等[24]指出,超高压处理能够破坏蛋白质分子的非共价键,使二硫键发生断裂,巯基含量增加,使凝胶软而富有弹性,呈现半透明状。由表2可知,与对照组相比,除了实验组B4的抗拉强度差异不显著(p>0.05);实验组B3的断裂伸长率差异不显著(p>0.05),其余实验组的抗拉强度和断裂伸长率均有显著性(p<0.05)差异。未经过超高压处理的薄膜抗拉强度为1.62 MPa,伸长率为13.76%。当超高压处理300 MPa,20 min时蛋白薄膜的抗张强度最大,为4.86 MPa,比未经过处理的薄膜抗张强度增加了198%,效果非常明显;当超高压处理300 MPa,10 min时蛋白薄膜断裂伸长率最大,为23.25%,比未经过处理的薄膜断裂伸长率增加了68.9%。
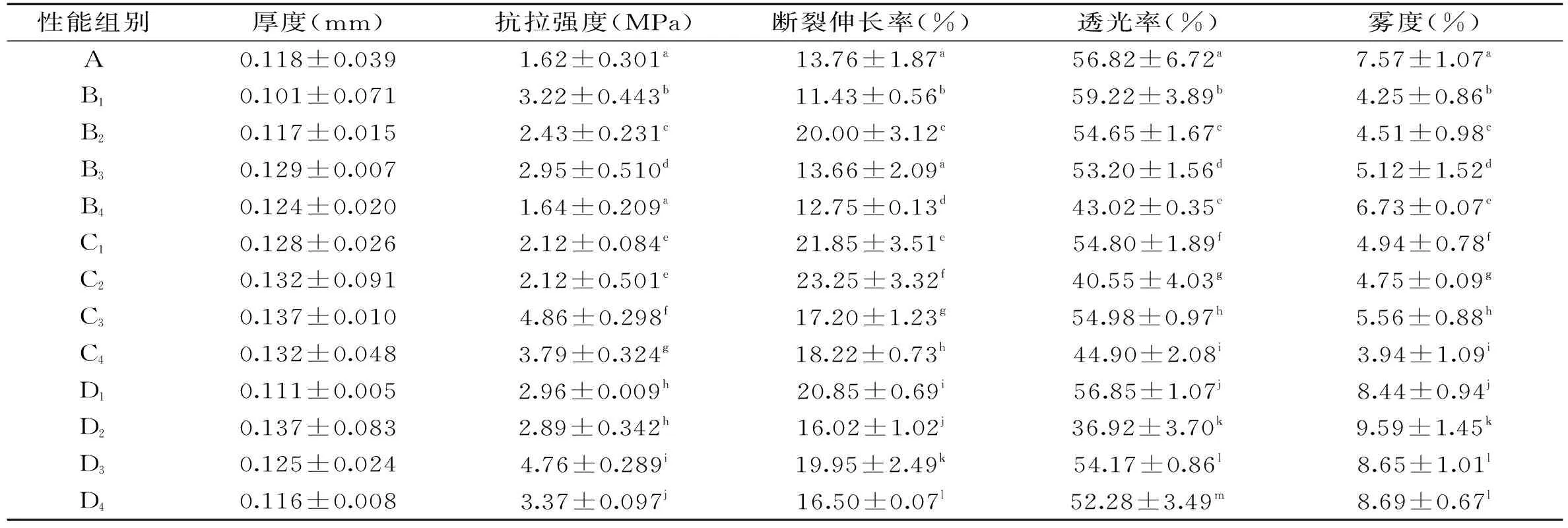
表2 超高压处理对薄膜机械性能和光学性能的影响Table 2 Effect of different ultrahigh pressure processing on mechanical and optical properties of films
由表2可知,超高压处理对薄膜的透光率和雾度均有显著性(p<0.05)影响。与对照组薄膜相比,组D2透光率变化最显著(p<0.05),为36.92%。与对照组薄膜相比,超高压压力为200~300 MPa时,雾度减小;压力为400 MPa时,雾度增大。组C4雾度变化最显著(p<0.05),为3.94%。这与普通薄膜材料的变化规律有较大不同。透光率和雾度是从不同的方面来表征材料的光学性能,一般材料透光率和雾度呈相反方向变化。经过超高压处理的薄膜透光性的降低可能与蛋白质分子的展开和颗粒的分离,而使材料内部的相界面上呈现非均匀的状态而导致光线发生反射和折射有关。雾度用来表征材料内部或者表面由于光散射而造成的浑浊或者清晰的外观。雾度的减小与蛋白子分子结构的展开和聚合也有密切关系。
2.4 超高压处理对薄膜热封性能的影响
热封温度为薄膜加热过程中在固相与液相之间的一个温度区域,如表3,超高压处理对薄膜的热封性能有一定的影响,且超高压处理压力越高,时间越长,热封温度越高。热封温度变化范围为115~146 ℃。
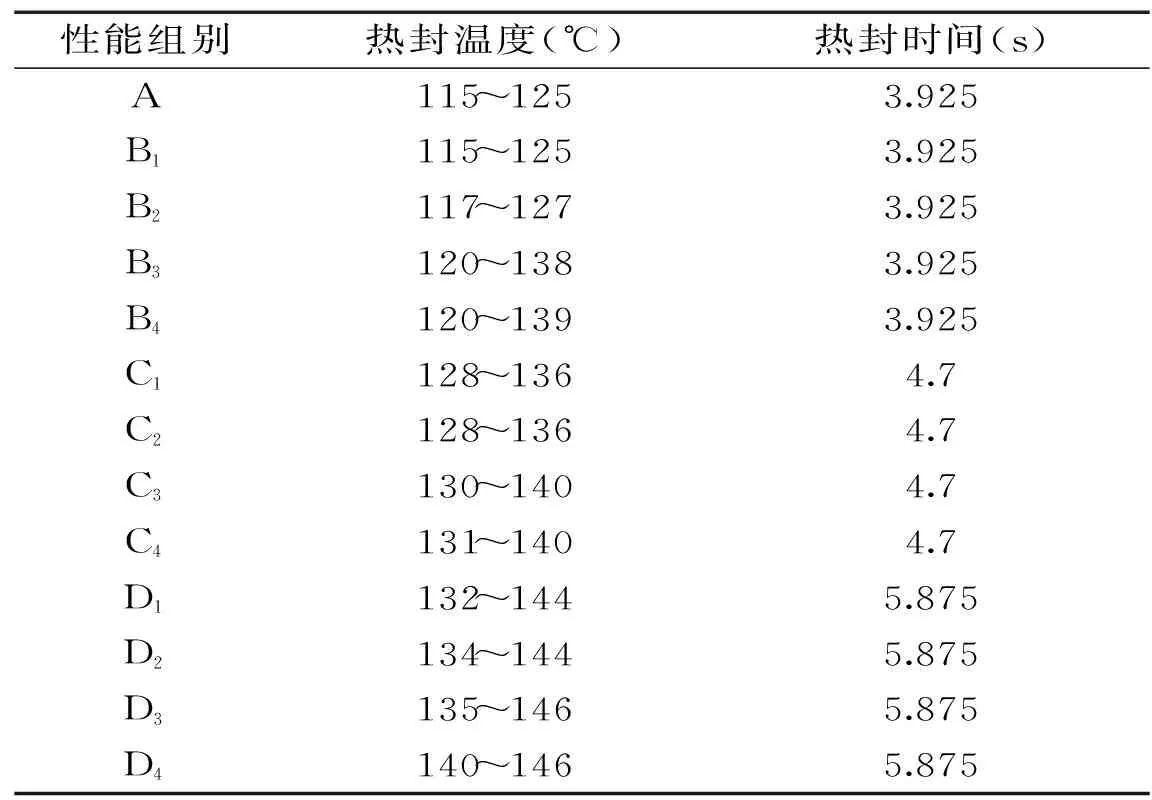
表3 超高压处理对薄膜热封性能的影响Table 3 Effect of different ultrahigh pressure processing on heat sealing performance of films
2.5 超高压处理对薄膜透氧性能的影响
由图3可知,与对照组A相比,实验组的渗透系数均有显著性(p<0.05)差异。对照组未经过超高压处理的蛋白薄膜氧气渗透系数高达104.47×10-9cm3·cm/cm2·s·cmHg,而实验组B1~D4的氧气透过量保持在7.85×10-9cm3·cm/cm2·s·cmHg以下,最大值为组C3;最小组为B2,0.93×10-9cm3·cm/cm2·s·cmHg。经过超高压处理的薄膜阻气性能有较大提升,可能是因为随着薄膜的致密性提高和孔洞的减少,更能有效阻隔氧气。
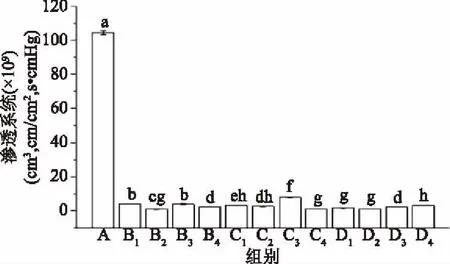
图3 超高压处理对薄膜透氧性能的影响Fig.3 Effect of different ultrahigh pressure processing on gas permeability of films
2.6 超高压处理对薄膜水蒸气透过系数的影响
如图4所示,对照组透湿系数达到最大值3.285×10-9g·cm/cm2·s·Pa,同时经过超高压处理的薄膜其透湿系数差异显著(p<0.05)。B组和C组样品,随着加压时间的增强其透湿系数逐渐降低,可能是因为超高压时间越长非极性集团暴露越多,水化作用减弱,水分渗透性减弱,使抗菌薄膜的阻湿性能增强,透湿系数减小。最低的透湿系数值出现在C4组,为1.177×10-9g·cm/cm2·s·Pa。对于D组,透湿系数随加压时间的增长而增加,可能是蛋白质分子间的结构重组而产生了不同的作用力,增加了蛋白质的水溶性。
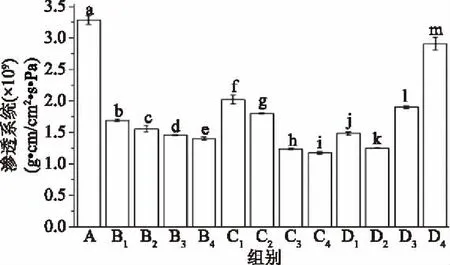
图4 超高压处理对薄膜水蒸气透过系数的影响Fig.4 Effect of different ultrahigh pressure processing on water vapor permeability of films
2.7 超高压处理对薄膜水溶性的影响
由图5可知,对照组抗菌薄膜的水溶性为21.89%,经过超高压处理的抗菌薄膜组B2、B4、C4与对照组相比均不具有显著性(p>0.05)差异。水溶性数值最低值出现在C1组,为14.51%,减少比率为33.7%,超高压能够使蛋白质分子内部的巯基和疏水性基团暴露[25],使分子间相互作用力增强,形成致密的网状结构,使薄膜的水溶性降低。最高值出现在D1组,为29.47%,增加比率为36.14%。对于相同超高压处理压力,水溶性的变化趋势随加压时间的改变而改变。由于超高压对蛋白质的解聚和重组情况较复杂,亲水和疏水性不断变化,所以水溶性程不同趋势变化。
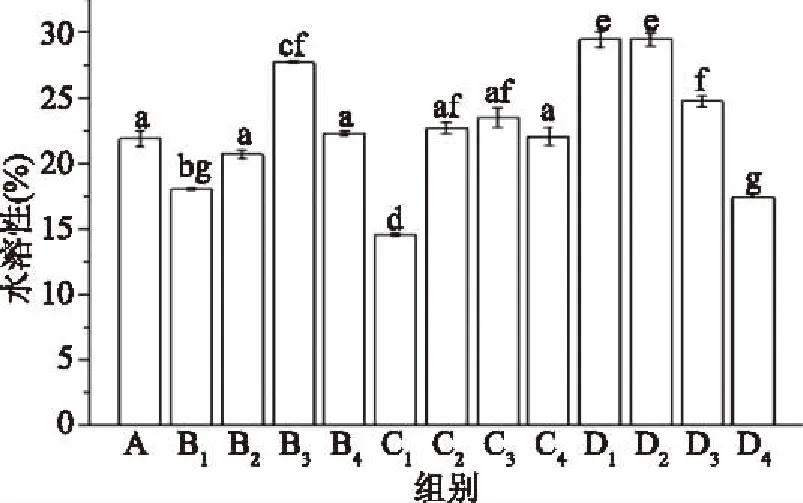
图5 超高压处理对薄膜水溶性的影响Fig.5 Effect of different ultrahigh pressure processing on water solubility of films
3 结论
静态超高压处理对于抗菌复合蛋白薄膜的机械性能、光学性能、透湿透氧性能等均有不同程度的影响。经过超高压处理的抗菌薄膜机械性能得以增强,但是透明度却有所减弱。经过超高压处理的薄膜表面更光滑和均匀,有较少的孔洞,但是当超高压压力从300 MPa进一步增加到400 MPa时,此效果会减弱。超高压处理可以降低薄膜的氧气渗透系数和水蒸气透过率,且与对照组相比具有显著性(p<0.05)差异。但是由于蛋白质本身的亲水性能,超高压对蛋白薄膜的水溶性没有较大影响。
超高压处理能够使蛋白质分子空间结构发生变化,使蛋白质分子内或者分子间氢键发生了不同程度的解聚和重组,从而改变薄膜的机械和包装性能。同时不同超高压压力和时间下的抗菌复合薄膜机械和包装性能呈现不同趋势变化,可适应不同食品的货架期要求。
