SNI大鼠模型诱发的早期病理性疼痛相关基因芯片数据的生物信息学分析
2018-12-06解琪琪李文洲史卫东邓亚军任恩惠马靖琳康学文
解琪琪,李文洲,史卫东,邓亚军,任恩惠,马靖琳,康学文,汪 静,*
(1.兰州大学第二医院骨科,中国甘肃兰州730030;2.兰州大学,中国甘肃兰州730000;3.甘肃省骨关节疾病研究重点实验室,中国甘肃兰州730030)
2011年,国际疼痛研究协会(International Association for the Study of Pain,IASP)将神经病理性疼痛(neuropathic pain,NP)最新定义为:“由躯体感觉神经系统的损伤或疾病而直接l成的疼痛”[1,2]。长期疼痛不但会影响患者的睡眠、工作和生活能力,还会增加抑Ⅳ、焦虑等情感障碍的发病率[3]。慢性神经病理痛持续时间长,临床治疗效果欠佳。进一步阐明NP的发病机制是当前疼痛研究领域的一个难题[4,5]。坐骨神经分支选择性结扎(spared nerve injury,SNI)是相对新型的NP模型,可用于急性长期实验(>14 d)的机制探讨[6],之前大部分的研究集中在神经病理性疼痛的维持机制研究,而对于其早期(<7 d)病理性改变的分子机制研究甚少。生物信息学是近年来生命科学领域的新兴学科,可为疾病的形成提供可能的分子机制依据,为实验研究提供可行的思路[7]。本文通过生物信息学相关方法对Costigan等[8]构建的大鼠疼痛模型表达谱芯片数据进行重新分析,以探讨SNI诱发的早期神经病理性疼痛的基因表达和生物代谢过程的改变,为神经病理性疼痛分子机制的进一步研究提供生物信息学依据。
1 材料与方法
1.1 材料
生物信息学分析数据集GSE30691[8]来源于NCBI的GEO(Gene Expression Omnibus)数据库,基于GPL85平台[RG_U34A]Affymetrix Rat Genome U34 Array,表达数据为expression profiling by array,种属Rattus norvegicus。该芯片数据包括56只Wistar大鼠,分为坐骨神经损伤组、脊神经结扎组、坐骨神经慢性压榨损伤组、假手术组、正常对照组,各组分别于l模后3 d、7 d、21 d以及40 h取L4和L5背根神经节以提取总RNA进行基因芯片分析。本研究通过生物信息学分析其坐骨神经损伤SNI术后3 d及正常对照组(N组)背根神经节标本的基因芯片数据。
1.2 数据处理及差异表达基因的筛选
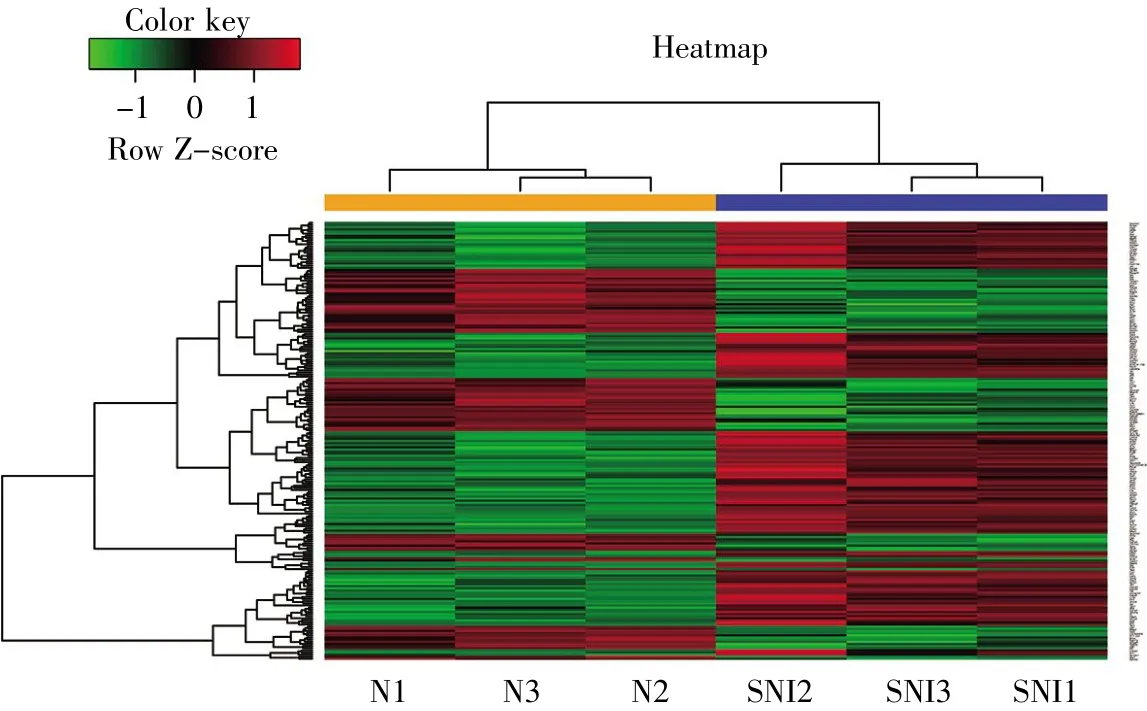
通过R语言软件包分析将原始的CEL文件通过RMA算法进行背景校正、bootstrap校正、质量控制和标准化处理,并转化为探针表达矩阵,然后根据GLP85平台文件将探针名转化为基因名;通过R语言软件包筛选出差异表达基因,差异表达基因同时满足|log2fold change(log2FC)|>0.6且P<0.05。利用pheatmap工具包绘制热图,直观地展示每个差异基因在每个样本中的表达情况。
1.3 差异表达基因的基因本体论和通路富集分析
基因本体论(Gene Ontology,GO)是用来注释基因及其产物的常用方法,有利于集中研究感兴趣的方向,发现新的现象。我们利用DAVID(Database for Annotation,Visualization and Integrated Discovery)在线工具(http://david.abcc.ncifcrf.gov/)对差异表达基因进行GO和KEGG通路富集分析[9,10]。P<0.05和FDR<0.05设定为显著性基因富集的临界值。
1.4 共表达分析
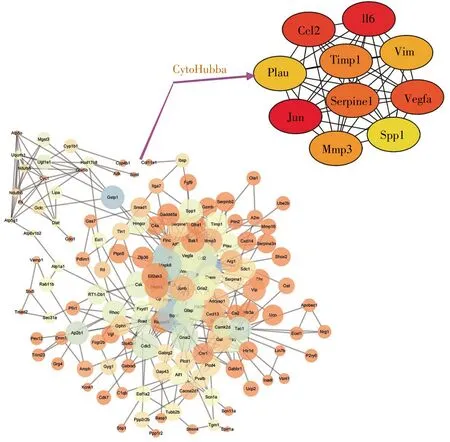
将所得136个差异基因导入STRING(Version:10.5)在线软件(https://string-db.org/),得出各节点间的互作关系(参数为STRING数据库默认)。然后以TSV格式导出,将所得源文件导入Cytoscape软件,用插件cytoHubba进行关键基因(Hub基因)分析,选用MCC算法,选取得分前10为所得Hub基因。
2 结果
2.1 数据处理和差异基因筛选
通过对两组差异表达基因数据进行标准化及处理,R软件共筛选出136个差异表达基因(SNI组/正常对照组),其中包括98个上调基因和38个下调基因。差异基因表达的热图如图1所示,可见两组样本基因表达具有显著差异,上调基因主要包括GFAP、IL-6、CCL-2、JUN、CACNA2D1、PTPN5、HSPB1、GADD45A等,下调基因有KCNS3、KCNC2、GABRG2、KCNS1、SCN1A、GRIA2、SCN11A、KCNK1、VEGFA、PIK3R1等。
2.2 GO和KEGG通路富集分析
GO可分为生物过程(biological process,BP)、细胞组成(cellular component,CC)和分子功能(molecular function,MF)。采用DAVID 6.8分别对136个差异基因、98个上调基因以及38个下调基因进行GO富集分析,结果如图2~4所示。差异基因主要涉及伤害刺激反应、炎症应答、防御反应等生物过程,介导门控性通道的活动以及激素活力等分子功能,富集于胞外区;上调基因主要涉及的生物过程跟差异基因基本一致,也富集于胞外区,介导的分子功能有激素活力、内肽酶抑制剂的活性以及细胞因子的活性等;下调基因r主要涉及细胞信号转导、神经冲动的传导、突触传递以及离子运输等生物学过程,富集于各种离子通道上,介导的分子功能也是各种离子通道的活动。KEGG通路富集分析结果显示:差异基因主要涉及细胞外机制受体交互通路、FAK信号通路、ErbB信号通路和MAPK等经典信号通路,上调基因主要涉及MAPK信号通路、补体途径信号通路、叶酸合成等信号通路,下调基因r主要涉及肾细胞癌及相关癌症通路。
2.3 差异表达基因所编码蛋白质间的相互作用网络分析
STRING是一个由已知和预测的蛋白质相互作用数据组成的数据库,本研究将136个显著差异基因输入STRING工具,然后将所得数据导入Cytoscape中,利用插件cytoHubba找出JUN、IL-6、CCL2、VEGFA、SERPINE1、TIMP1、MMP3、VIM、PLAU、SPP1为所得Hub基因(图5)。
3 讨论
近年来,关于SNI样本的基因组学、转录组学和蛋白质组学研究逐渐成为分子机制研究的热点[11~13]。以往大量文献及本课题组前期工作已经证实SNI大鼠l模后1~7 d痛阈下降最显著,7 d后趋于平稳且维持时间较长[14,15]。目前,涉及此模型的研究大多集中于维持期的机制探讨,而对于其急性期痛阈下降明显的机制研究较少[6,14],故本研究选取SNI大鼠l模后第3天的芯片数据重新进行分析,即利用生物信息学方法比较SNI组和正常组3 d时L4、L5背根神经节样本的差异基因表达。结果显示,共筛选出136个DEGs,其中包括98个上调基因和38个下调基因。
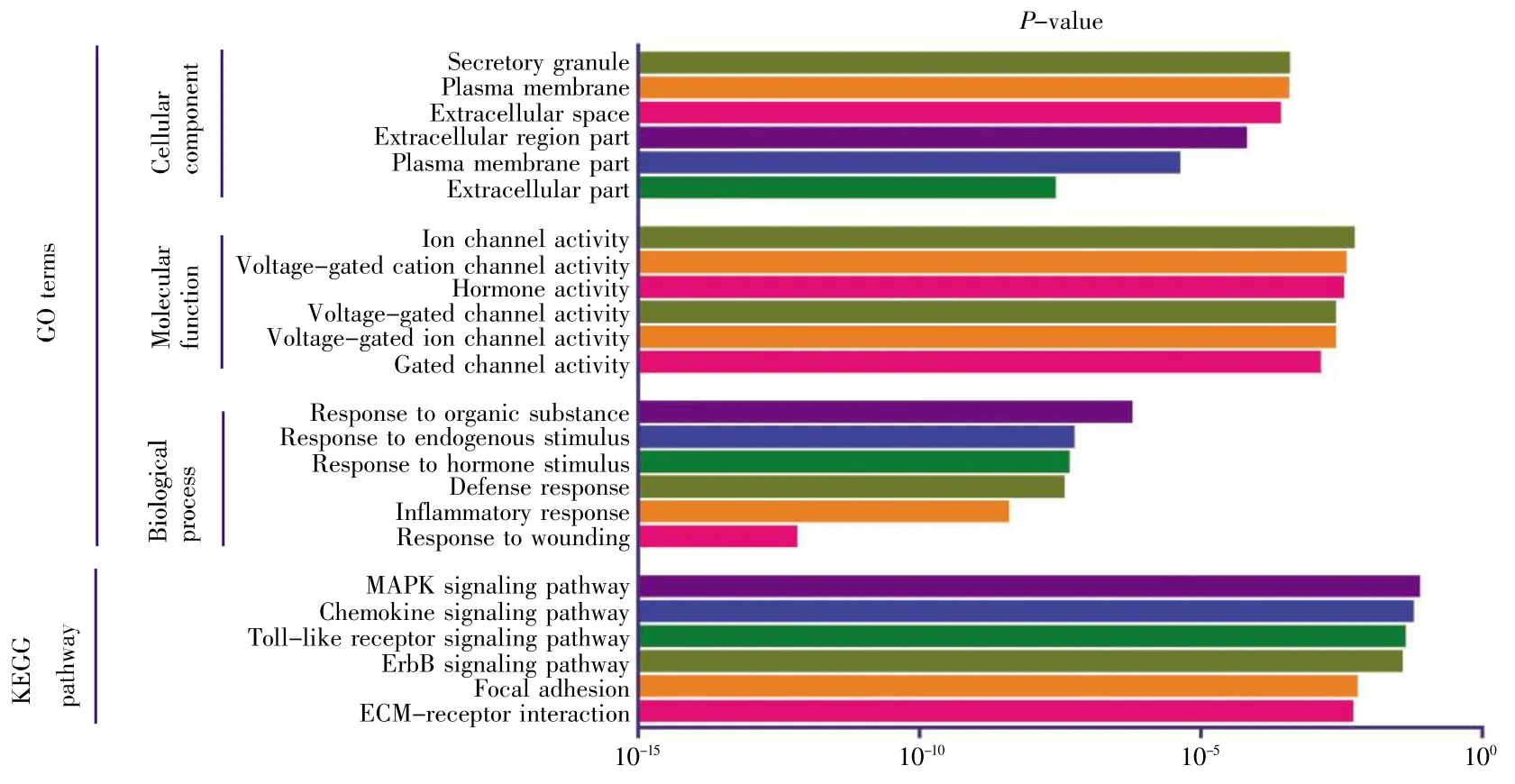
图2 差异基因GO分析及通路富集分析Fig.2 GO and pathway enrichment analyses of differential genes
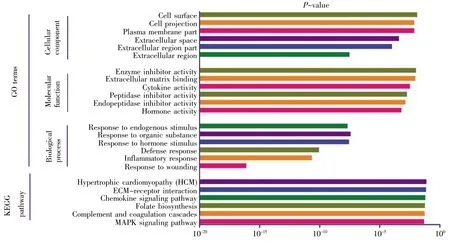
图3 上调基因GO分析及通路富集分析Fig.3 GO and enrichment analyses of pathways for up-regulated genes
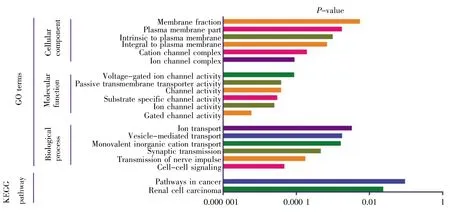
图4 下调基因GO分析及通路富集分析Fig.4 GO and enrichment analyses of pathways for down-regulated genes
上调基因GFAP、IL-6、CCL-2、CACNA2D1、JUN、PTPN5、HSPB1、GADD45A等主要富集在细胞外基质。功能富集分析显示,SNI相关基因与细胞外基质受体交互通路有关。之前的研究曾指出,此信号通路在SNI的进展中起着重要作用[16,17]。因此,细胞外基质成分和结构的改变可使神经元的正常生理活动发生变化,从而导致神经病理性疼痛的发生和进展。HSPB1在SNI的研究中有见报道[12],但是,对于其导致SNI发生的具体分子机制有待进一步研究。下调基因VEGFA、FH1、PIK3R1、KCNS3、KCNC2、GABRG2、KCNS1、SCN1A、GRIA2、SCN11A、KCNK1等主要富集在离子通道活性的生物学功能中。已有研究报道,离子通道活性的改变与SNI发生和发展互为因果[18~20]。此外,KEGG通路富集分析显示,MAPK信号通路在SNI中起着一定作用。MAPK包括ERK、p38、JNK和ERK5共4个亚族,4个亚族在SNI的发病中均有一定作用[21~24]。大量研究表明,MAPK在脊髓损伤后的胶质细胞(小胶质细胞和星型胶质细胞)中激活,阻断该通路能够抑制减弱不同动物模型中的炎症和神经性疼痛[25,26]。因此,MAPK有望成为潜在的药物治疗靶点。利用cytoHubba分析得到的10个Hub基因JUN、IL-6、CCL-2、VEGFA、SERPINE1、TIMP1、MMP3、VIM、PLAU、SPP1 中,JUN、IL-6、CCL-2、VIM在病理性疼痛中作用研究较为深入,机制相对较为明确[27~30]。MMP3是基质金属蛋白酶家族的成员之一,在炎症性疾病中扮演着重要的角色[31],而炎症与病理性疼痛的关系又密切相关[18],因此有关其在神经病理性疼痛的机制值得深入探究。VEGFA,又名血管内皮生长因子,诱导血管内皮细胞的增殖和迁移,对于生理和病理的血管新生发挥着必不可少的作用[32]。近年来,关于VEGFA的研究主要集中于肿瘤的发生发展,而在神经病理性疼痛中研究甚少,值得进行深入探索。SERPINE1编码的蛋白质属于丝氨酸蛋白酶抑制剂的一员,抑制组织纤溶酶原激活物和尿激酶的生成[33],这与PLUA的作用相反[34],值得注意的是两者在神经病理性疼痛中的研究均较少。SPP1编码的蛋白质主要参与破骨细胞的矿化及细胞因子释放[35],而后者与病理性疼痛的关系密切,最新研究表明其与巨噬细胞的功能发挥和骨骼肌的血管生成密切相关[36],以上均提示SPP1可能参与了病理性疼痛的发生发展。
综上所述,细胞外基质和离子通路活性的改变对SNI发生发展起着关键作用。我们预测VEGFA、SERPINE1、TIMP1、PLAU、SPP1 可能在病理性疼痛中发挥着重要的作用;同时,细胞外基质受体交互通路和MAPK信号通路与SNI密切相关,值得进一步深入研究。
