夯实基础 深度挖掘 提升能力——浅析核心素养观念下对中和滴定实验教学的研究
2018-12-06山东刘树领
山东 刘树领 王 学
近年来随着滴定实验及滴定图象试题的大量出现,使得对中和滴定实验的深度教学研究成为必然。以中和滴定实验基础知识为基点,研究滴定曲线及pH突跃范围,对理解指示剂选择、用量、终点反应序列关系以及构建实验设计及定量分析的思维模式具有重要作用,同时在突出教材权威性前提下,对教材知识的灵活处理及深度挖掘提供了极好的案例,也对学生理解“宏观辨识与微观探析”“证据推理与模型认知”“科学探究与创新意识”等学科核心素养以及数形结合、宏微结合、变化与守恒等学科思想具有更深刻的引领与指导作用。
酸碱中和滴定实验出现在《化学反应原理》教材中,是高中化学最重要的定量实验,也是在实际生产、生活中应用较广的一个实验,三个版本(人教、鲁科、苏教)教材中均将其置于实用的背景之下,以突出化学的学科核心素养。目前出现的关于滴定实验及电解质溶液的考题大多源自于酸碱中和滴定的实验素材,因此加强中和滴定实验的深度教学研究对于提高学生化学学科素养及应试能力具有重要的意义。
一、重视演示,夯实中和滴定实验的基础性知识教学
通过对中和反应概念的复习,提出了中和反应在实际生产、生活中具有重要的应用,依此在渗透化学应用及社会责任等核心素养知识的同时引出中和滴定实验主题,即通过利用已知浓度的酸(或碱)溶液测定出未知浓度的碱(或酸)溶液。笔者以0.10 mol/L的标准盐酸溶液测定未知浓度(约为0.10 mol/L)的NaOH溶液为例,探讨酸碱中和滴定实验的基础性教学。
1.提出问题,激发学生思维
为了提高学生的思维能力及实验设计能力,针对滴定实验可提出系列问题:(1)标准NaOH溶液与待测盐酸溶液反应有何明显现象?如何判断二者恰好完全反应?(2)依据何种原理计算出待测盐酸的浓度?(3)如何进行误差分析(或实验评价)?(4)应从哪些角度思考来提高待测盐酸浓度的精确度?通过对诸如此类问题的引入使学生在问题链中不断思考,从而将滴定实验的相关知识有机连接在一起,并建立起逻辑关系。由问题(1)能引出加入酸碱指示剂(酚酞、甲基橙试液),通过问题(2)(3)来引导出依据反应方程式找出计算关系式及误差分析的依据,通过问题(4)能使学生联想到仪器的精确度、标准液浓度的精确度、操作规范、反应终点的判断等,进而来引出滴定管等仪器介绍的相关知识。
2.简介仪器,演示实验过程
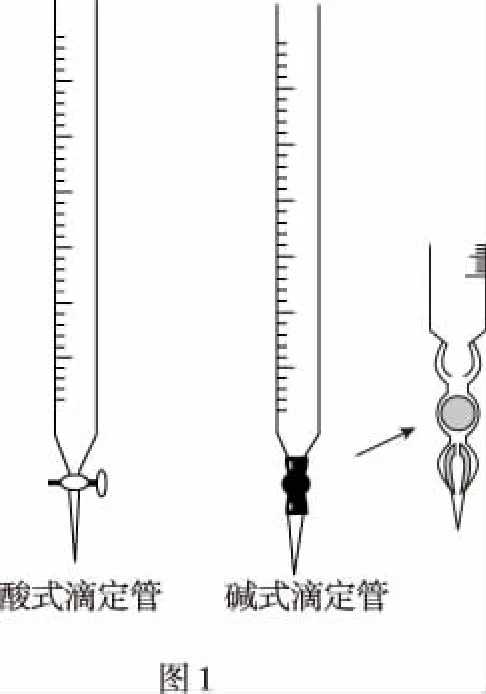
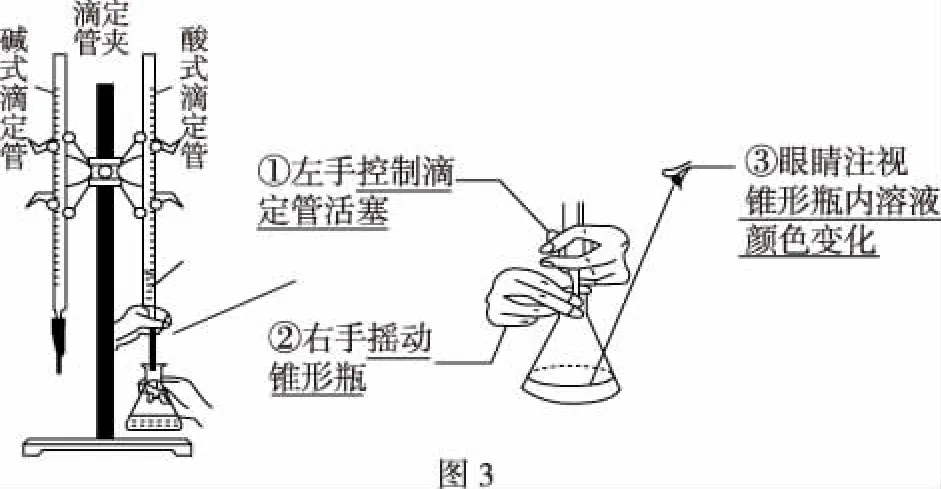
滴定实验最主要的仪器就是滴定管,因此实验前应对滴定管的类型与结构、使用及读数等通过实物向学生展示,让学生观看其结构特点及异同点,并通过多媒体图片(如图1、图2)进一步强调其0刻度位置、使用、排空、读数等规范操作知识点。通过真实实验来展现实验的过程,并通过多媒体图片(如图3)强调实验滴定时操作的关键点,以强化学生的规范操作能力及意识。也可在适当机会让学生走进实验室,进行自我设计、操作滴定实验以提高学生的实验兴趣及动手实验能力。

3.归纳反思,构建知识脉络

二、中和滴定实验的深度探究
酸碱中和滴定实验不应仅停留在宏观演示上,也不应仅仅停留在物质性质验证上,而应从粒子结构、性质及隐含的反应序列等角度给予分析与挖掘,以充分体现化学核心素养观念及微粒观、变化观、构性观、平衡观、守恒观等学科思想。
1.对滴定曲线的探究
滴定曲线是理解反应实质的关键,是体现宏微结合、定性与定量结合、数形结合思想的重要载体,因而对于滴定曲线的探究应予以重视。
(1)利用手持技术绘制pH曲线
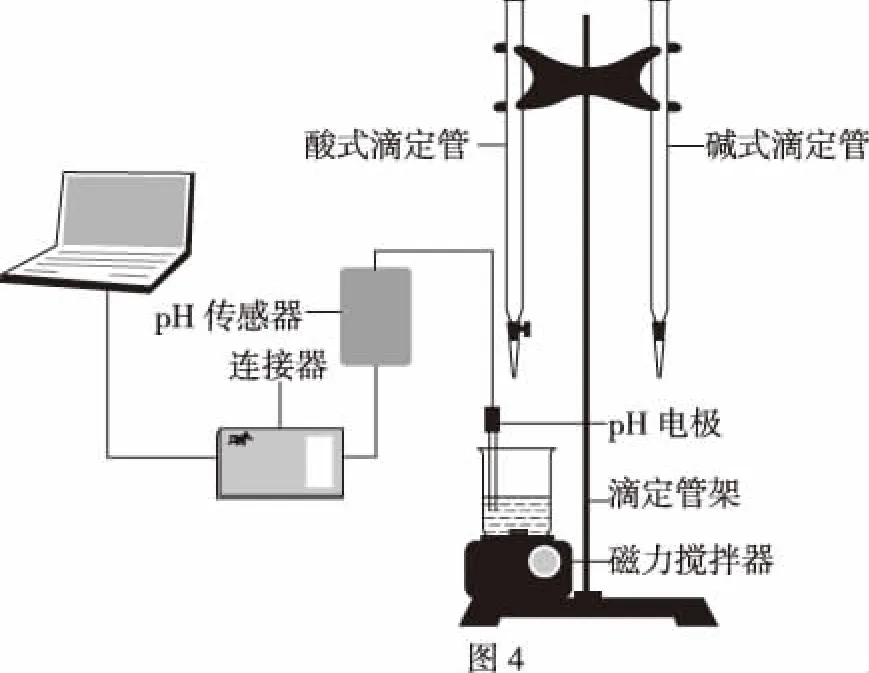
取20.00 mL的待测NaOH溶液置于磁力搅拌器上面的小烧杯中,然后再滴加2滴酚酞试液,把pH电极插入到溶液的中间位置,并与pH传感器、适配器及电脑连接起来,如图4所示。打开磁力搅拌器搅拌并开始滴加0.10 mol/L盐酸溶液,用pH传感器测量溶液pH的变化,通过专用软件可以很直观地绘制出盐酸溶液滴入氢氧化钠溶液的滴定曲线(图5)。同时为了增加对比度,按照同样方法绘制了0.10 mol/L醋酸溶液滴入氢氧化钠溶液的滴定曲线(图6),并通过平移图5、图6中的曲线得到图7。

(2)pH曲线特点分析
在学生惊奇地看到滴定曲线变化时,很自然地观察到pH突跃的客观存在。说明pH出现突跃现象是在滴定终点前后多加或少加1滴滴定液所致的原因后,引导学生分析观察图7。①pH突跃范围不同:强酸与强碱互相滴定时pH突跃范围比较大;弱酸与强碱或强酸与弱碱互相滴定时都会出现pH突跃范围较小,故推知弱酸与弱碱相互滴定时pH突跃范围更小。②pH突跃中点位置不同,即等当点(化学计量点)不同:强酸强碱相互滴定时等当点pH为7;弱酸与强碱相互滴定时因盐水解导致等当点pH大于7;强酸与弱碱相互滴定时因盐水解导致等当点pH小于7。③曲线起点相同但终点不同:强酸终点低弱酸终点高,进而推知同种碱滴定不同种等浓度酸时曲线起点不同,即强酸起点低、弱酸起点高。针对③还可以提出若把氢氧化钠溶液滴入等浓度、等体积的盐酸溶液、醋酸溶液时,其pH曲线的起点又是如何呢?这样通过具体分析,可使学生对酸碱中和滴定的现象与事实产生深刻理解。
(3)pH突跃的定量分析
为进一步增强学生数形结合思想、模型构建能力及计算能力,深刻理解“宏观辨识与微观探析”“变化观念与平衡思想”等学科素养内容。在假设NaOH溶液浓度为 0.10 mol/L 时,可设计如下几个问题,由学生分组、合作完成。
问题1:0.10 mol/L盐酸溶液滴定20.00 mL 0.10 mol/L NaOH溶液时,请计算盐酸体积分别为19.95 mL(即少滴1滴)、20.00 mL、20.05 mL(即多滴1滴)时,混合溶液的pH分别为多少?
问题2:0.10 mol/L醋酸溶液(Ka=1.8×10-5)滴定20.00 mL 0.10 mol/L NaOH溶液时,请计算醋酸溶液体积分别为19.95 mL(即少滴1滴)、20.00 mL、20.05mL(即多滴1滴)时,混合溶液的pH分别为多少?


通过实际运算,使学生在本质上更能深度理解pH突跃存在的原因,理解完全中和(即等当点pH)与溶液恰好呈中性是两个不同的概念,以及溶液中存在的粒子种类及浓度大小关系,进而逐渐养成运用实验手段及相关数据来构建思维模型的能力,通过数形结合、定量与定性结合策略来分析、解决相关化学问题。
2.对指示剂选择、用量及反应先后的探究
在酸碱中和滴定实验中,指示剂的选择、作用及用量是重要的学习内容,但学生往往对于指示剂选择的依据及用量问题理解不清楚,尤其是对隐含的指示剂变色反应序列问题常常忽视,因而需要教师的指导与解惑。
(1)指示剂选择的探究
消费者团体也对如何标记基因编辑食品提出了警告。虽然美国国会通过了一项法律,要求食品制造商自2016年起需要明确标识食品的转基因成分,但是这些规定可能不适用于通过基因编辑技术新近上市的食品。
中学阶段,常见的酸碱指示剂有甲基橙、酚酞、石蕊等试液,其变色范围如下:
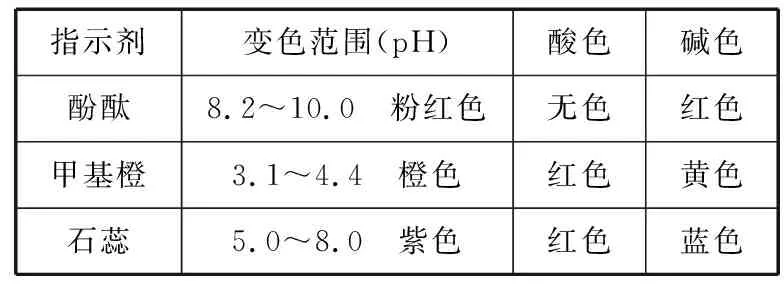
指示剂变色范围(pH)酸色碱色酚酞8.2~10.0 粉红色无色红色甲基橙3.1~4.4 橙色红色黄色石蕊5.0~8.0 紫色红色蓝色
通过对三种指示剂的变色范围的了解,使学生领悟盐酸滴定氢氧化钠溶液时为何选择酚酞或甲基橙的原因,即指示剂的选择必须使其变色范围处于pH突跃范围内(或与pH突跃范围部分重合),再附以人眼对紫、红、蓝色之间变化较难分辨的说明,就易使学生形成中和滴定实验选择指示剂的思维模式,即强酸与强碱互滴时选用甲基橙或酚酞试液均可;弱酸与强碱互滴时选用酚酞试液;强酸与弱碱互滴时选用甲基橙。
(2)指示剂的用量及反应先后探究
酸碱指示剂从类别上来讲属于有机弱酸或有机弱碱,如酚酞为有机弱酸,甲基橙为有机弱碱,通过了解酸碱指示剂,使学生自然想到指示剂添加过多必然会消耗一定量待测溶液或标准溶液,太少会因颜色变化不明显而影响终点判断问题,由此彻底理解了酸碱指示剂用量一般为 2~3 滴的原因。针对终点判断问题,提出一个容易被忽略而又涉及反应优先进行问题,即指示剂在终点时的变色与主要反应相比谁优先进行来激发学生的深度思考,即终点变色反应后期进行才能体现出其用于终点判断的功能。
三、典题例析,深度感悟中和滴定实验的基础性与应用性
中和滴定实验是各种滴定实验的基础,其他滴定实验则是对中和滴定实验的延伸与深化,因此通过适当典题训练对于深度理解酸碱中和滴定实验的基础作用具有重要的意义。
1.以滴定曲线为载体,强化滴定过程及终点判断方法
滴定曲线不但能较好地体现滴定反应过程,而且还体现出变化观、微粒观、平衡观等学科观念及宏微结合、数形结合、证据推理等学科素养内涵。
【例1】室温下,将1.00 0 mol·L-1盐酸滴入20.00 mL 1.00 0 mol·L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图8所示。下列有关说法正确的是
( )

A.a点由水电离出的c(H+)=1.0×10-14mol/L


D.d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热
【答案】C
【评析】形式上是双曲线图象题,但其考查的实质仍是对中和滴定过程中粒子浓度变化及终点判断问题,凸显了“宏观辨识与微观探析”“变化观念与平衡思想”“证据推理与模型认知”等学科素养。氨水与盐酸反应属于放热反应,因而在反应过程中必然伴随着温度变化,所以温度变化曲线上的最高点d点就表示了氨水与盐酸恰好完全中和反应生成氯化铵溶液,d点之后是盐酸过量导致溶液质量增加而出现温度降低现象。通过此题进一步使学生理解滴定实验的终点判断是依据明显的实验现象变化,除使用酸碱指示剂之外,还有诸如电导、温度(本题)等极点变化来判断终点方法。
2.以考查指示剂选择为背景,强化反应序列问题
酸碱指示剂的选择基本上凭经验即可解答,但在氧化还原滴定、配位滴定、沉淀滴定实验中指示剂的选择则需要理解多个反应之间存在序列规律才能准确解答。
【例2】莫尔法是一种沉淀滴定法。以K2CrO4为指示剂,用标准硝酸银溶液滴定待测液,进而测定溶液中Cl-的浓度。已知:

物质AgClAgBrAgCNAg2CrO4AgSCN颜色白浅黄白砖红白溶解度(mol·L-1)1.34×10-67.1×10-71.1×10-86.5×10-51.0×10-6
(1)滴定终点的现象是滴定最后一滴标准溶液,生成砖红色沉淀。

A.NaCl B.BaBr2C.Na2CrO4
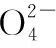
四、结语

