“盖斯定律”型反应热快速解题的思维认知模型
2018-12-06湖南周伟华
湖南 周伟华
一、问题的提出
反应热的计算是高考的重点及热点, 属于必考知识点,笔者对2016~2018年的高考化学试题中反应热的计算进行了统计与梳理,其中“盖斯定律”型反应热的求解最为常见。(见表格1)
2018年高考真题中有关反应热的计算除天津卷外其他为“盖斯定律”型,本文对此题型的题型特征、解题策略等进行归纳总结,以相应的高考真题进行分析,提供解题思路和解题示范,形成模型认知素养,帮助师生快速、准确解决“盖斯定律”型反应热的求解。
说明:海南卷-T4,即海南省高考化学第4题;全国卷Ⅰ-T28(2),即全国卷Ⅰ高考化学第28题第(2)小问,以此类推。
二、“盖斯定律”型反应热的思维认知模型
1.题型特征
2018年高考真题中有关反应热的计算除天津卷外其他为“盖斯定律”型计算,即由多个已知热化学方程式, 求目标热化学方程式的反应热ΔH或写出目标热化学方程式。
此类题型比较成熟,特征、分值及出现在试卷中的位置较为固定。
2.解题思路
首先观察目标方程式的反应物和生成物,利用已知方程式的加法或减法消去目标方程式没有出现的中间产物,得到总反应方程式。然后,将两个方程式进行代数运算得到新的反应方程式,注意焓变也随之变化。最后,根据消元的路径代入数据求出目标反应方程式焓变。(见表格2)
3.计算依据
盖斯定律:不管化学反应分一步完成或几步完成,最终的反应热相同。化学反应的反应热只与反应体系的始态和终态有关,与反应途径无关。
(1)反应热(焓变)的运算规则:
当热化学方程式同时乘(除)以某一个数时, 反应热的数值也必须乘(除)以该数; 热化学方程式相加减时, 同种物质之间可相加减,反应热也随之相加减; 将一个化学方程式调整方向时,反应热与正反应的反应热数值相等, 符号相反。
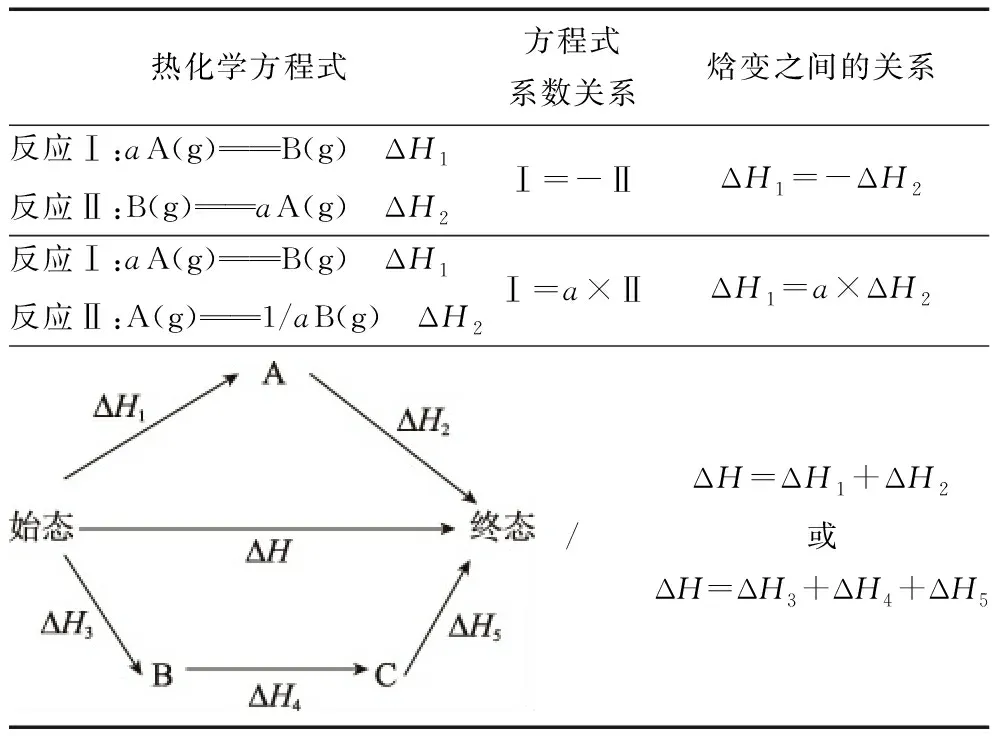
表格2 “盖斯定律”型反应热(焓变)的运算规则
(2) 解题关键:学生最大的难点是如何由多个已知方程式快速推导出目标方程式, 即确定多个已知方程式和目标方程式的关系。
(3)解题步骤:
观察反应物、生成物在已知式中的位置, 根据目标方程式中各物质计量数和位置的需要, 对已知方程式进行处理, 如调整计量数或调整反应方向。
突破学生最大的难点,具体而言可以分以下步骤:
①若目标热化学反应方程式中某物质只与一个已知热化学方程式共有,则选择此物质为参照物,以此参照物在目标热化学反应方程式中的位置及计量数确定已知热化学方程式的计量数、ΔH的改变量。若目标热化学反应方程式中某物质在多个已知的热化学方程式中出现,则在计算确定ΔH时,该物质暂时不考虑作为参照物。
②将参照物在已知热化学反应中的计量数调整为与目标热化学反应方程式中相同。
③已知热化学反应方程式的某个或某几个物质与目标热化学反应方程式中的共有物质在同一边(同为反应物或生成物),直接相加;反之,相减。
④经过上述三个步骤处理后仍然出现与目标方程式无关的物质,再通过调用剩余的已知方程式,消除无关的物质。
⑤将焓变代入,求出特定目标方程式的反应热或按题目要求书写目标热化学方程式。
察唯一、调系数、定侧向、同侧加、异侧减、消无关、做运算。
三、典例剖析
【例1】[2018年-全国卷Ⅰ-28题节选]
已知:


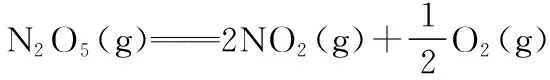
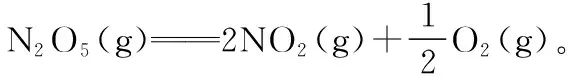
察唯一:N2O5(g)、O2(g)只出现在方程式Ⅰ,NO2(g)只出现在方程式Ⅱ。
1)混凝土和易性差,产生离析现象,砂浆与石子分离,或者漏振、振捣时间不足等。2)混凝土下料时未分层下料或混凝土一次下料过高,未设置溜槽,而使石子集中,造成离析现象。
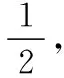
定侧向:同侧相加、异侧相减。
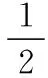
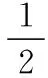
【答案】+53.1
【例2】[2017年-全国卷Ⅰ-28题节选]下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。

通过计算,可知系统(Ⅰ)和系统(Ⅱ)制氢的热化学方程式分别为 、 _____________。
【解析】
(1)思路分析:
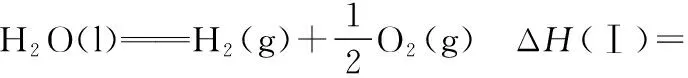
(2)解题步骤:设题干中给出的已知热化学反应方程式由上到下依次为①②③④。
察唯一:H2(g)、O2(g)分别出现在③式、①式中。
调系数:调整已知方程式③式、①式中H2(g) 、O2(g)的系数与目标方程式中的系数一致,即③×1、①×1。
定侧向:同侧相加、异侧相减。
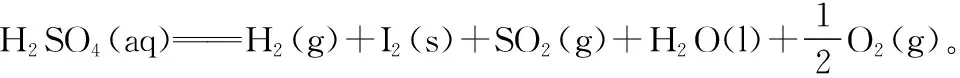
消无关:进一步调整方程式,消除与目标方程式无关的物质,与目标方程式保持一致,可得:
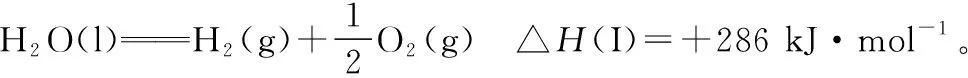
同理也可得:
④+③+②=⑥,做运算ΔH4+ΔH3+ΔH2=ΔH6,即(-151+110+61)kJ·mol-1=20 kJ·mol-1。

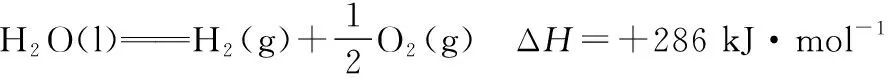

四、总结与启示

