学好有机化学的“官”“键”,轻松设计有机合成路线
2018-12-06云南孙应伦
云南 孙应伦
近几年新课标高考化学试题中对选修5《有机化学基础》的考查题型比较固定,通常是以生产、生活中陌生有机物的合成工艺流程为载体考查有机化学的核心知识,涉及常见有机物官能团的结构、性质及相互转化关系、有机物结构简式的确定、反应类型的判断、化学方程式的书写、同分异构体的识别和书写等知识的考查。有机选做题的最后一小题,经常要求考生以指定物质为原料,设计合成某种化合物的合成路线。这类题型整体难度不大,只要考生能够将题给情境适当迁移,依据各有机物的结构简式分析官能团及断键情况,逐步设计出有机合成路线。它充分体现了高考命题“源于教材又不拘泥于教材”的命题指导思想,考查学生运用所学知识分析、解决实际问题的能力,培养学生“证据推理与模型认知”“科学探究与创新意识”等方面的学科素养,同时也是有机化学复习备考的方向。
掌握有机化合物的“官”“键”,模仿题干中的变化,找到相似点,完成陌生官能团及碳骨架的变化分析,即可轻松设计有机合成路线。
一、设计有机合成路线的基础——掌握有机化合物的“官”“键”及常见有机化合物之间的转化关系
(一)“官”——有机物的化学性质由官能团来决定
掌握每一种官能团的性质,判断其能否发生某类反应,具有何种特性等,有利于正确设计有机合成路线。中学常见官能团性质如下:

官能团含该官能团的分子结构特点主要化学性质代表物质CC含碳碳双键,不饱和①加成:与H2、H2O、HCl、Br2等发生反应;自身加聚成高聚物②氧化:能被酸性高锰酸钾氧化CH2CH2—C≡C—含碳碳三键,不饱和①加成:与H2、H2O、HCl、Br2等发生反应②氧化:能被酸性高锰酸钾氧化HC≡CH—X(卤素原子)C—X键有极性,易断裂①取代:与NaOH溶液共热发生取代反应生成醇②消去:与强碱的醇溶液共热,脱去卤化氢,生成烯烃CH3CH2Br—OH(醇羟基)—OH与烃基直接相连,—OH有极性①与金属钠反应②取代:与HBr反应③氧化:催化氧化成醛或酮④脱水:分子内脱水或分子间脱水⑤酯化:与羧酸反应生成酯CH3CH2OH—OH(酚羟基)—OH与苯环直接相连①弱酸性②取代:与浓溴水反应③显色:与FeCl3反应OH—CHO(醛基)CO双键具有不饱和性①加成:与H2反应②氧化:能被弱氧化剂氧化成羧酸CH3CHO—COOH(羧基)O—H电离产生H+①酸的通性②酯化:与醇反应生成酯CH3COOH—COO—R'(酯基)分子中RCO—和OR'间的碳氧单键易断裂水解反应CH3COOC2H5—NH2(氨基)—①碱性,与盐酸反应②与羧基反应生成肽键CH2(NH2)COOH
对于相似的官能团,如醇羟基、酚羟基、羧基,可以通过比较化学性质来区分:
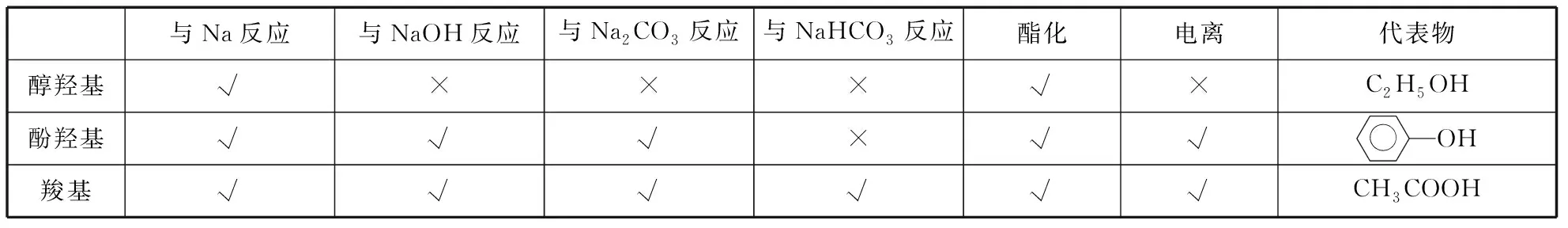
与Na反应与NaOH反应与Na2CO3反应与NaHCO3反应酯化电离代表物醇羟基√×××√×C2H5OH酚羟基√√√×√√OH羧基√√√√√√CH3COOH
(二)有机合成中官能团的转变
1.官能团的引入(或转化)方法
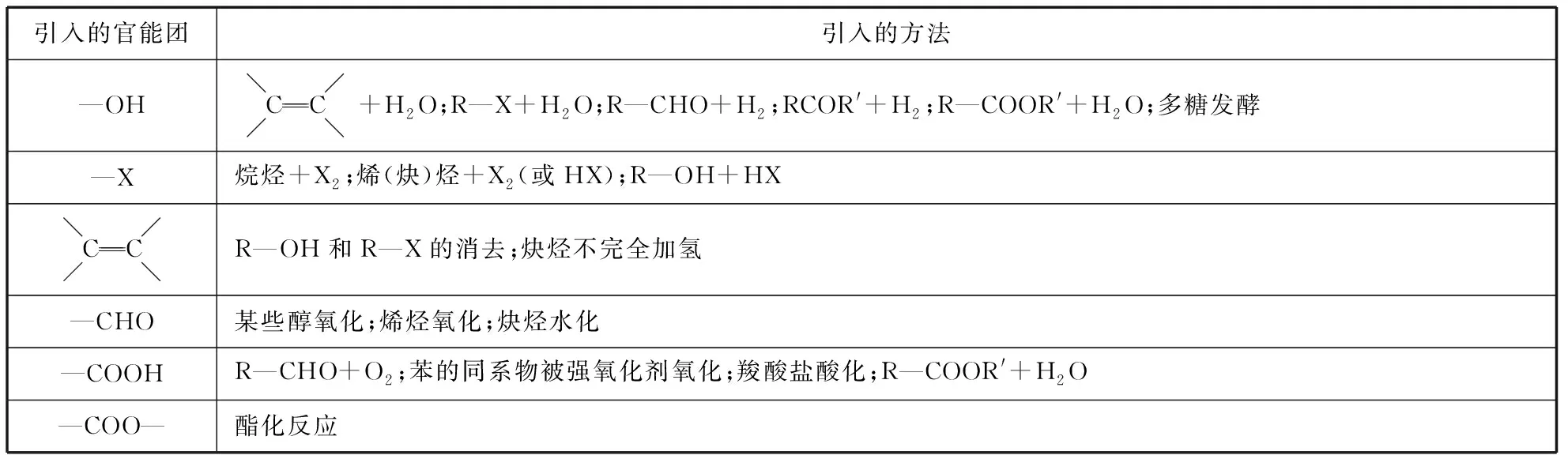
引入的官能团引入的方法—OHCC+H2O;R—X+H2O;R—CHO+H2;RCOR'+H2;R—COOR'+H2O;多糖发酵—X烷烃+X2;烯(炔)烃+X2(或HX);R—OH+HXCCR—OH和R—X的消去;炔烃不完全加氢—CHO某些醇氧化;烯烃氧化;炔烃水化—COOHR—CHO+O2;苯的同系物被强氧化剂氧化;羧酸盐酸化;R—COOR'+H2O—COO—酯化反应
2.官能团的消除
①消除双键:加成反应。
②消除羟基:消去、氧化、酯化反应。
③消除醛基:还原和氧化反应。
3.官能团的保护
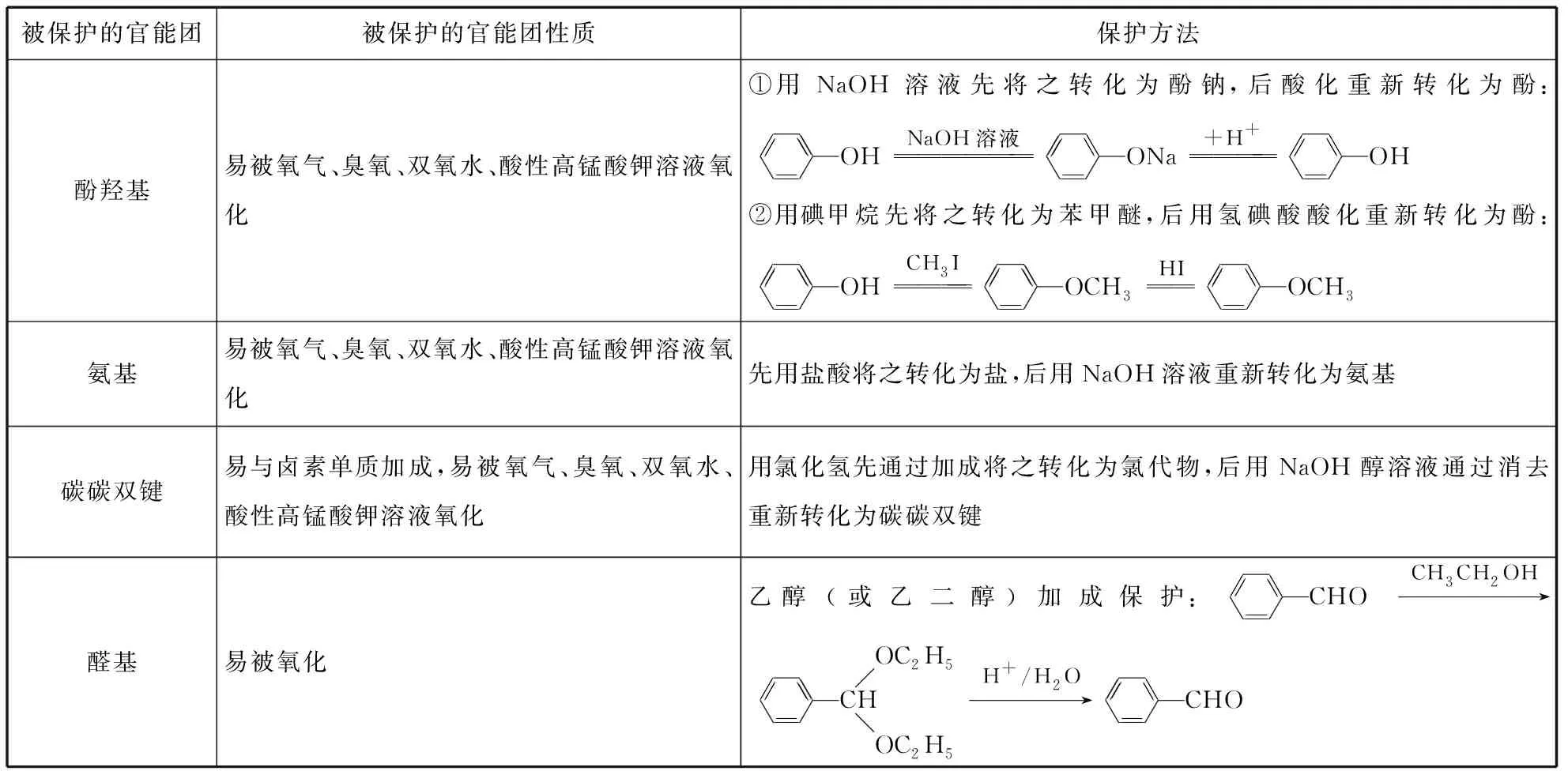
被保护的官能团被保护的官能团性质保护方法酚羟基易被氧气、臭氧、双氧水、酸性高锰酸钾溶液氧化①用NaOH溶液先将之转化为酚钠,后酸化重新转化为酚:OHNaOH溶液ONa+H+OH②用碘甲烷先将之转化为苯甲醚,后用氢碘酸酸化重新转化为酚:OHCH3IOCH3HIOCH3氨基易被氧气、臭氧、双氧水、酸性高锰酸钾溶液氧化先用盐酸将之转化为盐,后用NaOH溶液重新转化为氨基碳碳双键易与卤素单质加成,易被氧气、臭氧、双氧水、酸性高锰酸钾溶液氧化用氯化氢先通过加成将之转化为氯代物,后用NaOH醇溶液通过消去重新转化为碳碳双键醛基易被氧化乙醇(或乙二醇)加成保护:CHOCH3CH2OH→CHOC2H5OC2H5H+/H2O→CHO
(三)“键”——有机反应的化学键断键情况,也就是有机反应的实质
1.有机合成中,经常用到教材中给出的方程式的断键情况。如根据教材中的乙醇的结构及相关反应可知:
当乙醇与钠反应时断①键,与HX反应时断②键,发生消去反应时断②④键,分子间脱水反应时断①或②键,催化氧化时断①③键,酯化反应时断①键。
同样,据乙烯的加成反应方程式可知,烯烃加成反应的实质是双键断开,在双键两端加上原子或原子团;而分析溴乙烷发生消去反应的方程式,可知在反应中是消去官能团和与官能团相连碳原子相邻的碳原子上的一个氢原子,从而在分子中出现碳碳双键;酯化反应的实质是“酸去羟基醇去氢”等。在试题中若用到中学有机化学没有介绍的有机反应,则要读懂题意,仔细分析题中所给出的化学方程式或有机物之间的转化关系,掌握有机反应的断键部位,进行类比迁移,忽略有机物质的整体,看局部,看关键,设计出正确的有机合成路线。
2.利用有机物断键情况,分析增长碳链或缩短碳链的方法。

举例增长碳链2CH≡CH→CH2CH—C≡CH2R—ClNa→R—R+2NaClCH3CHOCH3CH2MgBrH+/H2O→CH3CHCH2CH3OHR—ClHCN→R—CNH+H2O→R—COOHCH3CHOHCN→CHCH3OHCNH+H2O→CHCH3OHCOOHnCH2CH2催化剂→CH2—CH2nCH2CH—CHCH2催化剂→CH2—CHCH—CH22CH3CHONaOH稀溶液→CH3CHOHCH2CHO+R—ClAlCl3→R+HCl+CClORAlCl3→COR+HClnOH+CnHOHHCl→HOHCH2OH+(n-1)H2O 缩短碳链CROONa+NaOHCaO△→RH+Na2CO3R1—CHCH—R2O3Zn/H2O→R1CHO+R2CHO
(四)常见有机物转化关系
1.含单官能团的物质之间的转化

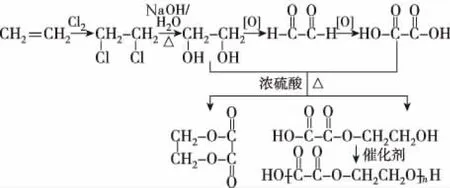
2.含多官能团的物质之间的转化
二、设计有机合成路线的要点——找到原流程中与新合成路线的相似点
设计有机合成路线时先要对比原料的结构和目标产物的结构进行分析,通常用逆合成分析法从合成产物的分子结构入手,采用“断键”分析的方法,先将产物分子分成几个片段,再分析官能团发生什么改变,碳原子个数是否发生变化,结合教材学过的知识和试题所给的新信息及官能团的性质进行逐步分析直到和原料完美对接。物质的合成路线不同于反应过程,只需写出关键的物质、反应条件及使用的物质原料,然后进行逐步推断,从已知反应物到目标产物。
1.原料和目标产物的碳原子数相同,可依据官能团的性质及官能团之间的转化来进行推导。
例1.(2016·全国卷Ⅲ·38节选)端炔烃在催化剂存在下可发生偶联反应,称为Glaser反应。
该反应在研究新型发光材料、超分子化学等方面具有重要价值。下面是利用Glaser反应制备化合物E的一种合成路线:
B C
D E
写出用2 - 苯基乙醇为原料(其他无机试剂任选)制备化合物D的合成路线:_____________。
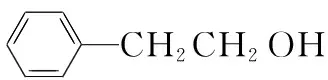

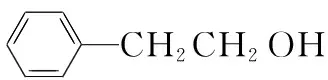
2.原料和目标产物的碳原子数不同,可利用常见有机物的断键情况,将目标产物分子“断键”,分成两部分,再依据官能团的性质及官能团之间的转化来进行推导。
例2.(2017·江苏卷·17节选)化合物H是一种用于合成γ - 分泌调节剂的药物中间体,其合成路线流程图如下:

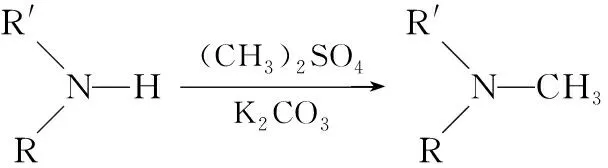
【解析】本题所给原料及目标产物不是高中有机化学常见物质,且碳原子数不同,可采用“断键”分析的方法,先将产物分子分成几个片段,再分析官能团发生什么改变,依据题干所给信息中的官能团的性质及官能团之间的转化来进行推导。
【答案】


