鸡传染性支气管炎病毒江苏分离株S1基因的克隆与序列分析
2018-12-05卢秀娴张思远梁昭平叶贺佳梅廷媛
卢秀娴,张思远,梁昭平,叶贺佳,梅廷媛
(广州市华南农大生物药品有限公司,广东广州 510300)
鸡传染性支气管炎(Infectious bronchitis,IB)是由鸡传染性支气管炎病毒(Infectious bronchitis virus,IBV)引起的一种急性、高度接触性传染病,主要影响呼吸系统、消化系统、泌尿生殖系统等[1]。IBV会引起呼吸困难、肾炎、产蛋量和蛋品质的下降,给家禽业带来巨大的经济损失。IBV具有特殊的复制机制和RNA聚合酶的校对机制,使得病毒基因组重组突变率增高,产生许多血清型,目前血清型已知有超过30种[2],并不断的出现新变异株,因此监测病毒变异和毒力变化对该病防控具有重要意义。
IBV基因组为线性单股正链RNA,全长约27.6 kb,编码小膜蛋白(E)、膜蛋白(M)、核衣壳蛋白(N)和纤突蛋白(S)4 种主要结构蛋白。当S蛋白与宿主细胞膜上的病毒受体结合,并通过宿主细胞的蛋白酶裂解到S1和S2时,病毒包膜可与细胞膜结合[3],病毒纤突能表现出较强的特异性。S1基因是诱导中和抗体的特异位点,可刺激中和血凝抑制抗体产生[4]。只有当S1蛋白诱导中和抗体,才能使机体起到有效地保护[5]。虽然IBV的遗传变异可以在基因组中的任何部分发生,但主要集中在病毒的S1基因。S1蛋白是主要的感染性和致病性的病毒蛋白,结构上的差异导致的血清型的差异,并直接影响着IBV的致病性和抗原性[6]。IBV不同毒株间核苷酸序列差异可高达50%及以上[7]。因此,S1基因是国内外研究最多的基因。本研究于2017年5月份从江苏省某肉鸡养殖场发生疑似传染性支气管炎的病料中分离到1株IBV,并对IBV分离株的S1基因进行克隆、测序和序列遗传变异分析。
1 材料与方法
1.1 材料
1.1.1 病毒来源 采集临床病料(主要是气管、肝脏、肾脏等组织),研碎后加入适量PBS,在-20℃和常温条件下反复冻融3次,8 000 r/min离心10 min,取上清液加入双抗(含200 U/mL青霉素和200 μg/mL链霉素)混合,作用2 h后,取0.2 mL接种于11日龄 SPF鸡胚的尿囊腔,放于37℃培养箱中孵育。36 h~48 h后收取鸡胚尿囊液,连续在SPF鸡胚上盲传3代。
1.1.2 SPF鸡胚及主要试剂 11日龄SPF鸡胚购自梅里亚实验动物中心;RNA提取试剂盒购自TaKaRa公司;DNA Marker DL 2 000 购自北京全式金公司;2×Gotap Master Mix购自Promega公司;反转录试剂盒和核酸染料均购自TIANGEN公司;pMD20-T载体购自TaKaRa公司。
1.2 方法
1.2.1 引物设计与合成 根据GenBank中公布的IBV S1基因组序列,利用 Primer premier 6.0软件及oligo6.0,针对IBV基因组S1基因的保守基因区间设计1对特异性检测引物IBS1(上游):5′-TTCAGGTGGCGTTGATAC-3′(下游):5′-AACCTTGGCCTACTCTGC-3′;根据 S1基因两端外的保守序列设计1对扩增S1全长基因的引物,引物的理论跨幅为1 722 bp,可将S1基因片段完全覆盖,引物序列:S1P1(上游):5′-TTGAAAACTGAACAAAAGA-3′,S1P2(下游):5′-CCATAACTAACATAAGGGCA-3′。引物由英潍捷基(上海)贸易有限公司合成。
1.2.2 IBV分离株RT-PCR鉴定和S1全长基因扩增 提取尿囊液中的病毒基因组RNA,按照天根反转录试剂盒进行反转录。以合成的cDNA为模板,采用S1基因特异性检测引物与S1基因全长引物分别进行PCR扩增,反应条件为:95℃ 5 min;95℃ 30 s,54℃ 30 s,72℃ 2 min,35个循环;72℃ 10 min。PCR反应结束后取产物以110 V、50 mA电流进行电泳,约25 min后于凝胶成像系统紫外灯下观察结果。
1.2.3 IBV分离株S1基因的克隆测序 按照胶回收试剂盒说明书,回收PCR扩增的IBV S1全长基因片段,将回收的PCR产物与pMD20-T克隆载体4℃连接过夜,转化大肠埃希菌DH5a感受态细胞,涂平板蓝白斑筛选,挑去白色单菌落接种到 LB液体培养基中,于37℃恒温培养振荡器内振荡培养12 h后,菌液PCR鉴定后挑取阳性菌液送英潍捷基(上海)贸易有限公司广州测序部进行基因全长序列的测定及拼接。
1.2.4 IBV分离株S1基因的序列分析 应用MEGA6.0分析软件将测定的序列与参考毒株的S1基因序列进行比对,绘制遗传进化树。其中序列比对使用Clustal W多重比对方法,在进化树绘制中选用Neighbor-Joining算法。
2 结果
2.1 IBV的分离与鉴定
病料进行处理与分离培养,利用针对IBV的S1基因特异性检测引物和S1全长基因的引物,通过RT-PCR对鸡胚尿囊液进行扩增,结果能扩增出大小约为500 bp和1 722 bp的2条预期目的片段,而阴性对照没有扩增出条带(图1和图2)。表明该毒株为IBV,命名为CK/GD/073/2017。
2.2 S1基因序列分析
CK/JS/073/2017基因全长1 635 bp(从起始密码子ATG到S前体蛋白裂解位点),编码545个氨基酸,其裂解位点为HRRRR,这与大多数中国流行毒株一致,为中国IBV所特有;和50株国内外代表及常用疫苗株的S1基因序列进行了比较,同源相似性为64.7%~99.4%;与位于同一基因型的参考毒株间同源性较高,与CK/CH/GX/NN11-4株同源性为99.4%,与我国使用的常规Mass型疫苗毒株的同源性较低,与H120和H52之间的同源性仅80.0%~82.2%。
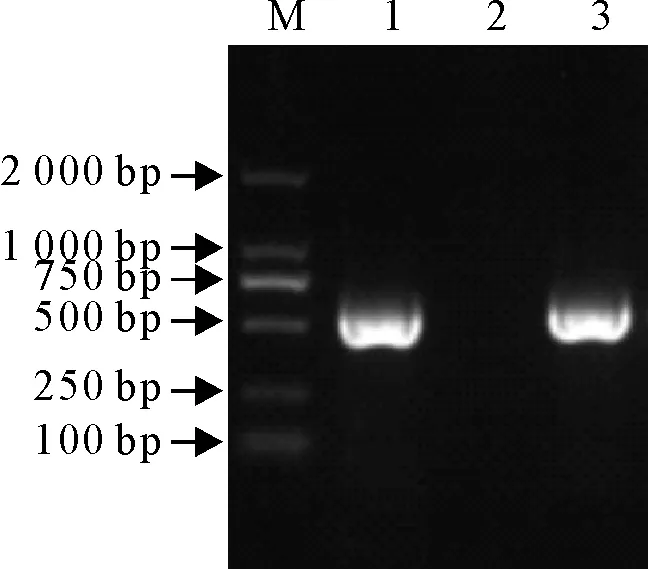
M.DNA标准DL 2 000;1.阳性对照; 2.阴性对照; 3.CK/GD/073/2017
M.DNA Marker DL 2 000; 1.Positive control; 2. Negative control;3.CK/GD/073/2017
图1分离株S1基因RT-PCR鉴定结果
Fig.1 RT-PCR identification result of S1 gene of isolate
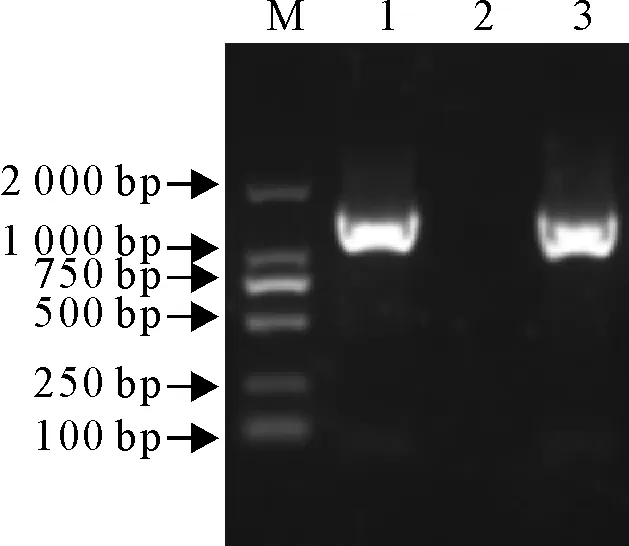
M.DNA标准DL 2 000;1.阳性对照 2.阴性对照 3.CK/GD/073/2017
M.DNA Marker DL 2 000; 1.Positive control; 2. Negative control;3.CK/GD/073/2017
图2分离株S1全长基因RT-PCR扩增结果
Fig.2 RT-PCR result of S1 full-length gene of isolate
研究证明,病毒基因组RNA的点突变、插入、缺失和不同毒株间的基因重组是造成IBV 变异的主要分子基础[8]。经序列分析发现分离株CK/GD/180/2017与其他参考毒株的 S1基因核苷酸序列中存在有大量的点突变外,还伴有碱基的插入、缺失现象,仅在少数区域相对保守;其中与H120相比显示,CK/JS/073/2017株的多处氨基酸位点出现突变,变异主要分别位于19-25、52-79、116-120、196-206、275-292、307-310、375-379 位氨基酸等区域;IBV 中和抗体产生相关的抗原位点分别位于 S1 蛋白的24-61、132-149、291-398处氨基酸,抗原相关区域存在氨基酸突变、插入和缺失,这可能导致病毒抗原性和血清型的改变,并导致免疫失败。
2.3 S1基因系统发育进化关系分析
将测定的分离株IBV 核苷酸序列与参考毒株构建进化树(图3),发现包括标准毒株在内,所有毒株共分为9个基因群,即LX4株、QXIBV株等组成Ⅰ群;英国分离株4/91与UK/7/93 组成基因Ⅱ群;河南分离株 CK/HN/HN99 等组成基因Ⅲ群;广东分离株CK/CH/GD/ZJ10/2013、HN08株组成基因Ⅳ群;台湾分离株 TW2575/98 和TW2296/95等组成V群;CK/CH/GX/NN11-4株等组成基因Ⅵ群; JASS株等组成的基因Ⅶ群;肾型分离株 ARK99 株、Holte 株等组成Gray型,疫苗株H120等代表的 Mass型,其中CK/JS/073/2017属于基因Ⅵ,与H120代表的 Mass型疫苗株的亲缘关系较远。

▲代表分离毒株 ▲Representing the isolate
3 讨论
S1基因是研究IBV遗传变异与进化的重要基因,分析S1基因序列有助于监控IBV的流行趋势。本研究对分离毒株 CK/JS/073/2017 的S1基因进行序列测定,并与国内外已发表参考株 S1 基因比较,表明 CK/JS/073/2017株S1基因属于基因Ⅵ群,裂解位点为HRRRR ,裂解位点与中国大部分毒株相一致,与国内分离株CK/CH/GX/NN11-4株S1基因相似性最高,与常用 Mass型疫苗株相似性较低,与参考毒株 Arkansas、Conn、G ray、793/ B 等血清型同源性差异亦在20%以上。分离毒株与国内普遍使用的疫苗毒株 H120、Ma5亲缘关系较远,是否发生重组,是否因为基因的突变、缺失、插入等现象而导致其毒力和致病性增强,仍需验证。
近年来我国江苏地区尽管使用疫苗免疫鸡群,但仍频繁发生IB[9],且有新的变异株产生。IBV的基因组变异频率高,突变形式多样,血清型众多,尤其是以 S1基因变异最大[10]。S1基因的点突变、插入、缺失或 RN A重组都可产生新血清型、亚型或变异株,这也是免疫鸡群中暴发IB的主要原因,现有Mass型疫苗可能在该地区起不到良好的免疫保护作用[11]。因此,必须对江苏地区的流行株进行血清定型 ,并对流行株进行分子流行病学研究,有助于更好地了解IBV的变异,从分子水平上揭示 IBV 的变异基础和规律,为新型疫苗的研发提供参考依据,也为江苏地区IB防控提供科学依据。
