自发性冠状动脉夹层
2018-12-05马琼综述徐日新审校
马琼 综述 徐日新,2 审校
(1.大连医科大学研究生院,辽宁大连116000;2.苏北人民医院心内科,江苏扬州225002)
1 流行病学
第一例自发性冠状动脉夹层(SCAD)由Pretty等[1]报道于1931年,一名42岁的女性由于反复干呕,呕吐致冠脉动脉瘤破裂形成夹层。近年来随着急性冠脉综合征(ACS)患者冠状动脉造影(CAG)的广泛应用,血管内超声(IVUS)、光学相干断层扫描(OCT)等影像技术的使用普及,此病的诊断率较前大幅增加。Tweet等[2]估测此病的年发病率约为0.26/100 000;但由于突发心脏猝死,年轻女性CAG检测的不足以及CAG诊断的有限性等因素,其真实发病率应更高,故应引起医务工作者的足够重视。有报道指出,ACS患者中此病的发生率在1.7%~4%[3]。此病好发于女性,尤其是妊娠期女性[4]。最近对美国的一个数据库分析发现,在怀孕期间或产后6周,每10万次妊娠中有1.81起SCAD事件[5]。发病时间主要在第三孕期和产后阶段[6]。因此年轻女性ACS患者中SCAD并不罕见,尤其是妊娠相关的心肌梗死中SCAD是一个主要原因。SCAD患者中女性占92%~95%,平均年龄在44~55岁[7],而男性的发病年龄略低于女性[8]。
2 发病机制
SCAD可以发生在动脉管壁三层中(内膜、中膜、外膜)的任意一层或两层之间[7]。SCAD被广泛认可的发病机制有两种:(1)内膜撕裂假说:动脉内膜受损,在内膜上形成一个入口,血液由此进入动脉壁内,致动脉壁分离。如动脉壁形成出口,则出现典型的夹层的真腔与假腔相通,且假腔在压力下进一步扩大可压迫真腔。心肌缺血是冠状动脉管腔受压的表现。(2)内出血假说:滋养动脉自发破裂,形成壁内血肿,随压力的逐渐增加形成出口,血液进入真腔,可产生逆向内膜撕裂[9]。有研究证实夹层的发生常合并血栓形成,最易形成部位是内膜破口处[7]。一个11例的小型OCT研究在所有病例的管腔中均发现了血栓的存在,但大多数对病情并无影响[10]。
冠状动脉粥样硬化的患者,斑块破裂形成内膜破口,也可形成真假腔。这种病例较罕见,但随着病情的发展,双腔的进一步延伸也可形成SCAD的影像表现,但严格就发病机制来分类,冠状动脉粥样硬化斑块破裂所致双腔形成并不属于SCAD,同样,由于病理生理机制的不同,医源性夹层和继发于外伤的夹层也不属于SCAD的范畴。SCAD定义:SCAD是非医源性或外伤引起的,自发的冠状动脉管壁的分离[7]。
3 发病诱因
SCAD的发病诱因是多方面的,其中以剪切应力增加为主,剧烈的有氧运动、力量训练、胸部钝挫伤、Valsalva动作、反复咳嗽或打喷嚏等均可能成为潜在的促发因素[11]。此外,目前已报道的诱因还有心理压力、药物滥用(主要是可卡因)、缩血管药物、激素类药物的应用、冠状动脉痉挛等[12]。在Saw等一系列的研究中,26%的病例发病前有激烈的情绪变化[12],56%的患者有长期的慢性情绪应激,女性以情绪应激为多,而男性则以锻炼相关的应激为多[8],这可能是由于儿茶酚胺释放增加主动脉压和心肌收缩力,促进血管痉挛所致[8]。多种临床情况均可导致SCAD的发生,如孕期、围产期、围绝经期、口服避孕药等。加拿大的一项研究指出,27%的患者既往有偏头痛病史,29%的患者有抑郁倾向[13]。
SCAD主要影响女性群体,特别是妊娠期和围产期后,其应与动脉壁受损有关,已有研究证实,雌激素可能会改变动脉壁的结构,影响弹性纤维、黏多糖的成分、胶原的合成,致动脉壁易损性增加[7,14]。据文献报道,一些全身性疾病也可能与SCAD的发生有关:(1)结缔组织病,如马方综合征、 Ehlers-Danlos综合征4型、 Loeys-Dietz综合征、多囊肾;(2)全身性炎性疾病,如系统性红斑狼疮、类风湿性关节炎、多结节性动脉炎、克罗恩病、结节病等[11]。近期大多数研究发现SCAD的发生与纤维肌发育不良(fibro-muscular dysplasia,FMD)有一定的相关性。FMD是一种非炎症性、非动脉硬化性动脉血管病。女性多见,女性和男性患者之比为3~4∶l,有85%的头颈部动脉FMD是中年女性,既可导致动脉的狭窄和闭塞,又可引起动脉瘤或血管夹层[15]。病变呈节段性,可单发或多发,主要累及全身中等大小的动脉,以肾动脉和颈内动脉最常见,常为双侧对称病灶。动脉造影可发现特征性串珠样改变。中型动脉中FMD的退行性改变会导致动脉壁各层间的剥离。在美国的一项FMD相关研究中,25.7%(237/921)的患者发生了不止一处的动脉夹层,其中,10.5%(25/237)发生了SCAD[16]。 Saw等[13]筛查了50例SCAD患者,发现86%的患者有FMD,但其病变多表现在非冠状动脉(如肾动脉、髂动脉),14%的患者检测到大脑或颈动脉瘤。一项梅奥诊所的验证研究证实,SCAD患者行髂股动脉造影,发现50%的患者有髂动脉FMD,无创CT检查发现2/3的SCAD患者存在外周血管的异常,包括FMD、动脉瘤、夹层、大主动脉迂曲等[2,17]。在这项研究中,FMD或外周血管异常的患者并无SCAD的复发以及临床不良事件[17]。对于SCAD患者FMD的高发生率,应进行一个更系统的筛查,进一步的研究十分必要,以确定是否存在巧合关联或其他因素。
4 临床表现
SCAD患者就诊的主诉主要为胸痛[18],临床表现包括ST段抬高型心肌梗死、非ST段抬高型心肌梗死、心肌缺血、恶性心律失常、晕厥、心源性休克、心脏猝死等[7]。其中较特殊的可引起室壁反常运动,需与应激性心肌病鉴别[19],也可因无明显临床症状而被忽视。心肌酶水平整体来说是增加的,但 SCAD患者的最初的肌钙蛋白水平可能是正常的[20]。超声心动图或早期血管造影可发现左室室壁运动异常,但左室射血分数通常变化不明显[21]。
5 诊断
近年来,随着临床认知的提高,ACS患者早期CAG的广泛应用,SCAD的确诊率较前有大幅增加,高分辨率的动脉腔内影像检测技术的应用使此病的误诊率大大降低。CAG是SCAD的主要诊断方式,典型的表现是典型的夹层双腔征象,可观察到内膜皮瓣[7]。NHLBI分类可用来评估SCAD的血管造影。临床上年轻女性CAG发现局灶性或弥漫性病变,而其余血管光滑应警惕壁内血肿的可能。Saw等[22]提出了一种简单的SCAD的造影分类:1型为经典的双腔造影,可见到内膜皮瓣;2型为壁内血肿弥漫性的狭窄;3型为类似粥样硬化的局灶性狭窄。梅奥诊所的研究发现SCAD患者(n=246)相较于对照组(年龄与性别匹配,n=300)更易发生冠状动脉的迂曲,这些迂曲的冠状动脉可表现为螺旋形态,对于SCAD的诊断是有价值的[23]。
IVUS和OCT可提高此病的确诊率。IVUS(轴向分辨率150 μm)可清晰地区分正常血管壁和粥样硬化斑块,分辨出真腔和假腔,也可检测出假腔内的血栓[11]。OCT(轴向分辨率15 μm)可清楚地看见整个病变节段内膜至中膜,测量夹层壁的厚度,包括内膜和内2/3的中膜[7]。OCT可以测量病变节段[双腔或壁内血肿的全长在(32±12)mm,夹层壁的厚度平均为350 μm],提供内膜-腔接口的清晰图像,准确地测量真腔的面积和直径[7];但血肿范围大时OCT视野有限,不能完全覆盖。OCT/IVUS在此病的诊断及血运重建的过程中有指导性意义。OCT/IVUS可获取清晰的图像,但操作时应更加谨慎,以防止血管损伤。虽然非侵入性影像检查在SCAD诊断中应用较少,但多层螺旋CT在SCAD患者的诊断中也有一定的价值[24],这种检测技术可以看到冠状动脉双腔,壁内血肿则表现为管腔内的偏心高密度影,其阴性结果需谨慎。多层螺旋CT更适合应用于随访中,提供动态的演变图像[24]。在多层螺旋CT的随访中,发现血管壁的愈合期在3~6个月,而且预后良好[11]。核磁共振成像在此病的诊断中无太大的价值。
6 治疗
对于血流动力学稳定的SCAD患者,推荐“观察等待”的策略。大多数研究表明保守的药物治疗在大多数患者中有比较好的临床效果,保守的药物治疗作为第一临床推荐。若患者药物治疗的情况下,临床症状持续不缓解或夹层进展、血流动力学不稳定时,应考虑进行血运重建。
6.1 保守治疗
临床上首先选用ACS的推荐治疗方案。使用抗血小板药、抗凝药物是一把双刃剑,一方面可防止血栓的形成以及血管的进一步闭塞,但同时也延缓血管壁的愈合,也可能加剧夹层的进展[7]。经验表明,促纤溶药物和Ⅱb/Ⅲa血小板抑制剂可进一步增加内出血的风险[25],而溶栓治疗可能会出现病情恶化。因此,学者建议联合使用阿司匹林和氯吡格雷抗血小板,但应根据是否有血栓形成与疾病进展来衡量,而个体化使用[7]。若患者胸痛症状持续,夹层进展,抗凝治疗是有风险的,在这种情况下使用抗凝治疗对内膜的稳定性有一定影响[26]。由于可以减少心肌耗氧以及局部剪切应力,推荐β受体阻滞剂的应用。近期温哥华一项随访3.1年的研究指出,使用β受体阻滞剂后,SCAD复发的风险比为0.36,这一研究有助于促进β受体阻滞剂的使用[27]。硝酸酯类和钙离子通道阻滞剂可在伴发冠状动脉痉挛时应用。一项纳入327例受试者的队列研究显示,使用他汀类药物和SCAD复发并无相关性,但若无明确指南指征不建议常规使用他汀类药物[27]。血管紧张素转换酶抑制剂类药物可用于继发左心室功能不全的患者。目前,缺乏前瞻性研究的对照数据来指导SCAD的药物治疗是一个主要的限制。因此,基于循证医学的推荐,实际的临床判断在这些患者的治疗中尤为重要。
6.2 血运重建
由于动脉血管壁的易损性增加,解剖结构的复杂性,SCAD患者血运重建充满了挑战性。在一项45例SCAD患者研究中,有16例患者(35%)在住院期间需冠状动脉血运重建,其中9例因为持续缺血存在需紧急血运重建,剩下的7例患者因为在住院期间复发缺血而选择择期血运重建,2例患者接受冠状动脉搭桥手术(其中1例死亡),14例患者植入支架。在两年随访时间内,只有3例发生了心脏不良事件(1例死于充血性心力衰竭,2例患者需再次血运重建)。然而,在随访期间,无患者再发心肌梗死或猝死。所有患者中,随访造影的图像50%完全自愈,或改善明显[10]。经皮冠脉介入术是血运重建的第一选择,此病的介入治疗由于复杂的解剖基础,存在一些技术难题,包括确保导丝位于真腔、避免夹层进一步延伸、避免壁内血肿播散、避免发生侧支闭塞[7]。而且,SCAD的介入治疗中导管的置入可能引起医源性夹层的发生。如选择支架植入术,应选择保守植入方式。在相对局限的夹层或血肿,一些研究更倾向于建议选择相对长的支架覆盖夹层的远端以及近端,以避免病变的扩展。IVUS、OCT可帮助确认导丝是否位于夹层真腔,确认内膜撕裂位置以及计算纵向病变的范围[11]。此外,冠状动脉内成像可优化支架植入,评估植入效果,尤其可以确认残余壁内血肿及残余夹层情况[7]。药物洗脱支架似乎优于传统的金属裸支架,尤其当需要覆盖全部病变时可以减少再狭窄的发生,但药物洗脱支架是否会延缓病变血管壁的愈合并不明确[11],AHA指南推荐使用生物可吸收支架[28]。使用切割球囊或嵌入式球囊可使假腔血液流入真腔,而对真腔进行减压[28]。冠状动脉搭桥术用于不适合冠状动脉介入治疗、难治性症状的SCAD患者。包括左主干病变、多支病变、导丝无法评估管腔内情况等。在梅奥诊所的一系列研究中,冠状动脉搭桥的预后不佳,虽然最初的手术结果和住院期间的观察是良好的,然而,在随后的血管造影随访中,由于冠状动脉搭桥术存在远期竟争血流、移植血管血栓,远期通畅率低[7](图1)。
7 预后
SCAD患者预后良好,夹层可自发愈合,一般愈合时间在半年左右。急性期内的院内死亡率<5%,其他主要心脏不良事件(MACE)发生率为5%~10%;2年内的MACE发生率在10%~20%,夹层复发率在15%以内,4~5年的复发率在27%以内[7]。在一项样本量为280例的研究中,MACE的发生率为20.4%,平均时间在2.3年;心肌梗死复发率为19.0%,SCAD复发率为12.2%[29]。值得注意的是,围产期后SCAD患者可能较其他SCAD患者预后不佳。
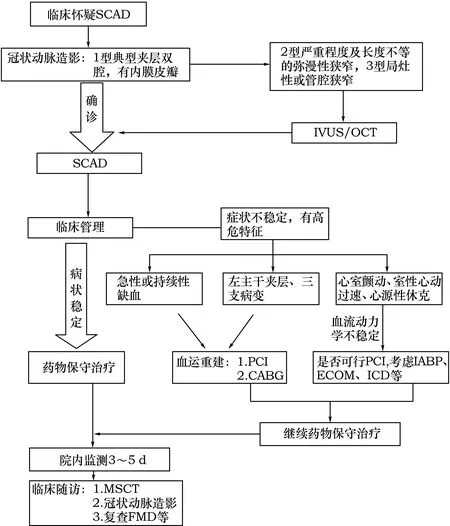
图1 SCAD诊疗流程图
注:PCI:经皮冠脉介入术;CABG:冠状动脉旁路移植术;IABP:主动脉内球囊反搏;ECOM:体外膜肺氧合ICD:埋藏式自动复律除颤器;MSCT:多层螺旋CT。
8 结语
SCAD作为ACS的少见病因,临床并不罕见。它的发生存在多种因素,目前认为其与FMD密切相关。保守治疗为第一选择,除血流动力学不稳定、左主干夹层等情况。CAG对其检出率低,极易漏诊,需借助IVUS和OCT等技术识别。对于中青年女性ACS患者,CAG显示其他血管未见明显动脉粥样硬化病灶,都应想到SCAD的可能。SCAD患者急性期生存率尚可,然而,长期的MACE常见,包括SCAD的复发。因此,应密切关注SCAD患者心脏事件,进行前瞻性研究,探索改善心血管疾病的策略。
