硫化氢改善高糖环境下内皮祖细胞功能活性的机制研究*
2018-12-05柯娩英杨治芳周华华孙靖陈芳吴文辉刘鸿滨
柯娩英 ,杨治芳 ,周华华 ,孙靖 ,陈芳 ,吴文辉 ,刘鸿滨
(1、江西省抚州市第一人民医院,抚州 344000;2、南昌大学第一附属医院,南昌 330006)
近年来发现,在人体外周血中存在一种骨髓源性的内皮祖细胞 (endothelial progenitor cells,EPCs),具有定向黏附至损伤血管壁修复损伤血管内皮的作用,对于维持血管结构和功能的完整性起着重要的作用[1,2]。 硫化氢(Hydrogen sulfide,H2S)是近年来广泛受到大家关注的一种新型的气体信号分子,研究证实,内源性或外源性H2S在保护心肌缺血损伤、再灌注损伤、抗高血压、抗休克及在神经系统、呼吸系统、消化系统中均具有重要作用[3,4]。我们既往研究发现,硫化氢能够上调内皮祖细胞的生物学功能[5],然而在高糖环境下,硫化氢是否能够调控内皮祖细胞的功能活性及其可能的分子机制有待我们深入研究。本实验拟在细胞水平,观察硫化氢对高糖环境下EPCs的增殖、迁移、黏附能力,以及在糖尿病裸鼠颈动脉内膜损伤的模型中,观察硫化氢预处理后EPCs的内皮损伤修复作用,研究其可能的分子机制;为外源性应用硫化氢调控内皮祖细胞治疗糖尿病相关动脉粥样硬化性疾病提供新的思路和方法。
1 材料和方法
1.1 EPCs的分离和培养 取来自抚州市第一人民医院健康志愿者外周血作为EPCs来源:⑴正常健康人30例,所有采血者均排除吸烟、近期外伤手术史,签署书面的知情同意书,并经伦理委员会批准。⑵外周静脉血40ml与PBS缓冲液1:1稀释后按2:1比例加入人淋巴细胞分离液,采用密度梯度离心法分离纯化外周血单个核细胞;重悬于EGM-2培养基(含10%胎牛血清、青霉素100U/ml、链霉素0.1mg/ml、VEGF 50ng/ml), 接种于预先人纤维链接蛋白包被的细胞培养瓶中培养;3d后去除未贴壁悬浮细胞,更换培养液后继续培养;每3d换液一次,在倒置显微镜观察细胞的形态变化,培养至7d左右的贴壁细胞即为实验所用的内皮祖细胞。
实验分组:将贴壁细胞随机分为7组:⑴正常糖浓度(5.5mmol/L):⑵高糖组(33mmol/L);⑶高糖(33mmol/L)+不 同 浓 度 NaHS(25、50、100、200uM)组;⑷高渗透压对照组:5mmol/L葡萄糖+35mmol/L甘露醇;培养24h,每组设3个复孔,实验重复3次。
1.2 EPCs的体外增殖实验 取培养至第7d的EPCs进行增殖实验:吸取培养液后用PBS冲洗2遍,加入0.25%胰蛋白酶1ml 37℃消化5min,加入血清培养基终止消化,收集消化下来的细胞,1500rpm离心5min,PBS洗涤后离心2次,用2ml含10%胎牛血清EBM-2培养液稀释后计数,根据计数结果将细胞浓度调整为3×104/ml的细胞悬液,取96孔板,吹匀细胞悬液,每孔加入细胞悬液100ul,加入干预药物,放置于37℃ 5%CO2孵箱中培养,24h后,每孔加入CCK8 10ul,放置于37℃5%CO2孵箱中培养4h,将96孔板放置于酶标仪上选择450nm处的吸光度,打印数据;
1.3 EPCs的体外迁移实验 取培养第7d的EPCs进行迁移实验;吸去培养液后用PBS冲洗两遍,加入0.25%胰蛋白酶1ml 37℃消化5min;加入含血清培养基终止消化,收集消化下来的细胞,1500rpm离心5min;PBS洗涤后离心2次,用2ml PBS液稀释后计数,根据计数结果将细胞浓度调整为3×105/ml的细胞悬液;取孔径为8um的Tanswell小室,让入24孔细胞培养板;下室加入含50ng/ml vascular endothelial growth factor(VEGF)的M199培养基;将细胞悬液吹匀,于上室每孔加入细胞悬液100μl;放置于37℃5%CO2孵箱中培养24h;取出Transwell小室让入4%多聚甲醛固定30min;将Transwell小室放入DAPI染色5min;清水中洗净多余的DAPI,棉签擦去上室底部的细胞;镜下计数随机6个高倍视野(200x)的下室的贴壁细胞数量。
1.4 EPCs的体外黏附实验 将培养的HUVECs胰酶消化后,按2×105/孔接种到4孔中培养48h后形成单层的内皮细胞层。EPCs荧光标记:将培养7d EPCs换液后,加入1ug/ml CM-DiI的无血清DMEM培养液37℃5min,4℃ 15min孵育后消化重悬;将消化重悬的EPCs按1×105/孔加入含内皮细胞单层的4孔板中,37℃静置3h后将含有EPCs的培养液吸出,用PBS缓冲液轻轻漂洗3次,用4%多聚甲醛固定10min后用DAPI染核。然后在荧光显微镜下观察,计算粘附于内皮细胞单层上的内皮祖细胞数量。
1.5 裸鼠颈动脉拉脱损伤模型 材料:健康8-10周雄性无胸腺裸鼠24只,重约16-18g,购自中山大学动物实验中心,SPF动物房,生产许可证号:SCXK(粤)2017-0029。
1.5.1 手术 雄性裸鼠,以3%戊巴比妥钠腹腔麻醉,取颈部正中切口,从尾静脉注射肝素钠100u/kg。暴露左侧颈总动脉和颈外、颈内动脉,用眼科剪游离出左侧颈总动脉伴行的迷走和交感神经,完全分离约2.5cm,在颈外动脉下穿2根5-0丝线,2根丝线间距离大约0.5cm,结扎远端。在2根丝线间剪开一小口,插入直径0.35mm的金属导丝至颈总动脉,旋转进出3次以剥脱内膜。完成后结扎颈外动脉,观察颈总动脉的搏动是否形成血栓,常规缝合皮下组织及皮肤。术中、术后给予肝素钠抗凝各一次,术后常规青霉素抗感染处理。
1.5.2 内皮祖细胞的移植 将培养7d的志愿者外周血来源EPCs消化,PBS缓冲液重悬为密度5×105/100μl的细胞悬液置于37℃(EPCs示踪实验时EPCs先用CM-DiI标记),拉脱手术约3min后裸鼠苏醒,将上述内皮祖细胞悬液按5×105每只从尾静脉注入裸鼠体内,对照组用不含细胞的PBS缓冲液或HUVEs注射。
细胞移植分组:⑴空白对照组:PBS注射;⑵正常葡萄糖组干预组:5.5mmol/L孵育EPCs组;⑶高糖干预组:35mmol/L孵育 EPCs 24h移植;⑷200uM预处理12h+35mmol高糖干预组。
1.5.3 伊文思蓝染色 将术后3d的裸鼠麻醉,经尾静脉注入100ul的3%伊文思蓝溶液,10min后打开颈部正中切口取双侧颈总动脉,处死动物;冲洗管腔后纵剖血管,内膜朝上置于载玻片,在体视学显微镜下观察,剥脱面积为获得动脉节段的总面积额,内皮再生面积为不被Evasns Blue着染得面积,并通过计算机图像分析软件Image-pro plus测定损伤总面积和内皮再生面积,计算内皮再生面积与损伤总面积比值。
1.6 蛋白检测 采用Western blotting检测NaHS干预前后EPCs目的蛋白的表达情况。培养7d后的EPCs经预冷的PBS洗涤后,用细胞裂解液于4℃裂解5min。将全细胞裂解产物经30x2s超声后进行蛋白定量。取20μg蛋白进行SDS-PAGE并转印至硝酸纤维素膜上,用Akt、p-AK2及eNOS、peNOS 相应的特异性一抗[Akt(1:2000)、p-Akt(1:2000)、eNOS(1:2000)、p-eNOS(1:2000)]单克隆抗体购买于Cell signal technology公司,以相应的荧光二抗和ECL蛋白印迹分析仪检测目的蛋白。
1.7 统计分析 应用SPSS 13.0统计软件包进行数据处理。计量数据用均数±标准差(x±s)表示,两组间比较采用t检验,组间比较采用单因素方差分析,计数资料用率表示,组间比较用Chi-Square分析。P<0.05表示差异有统计学意义。

图1 培养7d的EPCs光镜下图片(100x)
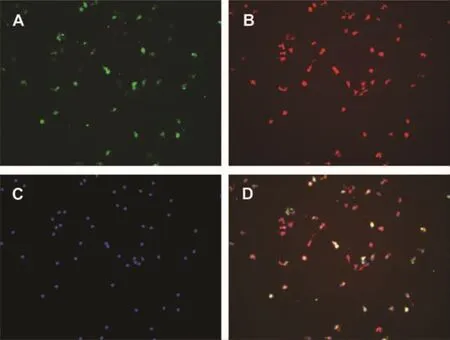
图2 培养7d的EPCs免疫荧光双标(200x)
2 结果
2.1 EPCs的鉴定
2.1.1 EPCs倒置显微镜观察形态 培养7d后的EPCs贴壁细胞呈现梭型、铺路石样(图1),培养7d后的EPCs,用DiI-ac-LDL和FITC-UEA-I进行免疫荧光鉴定,免疫荧光显微镜下观察细胞摄取DiI-ac-LDL呈现红色荧光,结合FITC-UEA-I呈现绿色荧光,DiI-ac-LDL和FITC-UEA-I双染色阳性细胞呈现黄色荧光,被认为是正在分化的EPCs(图 2)。
2.2 EPCs体外增殖能力 用CCK8法检测在高糖环境下,NaHS对EPCs的保护作用;与正常糖浓度组相比,高糖组的EPCs增殖能力明显降低 (P<0.05)。 20uM、50uM、100uM、200uM NaHS 作 用 后EPCs的增殖能力呈剂量依赖性升高 (P<0.05),而高渗透压对照组与5mmol/L葡萄糖组相比无显著差异。

图3 EPCs体外增殖能力
2.3 EPCs体外迁移能力 采用改良Boyden小室法,我们比较不同浓度NaHS预处理EPCs,在高糖环境下体外迁移能力的变化。与正常糖浓度组相比,高糖环境下EPCs的体外迁移能力明显下降(P<0.05),而 NaHS 预处理 EPCs后,在高糖环境下的迁移能力明显得到恢复,并呈明显剂量依赖性改变,而高渗透压对照组与5mmol/L葡萄糖组相比无显著差异。
2.4 EPCs体外黏附能力 通过内皮细胞黏附实验,我们发现与正常葡萄糖处理组 (5mmol/L)相比,35mmol/L高糖组明显降低EPCs的黏附能力(P<0.05);而高渗透压对照组与5mmol/L葡萄糖组相比无显著差异,NaHS预孵育的内皮祖细胞呈浓度依赖性恢复在高糖环境干预下的黏附能力(P<0.01)。
2.5 EPCs在体再内皮化实验 实验中采用裸鼠颈动脉内皮损伤拉脱模型,我们将培养7d后的内皮祖细胞用CM-DiI标记,通过尾静脉静脉注射至裸鼠体内;3d后比较裸鼠颈动脉内皮损伤修复情况;结果显示,EPCs移植与PBS注射组相比可促进损伤血管内皮再内皮化修复面积(P<0.05),而相比于正常葡萄糖孵育EPCs移植组,高糖环境孵育EPCs修复能力明显下降(P<0.01),采用 NaHS 预处理后,EPCs的内皮修复能力得到部分恢复(P<0.01);
2.6 Akt-eNOS信号通道的检测 采用Western blot法,我们检测EPCs Akt-eNOS蛋白表达情况,结果显示,高糖35mmol/L干预下EPCs的p-Akt及peNOS蛋白表达水平较正常葡萄糖干预组明显下降(xx vs xx,P<0.05);而单独 200uM NaHS 干预组可明显上调EPCs的p-Akt及p-eNOS蛋白表达水平(P<0.01),并且部分修复在高糖环境下EPCs的p-Akt及p-eNOS蛋白表达水平。
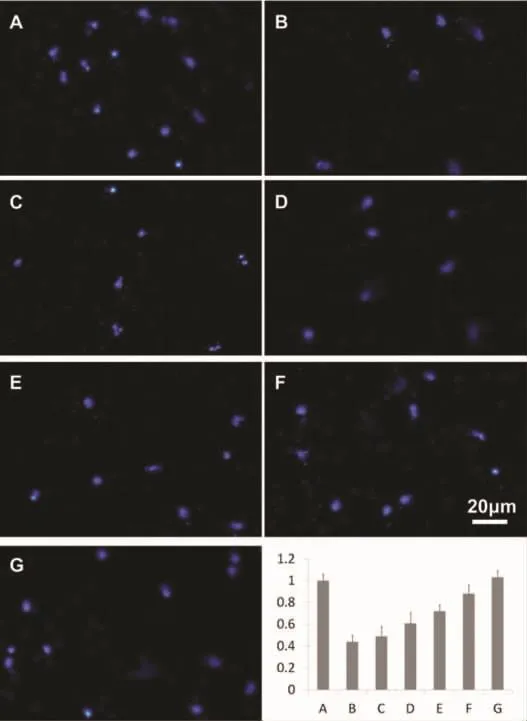
图4 EPCs体外迁移能力
3 讨论
针对糖尿病合并动脉粥样硬化性心脏疾病的治疗,随着干细胞研究的不断深入,以干细胞为主要方式的新型治疗模式—“治疗性血管新生和血管修复”已成为医学、生物学领域关注的焦点[1,6]。基础研究及临床均显示干细胞移植通过增强受损组织血管新生及受损血管内皮修复发挥治疗作用。EPCs是一类具有高增殖潜能、能定向分化为内皮细胞的多能干细胞。它参与缺血后血管新生和受损血管的再内皮化,维持血管稳态,在缺血组织及受损血管修复等生物工程方面有着良好的临床应用价值。
然而干细胞移植还存在许多问题;其中最为重要的是干细胞移植后的在体生存率低下。绝大部分干细胞在移植后不能归巢至受损组织,以及凋亡率过高;其原因上不明[7];多数临床研究表明,糖尿病患者中的危险因素如高血糖、高血脂、高胰岛素血症等导致EPCs功能活性下降及数量的减少,并且由于EPCs所在的内环境受到多种诸如高血糖、高血脂、高血压等影响,其归巢能力下降,很难归巢至病变部分,通过增殖、分化发挥血管新生和血管修复的代偿性作用,这也是单纯外源性输注EPCs治疗效果欠佳的原因之一[8]。鉴于此,如何解决干细胞移植的治疗性血管新生和血管修复疗效不佳的问题,是干细胞移植由“实验室”转化之“临床”重要一步,这对于改善糖尿病血管并发症的治疗有着重要的临床应用价值。

图6 再内皮化情况

注 :A:正 常 糖 浓 度 (5.5mmol/L);B:高 糖 组 (33mmol/L);C:高 糖(33mmol/L)+200uM NaHS;D:200uM NaHS。
硫化氢(Hydrogen Sulfide,H2S)是一种无色、特征性臭鸡蛋气味、具有良好水溶性的可燃性气体。近年来越来越多的研究证实,内源性H2S作为调节递质可以发挥多种生物学功能,在动脉粥样硬化、心肌缺血再灌注损伤、抗高血压、抗休克及在神经系统、呼吸系统、消化系统中均具有重要的病理生理作用。Yan等[9]在自发性高血压大鼠的研究中发现,与正常对照组相比,实验组大鼠血浆硫化氢表达水平明显下降,并且胸主动脉内硫化氢活性降低、CSE mRNA水平表达下降,通过人工途径干预硫化氢通路可诱发高血压的发生,而给予外源性硫化氢可降低血压,Yang等[10]通过敲除小鼠 CSE 生成基因(CSE-/-、CSE-/+)后,动脉血压升高,进一步证明H2S/CSE系统参与了血压的调节及其在高血压发病中的重要性。Wang等[11]通过向载脂蛋白E基因敲除小鼠(ApoE-/-)体内注射外源性 H2S供体硫氢化钠 (Sodium hydrosulfide,NaHS)能有效地抑制血管平滑肌细胞增殖、内皮细胞黏附分子表达及泡沫细胞形成等途径阻止动脉粥样硬化的发展,证明硫化氢与动脉粥样硬化的发生发展有直接关系。
在我们前期研究中,硫化氢在非高糖环境下能够明显上调EPCs的增殖能力,而且其迁移及黏附能力均可得到进一步提高;本研究探讨硫化氢是否具有抗高糖环境下内皮祖细胞的生物学功能下降以及介导的内皮损伤修复作用及可能分子机制。结果显示,在高糖环境下EPCs的增殖、迁移及黏附能力较正常葡萄糖水平作用组明显下降,而加入 NaHS(20、50、100、200uM)干预后,EPCs的上述生物学功能均得到一定程度的恢复,这种修复作用与NaHS的浓度有着明显的浓度依赖性。Liu Fang等[12]发现硫化氢通过恢复内皮祖细胞功能及激活血管生成素1受体促进2型糖尿病小鼠的皮肤创面愈合作用。进一步研究发现在糖尿病小鼠下肢缺血模型中,通过提高体内硫化氢水平能够促进骨髓干细胞的动员,进而发挥血管新生作用[13];上述研究说明硫化氢可通过调控内皮祖细胞或者骨髓源祖细胞的功能变化发挥促进血管新生作用;而硫化氢是否能够同样能发挥在高糖环境下,通过改善内皮祖细胞的生物学功能发挥血管修复作用。本研究通过裸鼠颈动脉内膜损伤模型,观察到高糖环境下孵育的内皮祖细胞通过尾静脉途径进行细胞移植,其发挥的内皮修复能力明显低于正常葡萄糖孵育的内皮祖细胞移植组;NaHS预处理EPCs 12h后,再继续于高糖环境下孵育24h后进行细胞移植,有趣的是,EPCs的再内皮化能力较单纯高糖环境EPCs有了明显的恢复,说明硫化氢可以恢复高糖环境对内皮祖细胞的损害作用。这与我们前期硫化氢预处理EPCs提高其再内皮化能力及归巢能力相符合。
丝氨酸/苏氨酸(Ser/Thr)蛋白激酶 B(Akt)是一种分子量约为60kDa的蛋白,它是磷脂酰肌醇3激酶(PI3K)下游底物。PI3K/Akt信号系统广泛存在于多种细胞中,参与细胞增殖、迁移、分化等调节功能[14,15]。研究发现PI3K基因的敲除鼠的Akt磷酸化降低,单侧肢体缺血后新生血管形成减少,EPCs整合到内皮网络及迁移的能力下降;eNOS是PI3K/Akt通路下游经典效应蛋白之一[16]。磷酸化的Akt有助于磷酸化下游区域底物内皮细胞一氧化氮合酶(endothelial nitric oxide synthase,eNOS),促进eNOS活化和NO释放;eNOS具有多种生物学功能:eNOS诱导血管内皮细胞产生的NO不仅在血管生成、调节血管张力上发挥重要作用,而且在抗动脉粥样硬化,抑制血小板聚集和单核巨噬细胞黏附,以及抑制VSMCs增殖等过程中也起着非常重要的作用[17]。为了明确硫化氢在高糖环境下对内皮祖细胞的功能改善作用的分子机制,我们对高糖环境下EPCs和NaHS预处理EPCs的蛋白水平进行分析,结果发现,高糖环境下EPCs的磷酸化Akt和eNOS水平较正常葡萄糖干预组明显下降,而NaHS预处理后,EPCs的p-Akt和p-eNOS水平均得到了一定程度的恢复,提示Akt/eNOS水平可能参与了NaHS发挥抗高糖环境下改善EPCs功能的作用。
综上所述,本研究证实了高糖培养液作用下内皮祖细胞的增殖、迁移、黏附等生物血功能出现明显下降趋势,而给予外源性硫化氢预处理后,通过Akt/eNOS途径发挥了上述生物学功能的部分上调作用,进而在体内实验中也正是了经过NaHS预处理后EPCs的再内皮能力可得到进一步提高。本研究为探讨硫化氢调控内皮祖细胞在高糖环境下的受损血管修复能力提供了理论依据和实验基础。
