花榈木组织培养植株再生体系的建立
2018-12-05,,,
, , ,
(1.贵州大学林学院, 贵阳 550025; 2.铜仁职业技术学院, 贵州 铜仁 554303)
花榈木(OrmosiahenryiPrain),又名花梨木,属蝶形花科红豆属常绿乔木,是国家二级重点保护植物[1]。其木材结构均匀,硬度适中,耐腐朽且花纹别致,色泽紫红光亮,是高档家具、工艺雕刻品和特种装饰品的珍贵高档用材树种[2];花榈木还是一种优良的园林绿化观赏树种和珍贵的中草药[2]。由于花榈木种质资源稀少,自然繁殖力低下[3]且种子采集十分不易,采用组织培养繁育种苗无疑是一种实用且高效的途径。目前关于花榈木的组织培养已取得一定的成效,高丽等[4-5]以花榈木幼苗胚轴为外植体,诱导出愈伤组织且产生了不定芽,并开展了花榈木茎段低温胁迫培养及耐冷性试验;乔栋等对花榈木组织培养中外植体的消毒方法进行了研究[6];姚军等[7]以花榈木种子为外植体,初步构建了花榈木组培体系。但以花榈木茎段为外植体的组织培养快繁体系还未建立。为此,本研究以花榈木萌发籽苗茎段为外植体,分别开展了基本培养基、丛生芽诱导培养基和生根培养基筛选、试管内外生根比较试验,以期建立完善的花榈木组织培养体系,为花榈木种质资源保存和实现工厂化育苗提供技术指导。
1 材料与方法
1.1 材 料
实验材料为人工气候箱内设置温度25 ℃,湿度60%,光照12 h/d条件下萌发10 d的健壮籽苗。
1.2 灭菌方法
采用乔栋等[6]的方法进行灭菌,将萌发10 d的籽苗除去根部,流水下冲洗干净,于洗涤剂溶液中浸泡15 min,用自来水冲洗30 min后转至超净工作台上备用,在超净工作台上先用70%乙醇浸泡30 s;再用0.1%升汞灭菌8 min;最后用70%乙醇浸泡30 s;期间用无菌水冲洗4~5次,即获得无菌材料。将茎段剪切为1~1.5 cm(带1~2个芽)长的外植体,待接种于灭菌好的培养基中。
1.3 基本培养基的筛选
以MS、B 5、WPM为基本培养基,分别添加激素6-BA 2 mg/L+NAA 0.5 mg/L,琼脂8 g/L,蔗糖30 g/L,pH调至5.8。每处理3次重复,每重复接种20瓶,每瓶接种1~2个外植体。从第14天开始,每7天观察记录1次外植体诱导和生长情况,60 d后统计试验结果。
表2 不同基本培养基对花榈木茎段初代培养的影响

培养基芽诱导率(%)芽数(个)14d生长状况28d生长状况61d生长状况基部褐化程度MS80.42±3.38bB6.43±0.45bB出现丛生芽点丛生芽生长迅速丛生芽多,芽生长健壮++WPM40.71±5.29cC4.33±0.23cC无明显变化无明显变化丛生芽较少++++B597.15±2.48aA11.67±0.29aA无明显变化大量丛生芽点丛生芽最多,芽较细弱---
注:“++”表示愈伤组织的褐化程度,“++++”表示褐化极严重,“---”表示基本无褐化;同列不同小写字母表示差异显著(p<0.05),
同列不同大写字母表示差异显著(p<0.01)。
1.4 增殖培养基的筛选
以初代培养的芽为外植体,MS为基本培养基,设计6-BA(0.5,1.0,2.0)mg/L和NAA(0.5,1.0,2.0)mg/L两因素三水平的全面试验,分别添加蔗糖30g/L,琼脂8 g/L,pH调至5.8。每个处理2次重复,每次重复接种20瓶,每瓶1~2个材料,以筛选增殖培养适宜的激素配比。每10天观察并记录1次外植体增殖情况,持续观察60 d。
1.5 试管内、外生根试验
1.5.1 试管内生根及移栽
将增殖培养中高于4 cm、基部粗度0.2 cm以上的健壮芽从组培瓶中取出,基部斜剪45°切口,垂直插入生根培养基中。设计以基本培养基、NAA、IBA和活性炭(AC)四因素三水平的正交试验(表1),选用正交表为L9(34),分别添加蔗糖10 g/L,琼脂8 g/L,pH调至6.0。每个处理2次重复,每次重复接种20瓶,每瓶1个外植体,每10天观察并记录外植体根系生长情况,持续观察60 d。在瓶内生根的植株中选择根数≥4条、根长≥5 cm且叶片数≥5片的健壮瓶苗30株,移至自然光下3~4 d,再打开透气膜于20~24 ℃常温下炼苗3 d,随后取出植株,洗净附在根系上的培养基,移栽至已高压灭菌消毒的混合基质(泥炭土∶蛭石∶珍珠岩为1∶1∶1)中,于遮荫率25%的条件下生长,定期浇水以保持基质湿度,观察记录移栽苗生长情况,45 d后统计成活率。
表1 试管内生根培养正交试验因素水平
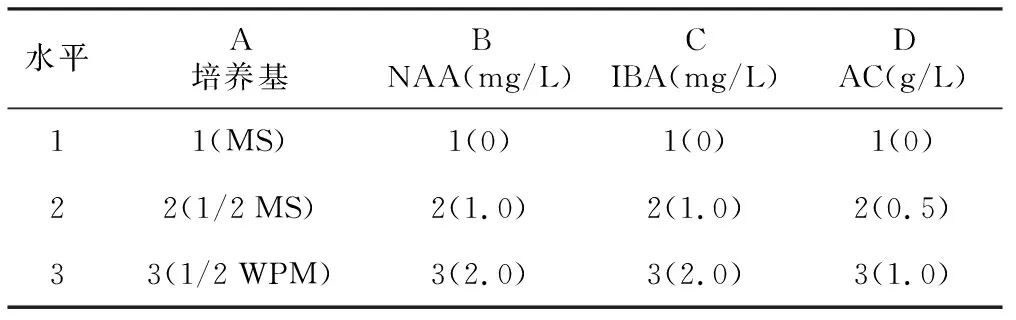
水平A培养基BNAA(mg/L)CIBA(mg/L)DAC(g/L)11(MS)1(0)1(0)1(0)22(1/2MS)2(1.0)2(1.0)2(0.5)33(1/2WPM)3(2.0)3(2.0)3(1.0)
1.5.2 试管外生根
试管外生根激素配比选用本研究得出的最适试管内生根激素条件:NAA 2 mg/L+IBA 1 mg/L。将丛生芽诱导中高于4 cm、基部粗度0.2 cm以上的健壮苗从组培瓶中取出,基部斜剪45°切口,置于生根液(NAA 2 mg/L+IBA 1 mg/L)中浸泡20 min,取出放置10 min后分别垂直插入纯蛭石、纯石英砂、蛭石∶泥炭土(1∶1)及石英砂∶泥炭土(1∶1)4种经高压灭菌的基质中,每基质扦插30株试管苗,于大棚内室温控制在22~26 ℃的环境中生根,保持基质湿度,45 d后统计生根率和根系质量。
1.6 培养条件
培养室温度保持(25±2)℃,光照强度3 000 lx,光周期为12 h/d。
1.7 统计分析方法
采用PASW statistics 18.0软件和Excel 2016软件共同对实验结果进行分析与统计。
2 结果与分析
2.1 不同基本培养基对茎段培养的影响
MS、WPM和B 5等3种培养基的诱导试验结果(表2)表明,B 5培养基中的丛生芽诱导率和芽数均最高,分别达97.15%和11.67个,诱导率分别比MS和WPM高16.73%和56.44%,芽数分别为MS和WPM的1.81倍和2.7倍。从芽诱导率、芽数和基部褐化程度评价最为理想的培养基应为B 5,但从后期的生长情况看,其丛生芽生长较细弱,不利于后续的增殖和生根培养。MS培养基中开始诱导丛生芽时间相对较短、芽苗生长健壮且1个月以后已逐渐具备转瓶生根或继代培养的条件,为花榈木初代培养最适宜的基本培养基。方差分析结果表明,不同基本培养基间丛生芽诱导率和芽数均存在极显著差异(p<0.01)。
同列不同大、小写字母分别表示差异极显著(p<0.01)和差异显著(p<0.05)。下同。
2.2 不同激素配比对茎段丛生芽诱导率的影响
试验结果(表3)表明:随着6-BA浓度的增加,平均增殖率逐渐升高,到2 mg/L时,平均增殖率为58.64%,比0.5 mg/L和1 mg/L水平分别高16.42%和40.86%;而随着NAA浓度的增高,平均增殖率逐渐下降,到2 mg/L时,平均增殖率仅14.19%,比0.5 mg/L和1.0 mg/L水平分别下降50.25%和25.8%。方差分析(表3)表明,培养基中不同浓度的6-BA和NAA对增殖率的影响极显著(p<0.01)。因此可得,高浓度的6-BA与低浓度的NAA组合对花榈木丛生芽的增殖效果较理想,即MS+6-BA 2 mg/L+NAA 0.5 mg/L为增殖培养最适宜的培养基。

注:A为瓶内生根;B为瓶内生根60 d根系;C为瓶外生根;D为瓶外生根45 d根系图1 瓶内外生根植株
表5 花榈木试管苗生根培养试验结果

处理A基本培养基BNAA(mg/L)CIBA(mg/L)DAC(mg/L)开始生根时间(d)生根率(%)根数(条)根长(cm)1MS0000±00.00±0.000.0±0.00.0±0.02MS110.50±00.00±0.000.0±0.00.0±0.03MS22117±457.15±0.004.1±0.10.8±0.241/2MS01143±450.00±10.114.0±0.62.4±0.651/2MS12033±464.29±10.103.3±0.43.2±0.361/2MS200.555±714.28±3.222.5±0.40.2±0.071/2WPM020.523±485.72±20.23.4±0.31.1±0.181/2WPM10119±285.71±0.005.4±0.52.3±0.491/2WPM21018±392.86±10.105.9±0.42.6±0.1
表3 6-BA和NAA不同浓度组合对增殖培养的结果

试验号6-BA(mg/L)NAA(mg/L)增殖率(%)10.50.533.33±9.4320.5113.33±0.0030.526.67±0.00410.573.33±9.4351140.00±0.0061213.33±0.00720.586.67±14.1482166.67±4.7192222.58±4.56
2.3 不同生根方式对花榈木试管苗生根效果的影响
2.3.1 试管内生根
花榈木试管苗试管内生根的结果(表5,图1 A、B)表明,在MS培养基中,试管苗存在少量生根或几乎不能生根,已生根的少量试管苗还存在叶片掉落现象;1/2 MS中虽都能诱导根系生成,但诱导率相对较低且根系质量差;在1/2 WPM培养基中,开始生根时间、平均生根率、根数、根长均优于其他培养基。激素NAA和IBA单独使用和搭配使用均能诱导生根,但搭配使用时效果较好,单独使用时,NAA生根效果优于IBA。从观察记录中发现,花榈木瓶内生根开始时间较晚且生长较慢,在17 d后才开始产生根突,45 d后根系生长才相对较快,60 d后趋于稳定,可见,花榈木瓶内生根培养1周期至少需要60 d。
表4 增殖培养试验方差分析结果

变差来源离差平方和自由度均方F值A2255.8621127.9325.19**B3323.6221661.8137.12**e5821344.77总和6161.4817
注:F0.05(2,13)=3.81,F0.01(2,13)=6.7
对试管苗瓶内生根率、根数进行直观分析,结果(表6)表明,四因素对生根率影响的主次关系为:基本培养基>IBA>NAA>AC,对根数影响的主次关系为:基本培养基>AC>NAA>IBA,最优组合均为A 3 B 3 C 3 D 3,即1/2 WPM+NAA 2.0 mg/L+IBA 2 mg/L+AC 1 g/L。为此,采用最佳理论组合A 3 B 3 C 3 D 3进行生根培养验证,设计2次重复试验,每次重复接种20个材料,结果得出A 3 B 3 C 3 D 3组合生根率为(67.50±10.61)%,平均根数为(3.8±1.0)个,生根效果不及实际试验得出的9号好,从试验总体观察中得到,幼芽在没有添加活性炭的培养基中的生长势优于有活性炭的培养基,可能是由于活性炭的吸附性,吸附了培养基中的营养物质所致。所以生根培养最佳的培养基应为9号,即1/2 WPM+NAA 2.0 mg/L+IBA 1.0 mg/L。方差分析(表7)表明,4因素对根数都有极显著影响(p<0.01),对生根率的影响,除NAA不显著外(p>0.05),其余3因素均有显著影响(p<0.05)。
表6 增殖培养的极差分析

生根指标因素水平1均值k1水平2均值k2水平3均值k3极差R绝对值 最优方案生根率基本培养基32.74 80.36 147.02 114.28 3水平NAA79.23 80.79 100.10 20.87 3水平IBA59.95 82.60 117.57 57.62 3水平AC88.20 63.99 107.93 19.74 3水平根数基本培养基2.7 6.5 9.8 7.1 3水平NAA4.9 5.8 8.3 3.4 3水平IBA5.3 6.6 7.2 1.9 3水平AC6.1 3.9 9.0 5.1 3水平
表7 花榈木试管苗生根培养方差分析结果

因变量变差来源离差平方和自由度均方F值诱导率基本培养基9885.57 24942.79 52.57**NAA405.24 2202.62 2.16 IBA2527.77 21263.88 13.44**AC1453.26 2726.63 7.73*误差846.20 994.02总和15118.03 17根数基本培养基37.80 218.90 137.89**NAA9.29 24.64 33.87**IBA2.93 21.46 10.68**AC19.37 29.69 70.67**误差1.23 90.14总和70.62 17
注:F0.05(2,9)=4.26,F0.01(2,9)=8.02。
将试管内生根健壮苗移栽至(泥炭土∶珍珠岩∶蛭石为1∶1∶1)基质生长45 d,结果表明,大部分植株已长出2~3片新叶,叶片颜色嫩绿,除3株植株前期萎蔫已经死亡外,其余植株长势均较好,成活率高达90%。
2.3.2 试管外生根
采用单一基质和混合基质共4种方式进行试管外生根45 d试验,结果(表8,图1 C、D)表明,与单一基质相比,混合基质更适宜花榈木瓶外生根。混合基质中平均生根率比单一基质高25.77%,平均根数是单一基质的2.77倍,其中以石英砂∶泥炭土(1∶1)基质生根率和生根数最为理想,分别达88.89%和4.7条,是花榈木试管苗瓶外生根的理想基质。从观察中发现,试管外生根16 d可见根突发生且根系生长相对较快,45 d即可长出完好根系且根系质量较好,有大量须根产生,相比瓶内生根,可节约生根时间15 d。方差分析结果表明,不同基质对瓶外生根率和根数均存在极显著影响(p<0.01)。
表8 不同基质对试管外生根的影响

基质生根率(%)根数(条)纯蛭石64.44±3.85cB1.6±0.2cC纯石英砂53.33±6.67dB1.4±0.1cC蛭石∶泥炭土1∶180.42±7.22bA3.6±0.4bB石英砂∶泥炭土1∶188.89±3.86aA4.7±0.4aA
3 瓶内外生根成本模拟与效益比较
由试验得出,花榈木试管苗生长较缓慢,生产一批花榈木组培苗从接种、生根到炼苗移栽,以最短时间计算,试管内生根需要225 d(诱导60 d,增殖60 d,生根60 d,炼苗移栽45 d),试管外生根需要165 d(诱导60 d,增殖60 d,生根45 d),采用试管外生根可节约60 d。
瓶内生根比瓶外生根多出的成本主要为培养基成本、人工成本和用电成本[8]。以提供1万株增殖无根苗为例,分别做试管内外生根,最终以效益产出作比较(表9)。其中试管无根苗按照试验中最佳的增殖方案培养所得,即在MS+6-BA 2.0+NAA 0.5+蔗糖30 g/L+琼脂8 g/L中进行2次增殖培养获得,每培养瓶接种2个材料,中途替换1次培养基,则共需MS培养基55 L,试管内生根需1/2 WPM培养基250 L。
按照市场价,花榈木苗10元/株,试管内生根率按92.86%,移栽成活率按90%,试管外生根率按88.89%计算,人工费150元/d、水费2元/t、电费0.6元/度,营养杯、基质和药品试剂均按市场价计算,以提供1万株花榈木试管无根苗,通过试管内生根及炼苗移栽最终可获得8 358株组培苗,试管外生根最终可获得8 889株组培苗,通过简易核算,前期成本约1 240.69元,瓶内生根成本约12 360.8元,瓶外生根成本约6 540.00元,则生产1株组培苗瓶内生根的成本是瓶外生根成本的2.34倍(瓶内生根方式约1.36元,瓶内生根方式约0.58元)。相比瓶内生根,瓶外生根可节约成本5 820.80元,提高收益18.7%。
表9 花榈木试管苗瓶内外生根成本计算
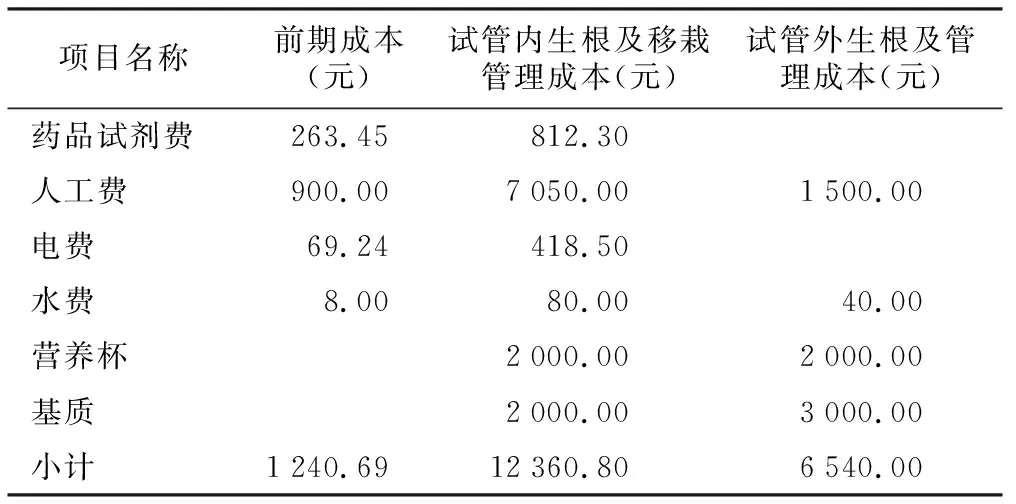
项目名称前期成本(元)试管内生根及移栽管理成本(元)试管外生根及管理成本(元)药品试剂费263.45 812.30 人工费900.00 7050.00 1500.00 电费69.24 418.50水费8.00 80.00 40.00 营养杯2000.002000.00 基质2000.00 3000.00 小计1240.6912360.806540.00
4 结论与讨论
4.1 结 论
MS为花榈木初代培养最适宜的基本培养基,初代培养的芽在培养基MS+6-BA 2.0 mg/L+NAA 0.5 mg/L+琼脂8 g/L+蔗糖30 g/L中进行增殖培养效果最好,增殖率达86.67%;瓶内生根最佳的培养基为1/2 WPM+NAA 2.0 mg/L+IBA 1.0 mg/L+琼脂8 g/L+蔗糖10 g/L,生根率达92.86%,平均根数达5.7根,将瓶内生根苗移栽至泥炭土∶蛭石∶珍珠岩(1∶1∶1)混合基质中,成活率达90%;瓶外生根采用NAA 2 mg/L+IBA 1 mg/L生根液浸泡试管无根苗基部20 min,在基质石英砂∶泥炭土(1∶1)进行试管外生根效果最好,生根率达88.89%;模拟计算结果得出,与试管内生根相比,瓶外生根可节约成本5 820.80元/10 000株,提高收益18.7%。
4.2 讨 论
选择适宜的基本培养基是组织培养成功的关键[9],通常高盐浓度的培养基利于启动和增殖培养,低盐浓度的培养基利于生根培养[10]。试验得出,花榈木组织培养所适宜的基本培养基与大多数植物类似,初代适宜为MS,生根培养阶段适宜为1/2 WPM。在初代培养诱导阶段,虽然MS为最佳的基本培养基选择,但存在一定的褐化现象,这可能与培养基中含有较高的无机盐浓度有关,通过降低培养基的pH值、缩短转瓶周期或在培养基中加入防褐化剂如PVP(聚乙烯吡咯烷酮)、Vc(抗坏血酸)、CA(柠檬酸)和AgNO3(硝酸银)等可有效防止褐化现象发生[11-12]。
培养基的种类对花榈木试管无根苗生根效果影响显著,这与邹英宁等和王军娥[13-14]的研究结果类似。花榈木试管无根苗在1/2 WPM+IBA 1.0 mg/L+NAA 2.0 mg/L的生根效果最佳,生根率达92.86%,研究结果表明,NAA与IBA单独或搭配使用都能诱导花榈木试管无根苗产生根系,但以搭配使用效果最好,这与何碧珠等[15]的研究结果一致。
试管苗瓶外生根把生根与驯化有机地结合起来,有效缩短了育苗周期,节约生产成本,相对于瓶内生根的组培苗来说,提高了移栽成活率,加速了种苗繁殖的进程,是一项在组培工厂化育苗中值得应用与推广的技术[16],大量试验证明,瓶外生根的生根率比瓶内生根率略低[17],本试验得出,花榈木瓶外生根率比瓶内生根率低3.97%,瓶内生根的苗要适应外界环境,需进行炼苗移栽驯化,花榈木炼苗移栽后存在10%的死亡率,因此,通过对瓶内外生根成本的模拟核算得知,瓶外生根可节约时间成本、经济成本和提高经济效益,应为花榈木组织培养最适宜的生根方式。
